
Daniel Dive
-
Compteur de contenus
49 -
Inscription
-
Dernière visite
Messages posté(e)s par Daniel Dive
-
-
Certe Michel, cela demeure de faible performances comparé aux vrais Sem ou Tem.
mais je serais déja heureux d'avoir un Sem de table 10 fois moins performant que celui-ci.
Aprés ca ne s'adresse pas aux meme publics.
Un Sem est a la base un microscope de recherche.....quoi que les microscopes photoniques aussi il me semble non ?
J'avais vu Ebay un Tm-1000 vendu sans logiciel a 45.000 euros.Gonfflé le gars de vendre un sem de table non utilisable a ce prix.Le vendeur l'a enlevé en moins de 10 jours,car les critiques allaient bon train aux vue des éventuels intérrésés.
A bientot
Laurent
le problème est que le micro n'est que l'instrument d'observation. Derrière; il faut aussi tout ce qu'il faut pour la fixation, la métallisation etc.... cela risque de coûter aussi cher que le micro, sans compter les réactifs à utiliser et la maintenance....
-
Mon collègue et ami de longue date, Christian Slomianny, à l’Université des Sciences et Technologies de Lille, va bientôt avoir un bien beau joujou. Dommage qu’il arrive un peu tard pour les dernières recherches que j’ai effectuées, Mais il m’a promis de me tenir au courant.
Mail du 6/12 de Christophe Biot, chimiste du médicament, Université des Sciences et Technologies de Lille, avec qui j’ai collaboré pendant seize ans.
Bonsoir Daniel
désolé de vous "embêter" de nouveau
Christian va avoir un JEOL 2100, 200kV, équipé pour la cryotomographie, l'analyse et la cartographie chimique élémentaire. Résolution 0,17 nm !!!
http://cmm.mrl.uiuc.edu/techniques/CMM_2100Cryo.html
une liaison C-C dans un peptide est de 150 pm! on va pouvoir voir les atomes!!!
bonne soirée
tof
Je pense qu’il y aura des personnes ici qui seront intéressées par cette information.
-
Bonjour Daniel,
C'est Marcel Lecomte !Bien connu sur ce forum et en vrai par ceux qui parcourent le Namurois.
Pour les inclusions, il dispose aussi d'alcool polyvinylique, je n'ai pas encore testé, mais c'est dans mes projets.
http://users.skynet.be/Champignons_passion/AlcoolPolyvinylique.htm
Pour les coupes, à la base, il faudrait savoir si l'on désire faire de la cytologie végétale ou animale.
dans nos débuts de microscopistes, on collectait du sureau pour en extraire la moelle, on la fendait pour insérer le sujet, en général une tige végétale, et on enfonçait le tout dans une bobine de fil.
Une fois le conduit de la bobine hydratée, il suffisait de pousser et de trancher avec ces porte-lame à rasoir disponibles dans toute papeterie.
Avec un peu d'entraînement, On parvenait ainsi à faire des coupes fines de tiges fragiles comme les orties sans écraser les épines.
Merci, c'est un plaisir de lire ta réponse. J'ai utilisé le microtome de Ranvier pendant des années, particulièrement en botanique, en effet. C'est un instrument qui permet de faire de très belles choses avec un peu d'entraînement. Malheureusement, tout ce matériel s'est perdu au cours de années, et je dois maintenant me rééquiper. Mais le plus difficile est de trouver les réactifs et colorants. Dans le coin ou je suis, la pharmacie n'a même plus d'alcool en stock, ne parlons pas du reste. Je pourrai obtenir un certain nombre de produits auprès de mes anciens collègues de labo, mais l'objectif prioritaire est de réparer ou remplacer mon microscope qui est cassé.
J'ai habité Bruxelles pendant 13 ans. On n'étaient pas loin, mais je ne connaissais pas ce site.
-
Bonjour! J'aurais,a noel, un vrai microscope (je me contente maintenant d'un jeu) et un microtome de ranvier. Ma question tourne autour de celui ci: pour pouvoir realiser les coupes, il faut placer l'echantillon dans de la paraffine apres l'avoir fixé (alcool) et enlevé l'eau... Mais la paraffine n'etant pas miscible a l'alcool, il faut, apres la fixation, placer l'echantillon dans un bain de xylène (dans certains site c'est du toluène)... J'ai lu dans cette adresse
http://www.microbehunter.com/wp/wp-content/uploads/downloads/2011/11/microbehunter_2011_11.pdf
c'est en anglais) que l'on pouvait remplacer le xylene par certaines huiles essentielles (a la base c'est sur les montages definitifs mais le resultat est le meme) , que je pourrais me procurer beaucoup plus facilement... Connaissez-vous cette technique (ou d'autres, bien sur) qui evite d'utiliser le xylene??? Et, une derniere question (désolé :P) est-ce que je pourrais remplacer la paraffine par de la cire de bougie incolore fondue??
Merci!! :P
Quelques remarques concernant ton post et ta demande.
Le microtome de Ranvier permet de faire des coupes d’environ 15-20 µm au plus fin. C’est beaucoup trop épais pour réaliser des observations de coupe à la paraffine classique, qui doivent être idéalement de 3 à 7 µm. En effet, on cherche avec les coupes à la paraffine, à avoir une couche de cellule seulement pour que l’image et les colorations soient bien nettes. De plus, le microtome de Ranvier se prête mal à accueillir des blocs de paraffine. Il n’est pas conçu pour cela à l’origine, mais plutôt pour couper du matériel directement, ou emballé dans de la moëlle de sureau, beaucoup plus tendre que la paraffine ou d’autres matériaux d’inclusion plus adaptés que la paraffine. Il est utilisé aussi avec un rasoir à main levée.
D’autres systèmes simples peuvent être aussi utilisés
http://www.microscopies.com/DOSSIERS/Magazine/Articles/WD-Tranchette/Tranchette.html
Pour les coupes à la paraffine, un microtome de type Minot est idéal, mais représente un investissement sérieux en achat et en entretien. On peut en trouver d'occasion. Le porte bloc et le support rasoir sont spécialement adaptés à ce travail. Ci- joint, un lien qui analyse bien les types de microtomes :
http://users.skynet.be/Champignons_passion/26microtomeCoupes.htm
En ce qui concerne la déshydratation, le toluène peut remplacer avantageusement le xylène. Il est moins cher et surtout moins explosif. La raison pour laquelle il faut traiter par le xylène est que l’alcool absolu, l’eau et la paraffine ne font pas bon ménage. Si les deux ne sont pas totalement éliminés, la paraffine devient spongieuse et impossible couper au microtome.
Pour la paraffine, il faut, pour avoir de bons résultats, une paraffine spéciale assez dure, et surtout qui fonde à assez basse température (55-60°C) sinon, le bloc est cuit pendant l’inclusion et inexploitable. La paraffine pour inclusion se trouve dans des magasins spécialisés. Les rognures de blocs de paraffine ayant servi à des inclusions sont en général très bonnes à utiliser, quand on peut s’en procurer. Je crois que la cire de bougie fond à une température trop élevée.
Il ne faut pas oublier qu’une fois les coupes à la paraffine effectuées, on n’a fait qu’une petite partie du travail, il fau déparaffiner les coupes, les coller, les réhydrater avant de pouvoir les colorer, puis les déshydrater à nouveau avant de les montrer de façon définitive. Là encore, on utilise de l’alcoll et du toluène en quantité appréciable.
http://histologie.euro-bioweb.eu.com/pages/etapesHistologie.html
http://www.microscopies.com/DOSSIERS/PRATIQUES/TPM-3/COUPARAF%20.htm
Le microtome de Ranvier permettra de faire de nombreuses observations de structures végétales et autres, mais pour de l’histologie animale, il est limité, à mon avis, à cause de l’épaisseur des coupes.
-
Merci pour cette analyse très complète et exhaustive.
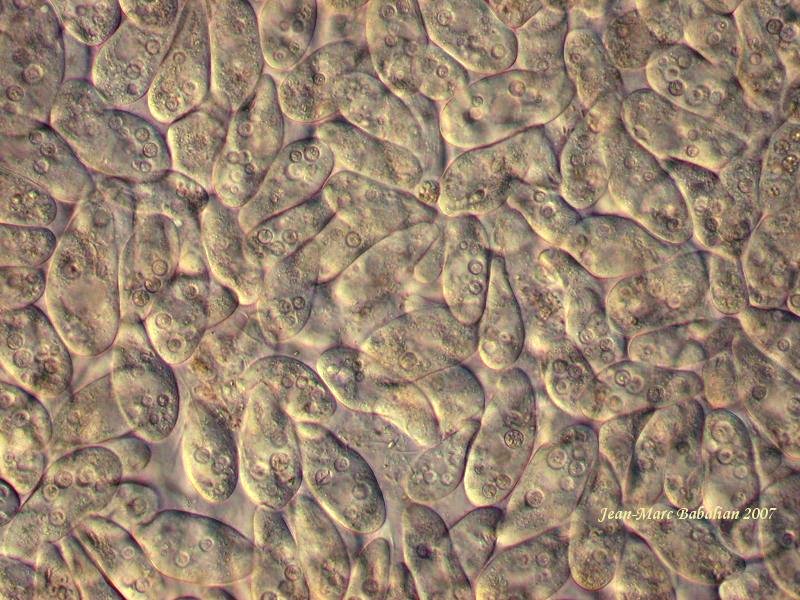
Je n'ajouterai qu'une chose, déjà soulignée dans mon protocole. Avant d'adopter le psyllium, j'avais aussi essayé la gomme et la carboxymethylcellulose. Ces deux produits perturbaient le comportement alimentaire des ciliés que je voulais étudier, et donnaient un fond laiteux aussi bien en contraste de phase qu'en contraste interférentiel. Ils n'assuraient pas non plus le maintien de cultures épaisses viables pendant plusieurs jours. C'est pourquoi, finalement, j'ai opté pour le psyllium. Les images du film montrent des activités alimentaires normales (formation d'une vacuole chez une vorticelle, paramécies et Colpidium bourrés de vacuoles digestives pleines de bactéries colorées) une mobilité normale, mais ralentie, et un fond sans voile, une image très nette, même à immersion. C'est ce qui a conditionné mon choix.
Amicalement
Daniel
-------------------------------------------------------------------------------------------
Bonjour Daniel, tous,
Au sujet des pectines:
Ta remarque est judicieuse pour obtenir la pectine à partir des trognons de pommes ou de coings, il faut les cuire.
Dans la fabrication de confitures, on fait un petit sachet de gaze contenant les pépins qui cuisent en même temps que les fruits.
A l'issue de la cuisson, on retire le sachet.
En effet je vois mal faire subir le même traitement aux cultures d'infusoire.
Mais on trouve sur le net de nombreuses recettes de "fabrication" de pectine sans pour autant faire de la confiture. Par exemple pour le nappage.
Je ne dis pas que çà marche, mais on peut toujours essayer en mélangeant une petite goutte de cette pectine avec le prélèvement.
Ceci dit, de nombreux microscopistes ont déjà expérimenté de nombreuses substances et je pense qu'il est plus efficace de mettre en oeuvre leurs recettes que de réinventer l'eau tiède. A moins de vouloir faire une recherche exhaustive à partir de tous les "épaississants" (Série de E4xx des additifs alimentaires) du commerce et de toutes les plantes à mucilages .
Langeron dans son édition de 1949 cite les travaux de Statkewitsch dans lesquels l'auteur fait la différence entre :
1 substances muco-colloîdales parmi lesquelles on trouve
- Plantago psyllium
- graines de cognassier
- gomme d' Astragale
- Les Caragahen (fucus crispus)
- gomme de cerisier
- gomme arabique
- l'agar agar
2 -les substances protéo-colloidales
- Gélatine
- albumine
- Amidon
- dextrine
C'est le premier groupe qui a sa préférence car elles se dissolvent facilement à l'eau froide et ne sont pas toxiques.
Et parmi elles les trois premières sont particulièrement appréciées .
La première étant en tête.
Mais d'après Langeron, le meilleur ralentisseur serait la Méthylcellulose.
On peut donc mettre dans le peloton de tête Methylcellulose, graines de Plantago psyllium , de Cognassier et la gomme d'Astragale, si j'ai bien compris, mais il reste d'autres solutions.
Langeron citant Statkewitsch indique qu'il faut placer un gramme de graines de coings dans 50 grammes d'eau et on obtient rapidement un milieu très consistant et pour les graines d' Astragale , on met beaucoup moins de graines.
Pour le Plantago psyllium il faut mettre 1 à 2 cm de graines dans un vase contenant 5 à 10 ml d'une solution riche en infusoires ce qui rejoint le protocole de Daniel.
Statkewitsch indique qu'il y a trois degrés dans ses solutions (liquide, sirupeux, colloïde ) ce qui correspond aux trois mélanges de Daniel et je suppose que chaque concentration apporte des enseignements différents et complémentaires.
Ce que ne dit pas Langeron (et Statkewitsch ) ce sont les comportements optiques de ces substances par rapport au CID puisque celui-ci n'existait pas.
Adoptons donc les méthodes approuvées (celle décrite par Daniel dans le sujet ) nous y gagnerons en efficacité et rapidité...
Amitiés.
-
Bonjour Guy,
Je viens de me renseigner sur les pommettes, la gelée à l'air très appétissante!
C'est curieux, je n'en avais jamais entendu parler. Il n'existe ici que des pommiers à fleurs, décoratifs dont les fruits ne sont pas comestibles, sauf pour les merles.
Comme les pommes, les pommettes doivent avoir des pépins et donc de la pectine.
Amitiés.
-------------------------------------------------------------
Les coings et les pommes c'est bien, mais toute personne qui fait des gelées ou des confitures, utilise un temps d'ébullition minimum pour que la pectine se libère en abondance. je crois pas que les protozoaires supporteraient de bon coeur ce traitement.
Pour la gélatine, la viscosité varie beaucoup en fonction de la concentration en gélatine, et surtout en fonction de la température. à partir d'une certaine concentration, la préparation se solidifie à température ambiante et se liquéfie à des températures supérieures à 30°C. Je ne suis pas sûr non plus que la gélatine n'introduise pas d'opalescence en contraste de phase ou en contraste interférentiel (je n'ai pas vérifié personnellement).
Je sais que le psyllium est plus difficile à se procurer que la gélatine, mais il a réellement fait ses preuves à maintes reprises. J'ai trouvé ce protocole dans une édition du précis de microscopie de Langeron datant de 1918 et je l'ai adaptée à mes propres besoins.
-
Merci Daniel,
Ta technique d'observation avec du psyllium fonctionne à merveille.
Je m’en suis procuré en pharmacie, je le saupoudre sur la préparation.
Les rotifères ne semblent pas l’apprécier par contre.
Bonne journée, Guy
Merci. je n'avais pas trop de doutes, ayant utilisé cette technique prendant de nombreuses années.. Essaie de nous faire des photos ou une petite vidéo de démonstration. Je suis totalement en panne de microscope pour l'instant et je peux absolument rien faire en plus en absence de caméra...
Je ne suis pas étonné pour les rotifères qui sont des organismes beaucoup plus complexes et qui doivent avoir des problèmes de régulation osmotique, ou être intoxiqués par le mucilage. Je n'ai proposé cette technique que pour les protozoaires, en particulier les cilés nageurs dont beaucoup ne peuvent pas être observés avec précision sans être ralentis.
j'ai pu faire des observations sur des holotriches, des hypotriches et des péritriches avec cette méthode... J'ai pu observer aussi une fois une euglène, et j'ai constaté que les bactéries mobiles étaient ralenties.
Amicalement
Daniel
-
-----------------------------------------
En culture stérile, avec Colpidium campylum, il est possible de dépasser 300 000 cellules/ml soit 15000 ciliés dans une goutte de 50 µL. Avec Tetrahymena il est possible d'atteindre, en fermenteur avec nutrition continue et filtration-épuration du milieu par microfibres, plus de 3 000 000 cellules/ml, soit 150000 cellules dans une goutte de 50 µl. cela peut paraître à peine croyable, mais cela a été publié et vérifié.
Colpidium colpoda est plus gros que ces deux espèces, il est donc possible que la densité maximale soit plus faible. La population maximale est en général limitée par l'épuisement de la nourriture disponible.
-
Merci pour ce post Daniel,
ça fait du bien après une journée de boulot de tomber sur une technique (je suis aussi amateur de pond water) que je vais tester lors de mes prochains congés.
Un peu un avant-goût de vacances.
je connaissais la gomme arabique, mais pas l'infusion de plantain.
Juste une question, à l'état vif, tu fais un montage humide (wet mount) ou juste entre lame et lamelle.
Si tu fais un wet mount, l'eau va diluer le tout et les organismes vont retrouver toute leur mobilité. Il faut prendre le gel formé et le mettre entre lame et lamelle. Pas toujours facile car il peut être très visqueux et épais à aspirer. C'est pourquoi je préconise plusieurs ratios graines/culture afin d'avoir des consistances différentes et une plus ou moins grande rapidité à obtenir le gel. La lamelle aplatit la gouttelette et on observe directement..
J'observais avec un Orthoplan, en double immersion (lentille condenseur à immersion), avec un contraste interférentiel Normarski et d'un éclairage au xénon 250W, car la caméra était, en ce temps là, très exigeante en lumière.. J'avais un zoom intégré dans le micro qui m'a permis de monter jusque 3500 en grossissement (valeur de zoom 1.6)sans perdre de netteté. Je voulais récupérer ce microscope pour ma retraite, malheureusement,pour cause d'usage intensif et intempestif en routine de labo, il a été abîmé et il n'était plus possible de réparer ou de remplacer les pièces endommagées, en particulier un objectif à immersion aprochromatique qui était une merveille. Les lampes normales d'éclairage était déjà très difficiles à trouver depuis plus de cinq ans.
Bon courage et bonne chance pour les manips...
Amicalement
Daniel
-
Bonsoir et merci pour cette recette :)
j'aurais juste deux questions:
- ou trouves t'on des graines de plantain (dsl si la question peut paraitre stupide :( )
- as tu déjà essayé avec des flagellés et/ou des straménopiles ?
-----------------------------------
On trouve des graines de plantain chez les herboristes, mais elles sont aussi en vente sur internet, car elles ont une application pour les problèmes de transit digestif. On entre avec le mot clé Psyllium et on trouve des liens facilement.
Je n'ai essayé cette méthode que sur des ciliés, mais je ne vois pas pourquoi cela ne marcherait pas avec des flagellés... il faut essayer... et faire une note là dessus si cela marche... ce serait en effet très intéressant.
Bon courage et bonnes expériences..
-
Les protozoaires sont des animaux fascinants à observer, tout autant que rebutants , car souvent leur vitesse de déplacement gêne considérablement l’observation à fort grossissement.
Je vous livre deux petits trucs que j’ai utilisés pour pouvoir filmer les infusoires avec une caméra à 24 images/seconde dans le film « phénomènes d’autoépuration dans les eaux ». J’ai pu aussi ainsi observer l’endocytose (ingestion de particules alimentaires ou non).
Observations des protozoaires à l’état vivant
Matériel :
-suspension abondante d’infusoires (Paramecium, Tetrahymena, Colpidium, Colpoda, Hypotriches, Péritriches, etc…) ou de tout autre protozoaire très mobile.
- graines de Plantain (de préférence Plantago ovata, plantain des indes ou Psyllium).
- tubes à hémolyse ou petits tubes quelconques.
- pipette Pasteur ou équivalente.
Manipulations
1) Disposer dans trois ou quatre tubes une petite quantité de graines de plantain (1 volume).
2) Ajouter dans chaque tube respectivement, un volume, deux volumes, trois volumes de suspension d’infusoires
3) Laisser reposer. Le mucilage du plantain absorbe l’eau de la culture et gonfle progressivement, rendant le milieu de plus en plus visqueux, d’autant plus visqueux qu’il y a moins de liquide par volume de graine.
4) Avec le tube 1/1 (volume/volume) on peut faire les observations assez vite, dès que les graines semblent avoir absorbé le liquide. Pour faire les meilleures observations, il est préférable d’attendre que le contenu des autres tubes s’épaississe, car les protozoaires s’accoutument mieux et leur comportement est moins perturbé.
5) Prélever à la pipette une goutte (parfois très visqueuse) de la préparation. La déposer sur une lame. Recouvrir d’une lamelle. Observer au microscope.
Dans ces conditions, le mouvement des infusoires est considérablement ralenti et on peut observer les animaux vivants avec un objectif à immersion sans problème….
La technique présente des avantages par rapport à la carboxyméthylcellulose (Methocel et autres) et à la gomme arabique.
- Elle n’est absolument pas toxique pour les infusoires qui continuent à se déplacer et s’alimenter normalement. On peut même observer des divisions.
- On peut conserver les cultures épaissies plusieurs jours sans autre inconvénient que celui de la prolifération de grosses bactéries spontanément présentes à la surface des graines, qui ne gênent pas l’observation. Elles donnent des sujets d’étude complémentaires par leur mobilité.
- Contrairement à la carboxyméthyl cellulose et à la gomme arabique qui donnent un voile laiteux en contraste interférentiel Normarski, le gel de plantain est absolument transparent et cristallin et permet les observations avec des techniques comme le contraste de phase ou le contraste interférentiel.
Observation de l’endocytose chez les infusoires
Matériel
- Tubes hémolyse ou équivalent
- Une suspension abondante d’infusoires
- Eau distillée
- encre de chine (de préférence en tube avec poussoir caoutchouc)
Manipulation
1) Diluer une goutte d’encre de chine dans 5ml d’eau
2) Ajouter un volume de la dilution à un volume de suspension d’infusoires (pour faire 1 à 2 ml au total). C’est le temps zéro de l’expérience.
3) Aux temps 5, 10 et 15 mn, prélever quelques gouttes de la préparation, la fixer et observer entre lame et lamelle.
4) Après 15 mn Prendre une partie de la préparation et l’épaissir avec des graines de psyllium (1/1 ou ½ V/V)
5) Garder les préparations normale et épaissie à température ordinaire.
Observations
Les ciliés endocytent les particules noires de l’encre de chine et forment des vacuoles digestives qui apparaissent en noir sur le fond clair de la cellule. En travaillant à différents temps, on peut compter le nombre de boules noires dans les individus et comparer, par exemple, le temps de formation d’une vacuole chez la paramécie, la vorticelle ou Tetrahymena, par exemple. On peut montrer aussi que sur les quinze premières minutes, en général, la vitesse d’endocytose est constante.
Sur les préparations épaissies au psyllium, on peut passer à l’immersion et observer la formation de la vacuole digestive au fond de l’entonnoir buccal, au niveau du cytopharynx. On voit une accumulation progressive de particules noires et on peu aisément observer le détachement et l’individualisation de la vacuole digestive.
Si on garde les cultures suffisamment de temps et si la population de ciliés est abondante, on pourra observer l’éclaicissement du milieu qui indique que les particules d’encre de Chine ont été ingérées. Les infusoires sont alors littéralement bourrés de vacuoles noires.
Remarque :
L’encre de Chine peut être remplacée par des bactéries colorées. Je n’ai jamais essayé le bleu de méthylène qui peut diffuser, mais j’ai coloré des cultures bactériennes avec du chlorure de triméthyl tétrazolium qui est réduit par les bactéries en formazan rouge insoluble. Ce sont de telles bactéries qui ont été utilisées dans le film « phénomènes d’autoépuration dans les eaux ». Cela explique que les vacuoles des Colpidium et des paramécies sont colorées en rouge. Les graines de Psyllium m’ont permis de réaliser les prises de vue à l’immersion sans problème, les animaux étant considérablement ralentis, mais gardant un comportement normal pendant plusieurs jours.

HITACHI TM-3000
dans MEB - MET et autres ME
Posté(e)
merci pour l'information. j'étais persuadé que pour le balayage, il était nécessaire de préparer un minimum l'échantillon. On apprend tous les jours.
Amicalement
Daniel