-
Compteur de contenus
268 -
Inscription
-
Dernière visite
Messages posté(e)s par scrophulaire
-
-
Bonjour,
Avec le violet de gentiane, il faut régresser avec de l’alcool acétifier 20 a 30 seconde. Le cytoplasme sera incolore et l’ADN violet .
A+
-
Bonjour
Très belle article.
J’utilise le limonène de Roth. Le produit desparaffine bien mais c’est un peu long et plus de rinçage.
A+
-
Bonsoir,
Oui tous ceci est bien, mais il faut aussi ce poser la question pourquoi a t-il grillé?
Soit il était en fin de vie et il a grillé.
Soit il y a un court circuit et en le remplaçant, il se produira la même chose.
Un ohmmètre pour vérifier la la resistance est suffisant. (zéro si court circuit)
Salutations
-
Bonsoir,
Merci pour ces techniques, mais il me semble difficile à réaliser également. N’ayant pas d’azote liquide pour refroidir, je me vois mal Vider mon congélateur pour travailler à l’intérieur avec mon microtome afin de trancher la cervelle d’un pigeon.
D’autre idée ?
Salutations
-
Bonjour,
Belle présentation.
C’est une des coupes que je veux faire mais la déshydratation habituelle me semble pas adaptée. En effet , l’alcool dissous les lipides dont les neurones en sont riche. C’est peut être la raison que vous ne voyez pas les neurones . Je n’ai pas trop cherché mais quelqu’un connaît il un protocole pour les coupes?
J’ai pensé au peg. Mais je n’en ai pas.
Dans l’attente
-
Bonsoir,
Avez vous déjà essayé le carbure de calcium ?
A+
-
Bonsoir,
Bizarre qu’il y ait rupture de stock. Par contre, ils ne veulent peut-être pas le vendre au particulier car comme l’acide picrique, les phosphates potassique sert à faire de l’explosif.
Tu nous cacherais pas quelque chose professeur tryphon.????.
A+
-
Bonjour tryphon, Jean Marie,
Oui c’est bien 13,609 g par litre de cristaux et oui il faut compléter le volume à un litre.
Dans la pratique, tous dépend de la masse volumique des cristaux et de leurs activités :
Si forte masse volumique mettre directement 1 l sinon corrigé
Si forte activité de la substance ( enzyme) alors qsp a 1 l.
Merci pour ce petit rappel historique que je ne me souvenais plus.
Salutations
-
Bonjour tryphon,
Je pense que tu connais très bien toute ces formules mais je vais rappeler pour certains jeune du forum.
Pour la mole, je rassure tout le monde, pas besoin d’être chimistes pour la manipuler comme pour le mètre, il ne faut pas être physicien pour tracer un très sûr une feuille avec une règle. ( nos chères bambins l’apprennent à 7 ans )
La Mole est un étalon : selon la définition dito Wikipedia :
La mole (symbole : mol) est une des unités de base du Système international, adoptée en 1971, qui est principalement utilisée en physique et en chimie. La mole est la quantité de matière d'un système contenant exactement 6,022 140 76 × 10puissance 23 ( nombre d’avogadro) entités élémentaires (atomes, ions, molécules, etc.)
Me demander pas pourquoi elle est défini comme ceci, je ne le sais pas. Pas plus que le mètre fait une certaine longueur ou que le kilo fait un certain poids.
Le but de l’étalon est que tout le monde parle de la même chose sur la terre.
Pour le nombre d’avogadro dito Wikipedia :
Jusqu'au 20 mai 2019, le nombre d'Avogadro (donc aussi la mole) est défini comme le nombre d'atomes de carbone dans 12 grammes (10−3 kg) de carbone 12, le kilogramme étant lui-même défini comme la masse d'un étalon international. Sa valeur est mesurée à :
NA = 6,022 140 857(74) × 1023 mol−1.
À partir du 20 mai 2019, le nombre d'Avogadro devient une constante fixée par convention, qui définit la mole :
NA = 6,022 140 76 × 1023 mol−1, exactement.
Le kilogramme étant alors défini en fixant les valeurs de trois constantes (la période de la radiation correspondant à la transition entre les deux niveaux hyperfins de l'état fondamental de l'atome de césium 133 à la température du zéro absolu, la vitesse de la lumière et la constante de Planck), le nombre d'atomes de carbone contenus dans 12 g de carbone 12 reste sujet à la mesure (laquelle est encore en cours d'améliorations importantes), mais n'a plus de nom particulier.
Comme pour tous les étalons, le bureau international des étalons effectue des recherches très important pour trouver des mesures répétitives et contantes de ces étalons
A+
-
Bonjour Dominique,
Merci pour ces essaies.
Comme tu le sites la palette de couleur est plus étendue du fait que les mordants modifient l’affinité des molécules pour les colorants.
Un même colorant peut faire un liaison faible avec une molécule ( bleu alcian) et une liaison forte via mordant ( passage au vert dans ton cas) ou vis versa.
De plus, si tu gardes tes lames, elles devraient se conserver plus longtemps. Mais je n’est pas testé car je suis trop jeune pour le savoir ????.
A+
-
Re,
Pour faire vos solutions tampons voir adresse ci dessous
https://www.lachimie.fr/solutions/phmetrie/recette-solution-tampon.php
Les produits se trouve sur internet à moins de 10 euros
Sinon autre possibilité, prendre des solutions tampon pour étalonner les pH mètres. Aussi le prix est de 10 euros
A+
-
Bonjour à tous,
Je me suis déconnecté quelques temps, donc mille excuses pour le retard.
Je me suis toujours posé la question d’une solution tampon pour ces colorations. En effet, la solution tampon permet de maintenir le pH si nous avons un excès de base ou d’acide. Mais, quand nous recouvrons une lame avec 3 ml de solution à pH 7 pour un volume d’eau cellulaire de 1 micro ou pico litre , je ne pense pas que le pH varie beaucoup.
Je pense que ces solutions sont utilisées surtout pour:
- un gain de temps car les solutions pH 7 ne sont pas stable ( varie avec la température, les ions, les bactéries...) il faut vérifier au pH mètre qu’il faut calibrer etc...vive le prêt à l’emploi
- de plus, tous ce qui est analyse est soumis à des normes et protocoles très stricts pour comparer. Donc font appel à ses tampons. Les laborantins qui analysent les lames de sang garde également les mêmes marques de colorant car les couleurs différentes d’un fournisseur à l’autre.
A+
-
Ok Dominique,
Je ne pensais pas que tu triais les coupes. Je pensais que tu mettais directement les coupes sur la lame pour collage.
Effectivement, tu a du passer beaucoup de temps.
A+
-
Bonjour Dominique
C’est magnifique et vraiment pas facile à faire.
Comment procède tu pour des objets aussi petit après la coupe au microtome ?
A+
-
Bonjour Dominique,
j’ai regardé les formules chimiques des produits et je n’aurais pas procédé ton essai de cette façon.
L’acriflavine et l’acridine sont des colorants basique donc
j’aurais fixé par un agent réducteur sans ion métallique style formole à 4 % 2 min,
Je rince à l’eau puis je fait agir les deux colorants basiques.
Je verse l’excès de colorant et j’ajoute du lugol 1 min.
On différencie si il faut.
Je mordance a l’alun, au chrome, au cuivre ( un ion métallique)
Je rince et fait agir le bleu alcian ( noyau porphyrine qui chelate les ions)
Voilà
Tout fois très interessant le changement de couleur du bleu alcian par remplacement du cuivre par l’aluminium.
Sinon, sujet remarquable comme d’habitude.
Salutations
-
bonjour,
j'ai re-lu les protocoles et pour pour moi il manque un détaille mais qui est essentielle dans les colorations métachromatique et panoptique (dans ton cas le Giemsa). L'eau déminéralisé (bien) doit surtout être neutre. En général les laboratoires utilise des tampons à ph 7. Pas défaut prendre de l'eau en bouteille à ph 7 (écrit sur les étiquettes à l’arrière) ou en faire.
Eau Neutre : Prendre de l’eau pour fer à repasser (déminéralisé) et mettre quelques cristaux de rouge neutre.
Préparer à coté: de l’eau pour fer à repasser avec de l’acide acétique à 1% et de l’eau pour fer à repasser avec du carbonate de soude à 1%.
Ajuster jusqu’à ce que l'eau soit orangé = pH7.(sinon jaune ou rouge). Pour apprécier la couleur prendre du verre transparent et une feuille blanche derrière.
Salutation
-
Bonjour,
Pour répondre à Dominique, voici les principes de coloration en microscopie. Bonne lecture.
Colorants directs :
Il n'y a qu'à mettre le colorant en présence de la substance, dans un milieu convenable (solution) :
· Pour les colorants dits "substantifs", des liaisons hydrogène ou des liaisons de Van der Waals suffisent. En général, ce type d'association est faible et la teinture n'est pas solide.(avec le bleu de méthylène sur cellulose ou fibre protéinique). Cependant, si les dimensions de la molécule de colorant sont adaptées à la structure du produit à teindre, on obtient un résultat convenable. C'est le cas de plusieurs bis-azoïques sur la cellulose. Ainsi le rouge congo teint parfaitement la cellulose.
· Pour les colorants acides et basiques, il s'agit de véritables réactions chimiques acide-base avec des fonctions présentes sur le support.
Colorants acides :Leur molécule comporte une ou plusieurs fonctions acide ; en solution il apparaît donc des anions -CO2 - , -SO3- , -O- …..d'où leur appellation : colorants anioniques.Ils forment des liaisons ioniques avec des supports à sites cationiques, essentiellement –NH3+ et plus généralement des fibres protéiniques ou des polyamides en milieu acide.
exemple l'acide picrique, safran sont des acides fort.
Colorants basiques : Ils comportent des cations d'où leur autre appellation : colorants cationiques, essentiellement NH3+ . Ils forment des liaisons ioniques avec des supports à sites anioniques, notamment les -CO2 - , -SO3- , -O-.exemple le violet cristal, vert malachite
· Avec les colorants dits "réactifs", il se produit une réaction chimique entre le colorant et la substance, Il s'établit des liaisons covalentes. La teinture est très résistante mais ce procédé n'est pas très courant car il met en jeu des molécules qui ne sont pas très répandues.
Colorants par mordançage :
La fixation du colorant s'effectue par l'intermédiaire d'un "mordant", espèce qui assure le lien entre colorant et la substance. Le mordançage augmente l’affinité du colorant pour les structures à colorer (élective). Il peut changer la couleur finale de la coloration (différentiation). En pratique, le choix de la méthode repose sur diverses considérations : possibilité de réaction, teinte recherchée et également toxicité de certains éléments (Cr3+). On distingue
Onchrome : Le mordant est appliqué en premier, suivi du colorant. L'hématoxyline de fer de Heidenhain en est un exemple classique.
Métachrome : Le mordant et le colorant sont mélangés puis appliqués. Des solutions d'hématoxyline d'alun sont appliquées comme ceci. C'est probablement la façon la plus courante d'utiliser des colorants mordants en histotechnologie.
Afterchrome : Le colorant est appliqué en premier, suivi du mordant. Ce n'est pas souvent appliquer en histotechnologie,
1) Mordant Oxydants : Les mordants Oxydant on pour rôle de neutraliser les tissus réducteurs qui empêchent la coloration. Ces intermédiaires sont de deux types :
· Oxydants métalliques : Les ions métallique : Al3+, Cr3+, Fe3+, ou Fe2+, Cu2+ chélaté sont relié à la fois à la substances et au colorant. Les mordants sont
-soit des fixateurs à base de sels chromiques (Ac Chromique), d'acétate d'aluminium, de sels ferriques, de sel Osmique:Fixateur de Van Tellyesniczky, Fixateur de ZENKER soit des solution, Fixateur de HELLY. (On utilise Ac Chromique (K2Cr2O7 )mais c’est Cr3+ qui est présent dans le complexe ; la réduction peut se faire grâce à l’acide formique (COOH réducteur ) employé pour ajuster le pH.)
-Soit des solutions a appliquer avant les colorants : d'alun, Phosphomolybdique, Phosphotungstique, azoique. Agit dans la différenciation
· Polyphénol :Les liaisons font intervenir les doublets des atomes d'oxygène, donneurs d'électrons -OH, -O - .Ou encore les hydrogènes des –OH (liaisons hydrogène).
-soit des fixateurs ex Bouin l' Ac Picrique est un mordant et différenciateur avec des colorants acides.
Ex le formol :AFA de LOcquin
- Soit en Solution dans les colorants : l'aniline : safranine et violet de gentiane aniliné, l'ac phénique : Cristal violet Phéniqué (dans les colorants bactériologique),
Les Tanins agissent avec les colorants acide (orange G...) pour différentier les couleurs basiques qui donnent des sels polyacide solubles. Les tanins sont des polyphénols présents en abondance dans certains arbres : chêne (notamment dans les galles), châtaignier. Ce sont des hétérosides mais leur hydrolyse libère facilement deux molécules fondamentales : l'acide Gallique et l'acide ellagique. Par leurs multiples fonctions phénol ou phénate (en milieu alcalin) ils peuvent produire des chélations ou donner des liaisons hydrogène, autant de "dents" pour accrocher la cellulose ou les protéines d'une part et certains colorants d'autre part.
L'ac gallique est utilisé dans les coloration argentique,
2) Mordant Métalloïde :
· Métallique Incorporé : Le principe est de faire agir un sel métallique à chaux sur un colorant de base. Le colorant est dit « pré-métallisé » par chélation du sel sur la molécule colorante. Il forme une sorte de gel que l'on appel une Laque. Une laque est défini comme un complexe de coordination formé entre un ion métallique polyvalent et certains colorants. (même principe que l'hémoglobine). Souvent l'incorporation du sel entraîne un changement de couleur très soudaine et spectaculaire.
Alun de potasse (sulfate double d'alu et de K) et alun de fer ( sulfate double d'alu et de sesquioxyde de fer). Il forme une laque (intensifie la couleur) avec Hematoxyline et l'ac carminique qui on des propriétés électives. (Alun de fer)
· Métallique dissociable : Ce sont des colorants qui se fixent sur les substances mais qui ne donnent une teinte définitive stable qu'après avoir été trempés dans une solution d'ions métalliques ( sels basiques ou des sels neutres insolubles).
-soit des fixateurs : le sulfate de Cu de sulfate de cuivre (CuSO4). Chlorure de platine, de zinc, de mercure : Fixateur de Helly, FAA
- Soit en Solution avant coloration : Permanganate de potassium (cytologie), Iode (cristal violet en bactériologie).
- Soit en Solution après coloration : sulfate de fer (coloration à l'argent), Iode : utiliser sous forme de lugol ou teinture soit pour renforcer les couleurs (vert de méthyles, bleu victoria).
Il faut l'éliminer par lavage à l'eau car il détruit les colorations.
3) Mordants Basiques : ce sont des accentuateurs de colorants. On trouve le carbonate de potassium, l'ammoniaque, bicarbonate de soude, potasse caustique, borate de sodium. Dilution (1/10000)
On réserve l'appellation "colorants au soufre" à des substances organiques soufrées qui teintent les subtances parce qu'elles ont été retenues au sein de celles-ci grâce à une insolubilisation.
Le produit de la fixation du soufre sur une molécule appropriée (parfois un mélange de deux molécules différentes) est insoluble dans l'eau. On peut lui donner une forme soluble en le réduisant par action du sulfure de sodium en milieu alcalin. Il est alors apte à être absorbé par la substance.
Utilisé dans les colorations argentique avec
Soufré : métabisulfite de potassium, hyposulfite de sodium
Colorant nitrate d'argent ou chlorure d'or (osmium ou platine en microscopie électronique)
Oxydant hydroquinolone, formol
-
Bonjour Dominique,
Très belle présentation des principaux types de coloration de végétaux.
Je me pose une question sur le protocole de préparation des coupes avant coloration.
Tu dénatures les cellules ( vide le plasma) au dakin puis on fait un bain au vinaigre pour acidifier la cellule ce qui améliore la fixation du colorant: là ok
Mais pourquoi le AFA?
Ok il est un peu acide mais bon, normalement on l’utilise comme fixateur ( gélifier ou agglutiner les protéines) donc:
Soit on l’utilise pour conserver le plasma mais on ne dénature pas au dakin.
Soit on l’utilise avant de dénaturé mais je pense que ça ne sert à rien car la cellulose, lignine sont des polymères stables.
Reste le sulfate de cuivre qui peut formé une laque avec les colorants mais il n’est pas réputé pour ça. Il faudrait plus essayer avec de l’alun ou iodure de potassium ou chlorure de mercure ?
Salutations
-
bonjour,
merci pour ce travail qui je l'espère sera utile à tous.
A+
-
Bonjour,
oui les modes opératoires
A+
-
Bonjour Dominique,
Super démonstration. Très belle coloration.
Je suis toujours à l’affût de coloration.
Si tu pouvez me transmettre les protocoles que tu utilises :
Le trichrome de Gill
Le trichrome de Golner ( vert lumiére ) = Goldner ?
Le trichrome de Gomory
Je ne peut pas t’envoyer de mails pas MikrOscOpia. Bizarre
Remerciements
-
Toujours très instructifs
-
Salut klaus,
Peut on connaître la nouvelle formulation de ta coloration?
Merci
-
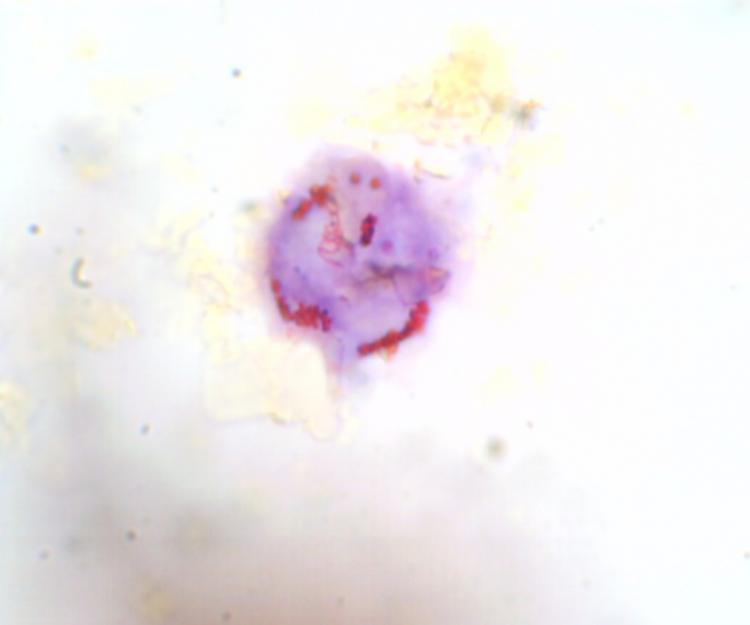
Voici quelques exemples:
Noyau de cellule d’orchidée x100/1,25 coloration au cristal violet aqueux réduit à l’orange de méthyle
Nous observons l’adn Condensé et les nucléoles
 E6D24B23-FC14-4DB3-85A6-EB63015586D9.jpeg
E6D24B23-FC14-4DB3-85A6-EB63015586D9.jpegAmyloplaste de banane coloré à l’iode
 0D7F9FF0-608B-46EE-8A6E-14B0D242D606.jpeg
0D7F9FF0-608B-46EE-8A6E-14B0D242D606.jpegColoration argentique de notre ami du forum pour le rendu du détail
 A3822C16-237A-4168-875D-A2E1845F2B30.jpeg
A3822C16-237A-4168-875D-A2E1845F2B30.jpegJe ne peux pas donner toutes les techniques. Les anciennes ce trouvent dans le Langeron
Salutations
Voici quelques exemples:
Noyau de cellule d’orchidée x100/1,25 coloration au cristal violet aqueux réduit à l’orange de méthyle
Nous observons l’adn Condensé et les nucléoles
Amyloplaste de banane coloré à l’iode
Coloration argentique de notre ami du forum pour le rendu du détail
Je ne peux pas donner toutes les techniques. Les anciennes ce trouvent dans le Langeron chapitre cytologie .
Salutations





Sansevieria cylindrica étude histologique
dans Dominique
Posté(e)
Bonjour
superbe présentation.
Une petite remarque, je doute que nous pouvons voir des microtubules au microscope. Elles font de l’ordre de 25 nm.
C’est peut-être la membrane cellulaire qui a fait des replies par plasmolyse.
A+