-
Compteur de contenus
212 -
Inscription
-
Dernière visite
Messages posté(e)s par chrisimbee
-
-
Mes essais semblent le confirmer : une fixation ne serait que dans le vinaigre permet de conserver bien davantage les noyaux et chromosomes lors de l'hydrolyse à chaud dans HCl...et de mieux les voir ensuite
-
ah cool je vais esayer ! merci !!
Par contre j'ai fait quelques recherches sur le role d'une fixation préalable : c'est à dire que je trouve des protocoles impliquant du liquide de Carnoy ( mélange acide acétique et alcool) et d'après la littérature l'acide acétique fixe l'ADN et permet une meilleure visibilié des chromosomes et de l'ADN en général dans le cas de cette préparation . Si j'ai bien compris tout ce que je lis c'est un bon fixateur utilisé pour l'ADN en générale ; on le mélange avec l'alcool ( et d'autres produits en fonction des différentes formules de fixateurs) pour trouver un compromis entre "gonflement et rétrécissement dut a l'alcool) pour ne pas avoir trop de déformation à l'observation au microscope optique.
Bref, là je fait des essais avec du vinaigre (c'est tout ce que j'ai sous la main comme type d' acide acétique) et ça donne des résultats plutot interessants : le cytoplasme est bien clair voir transparent.
Les noyaux quand j'utilise le bleu de toluidine sont bien bleu et la granulation bien fine.
Je fait l'hydrolyse à l'HCl à chaud également : je chauffe en peu la lame à environ 60 °C comme j'ai pu voir sur de nombreux protocoles.
Aussi je vais essayer la colchicine pour avoir davantage de cellules en mitose ; j'ai comme l'impression que dans les lames du commerce ils doivent en utiliser pour avoir autant de stades visibles dans leurs racines:
à suivre
-
merciiiiiiiiiiiiiiiiiiiiiiiiiiiiiii :)
oui j'avoue la fluo c'est davantage pour un effet cosmétique et contemplatif :) Je trouv ('en dehors de toute considération scientifique bien sur) que la vision en épicospie donne une meilleure idée du volume des cellules , de la masse des noyau etc à cause de l'effet d'ombre dût à l'éclairage par le dessus.
Les photos en N&B : j'ai remarqué qu'avec ma cam couleur je pouvais effacer le dédoublement bleu-rouge par l'emploi du filtre vert et de désaturer ensuite l'image. J'obtiens encore davantage de finesse avec ma cam monochrome mais globalement c'est surtout mon équipement de prise de vue avec l'oculaire que j'utilise pour la projection : il induit tellement d'aberration....
J'attends un oculaire photo x10 LOMO car je trouve bien le NFK x2.5 olympus mais il ne donnera que l'image globale et je perdrais en définition si je veux bien échantillonner pour être en haute résolution (si la théorie de photo astro s'applique aussi ici).
Pour le violet de gentiane : je l'ai en poudre et en fait je fait la couleur directement sur la lame :
avec une aiguille montée je prélève quelques micro "poussières" de la poudre et je la met dans la goutte d'eau sur la lame. Je mélange puis j'y met la racine ramollie à l'HCl et bien rinçée au préalable car j'ai remarqué que si le Ph est toujours trop bas le violet change de couleur et vire au vert.
Je pose la lame sous le microscope et j'observe sans lamelle au x4 ou x10 (distance de travail assez grande) et je regarde si les noyau ont bien pris sur les couches externes de la racine jusquà la pointe).
Quand j'estime que c'est bon je rince et je met la lamelle et j'écrase....
En général ça colore vraiment très vite avec le viole de gentiane ; bien plus rapide qu'avec le bleu de Toluidine ou de Methylène...
j'ai commandé du carmin sur ebay pour voir..
-
Et pour ceux qui sont intéréssés j'ai trouvé un protocole pour observer la mitose de racine de poireaux (dont je me suis inspiré) mais en épifluorescence avec de l'orange d'acridine...
et j'ai fait un essai...
Ce que je trouve interessant dans cette technique c'est la sensation de 3D qui montre bien le volume du noyau et des chromosomes...
Ce n'est qu'un 1er jet mais j'espère faire une belle lame pour prendre de bien meilleurs clichés..
PS : voici le lien du protocole d'épifluo pour la mitose : tappez ça dans google car c'est un lien PDF .
Introducing Students to Epifluorescence Microscopy Using the OPNChris -
Bon après multiples essais j'arrive à ces résultats...
à vous de juger...
toutes les photos sont prises au Zeiss neofluar x100 Ph
colorant utilisé : violet de gentiane
Les photos en n&b sont en fait prises en couleur avec filtre vert pour améliorer la définition car la caméra réagit mal à la couleur violette et il y a un léger dédoublement..
Je vais voir avec la caméra N&B ce que ça donne..
Chris
-
Bonjour Dominique,
merci beaucoup,
Je crois que je me suis surtout planté dans la solution de HCl : je n'avais pas dilué au début pour obtenir une concentration de 1 Mol/L... et le colorant (bleu de Toluidine) se décolrait et ça ne mordait pas.
J'ai refait avec la bonne dilution et ça fonctionne mieux ; de même en chauffant un peu ça améliore la prise.
Je trouve en revanche que avec le violet de gentiane ça fonctionne très bien et qu'en double coloration avec de l'éosine j'obtiens des résultats interessant mais pour le moment je ne trouve que très rarement des cellules en mitose (je n'ai que des racines de poireaux sous la main mais je vais faire sur des germes de blés et surtout acheter de l'ail demain ).)
voici quelques résultats...
Ils ne sont pas folichon ; j'ai vu un largement plus beau ici ou sur le net ; d'ailleurs c'est quoi cette coloration où on voit les chromosomes en "noir" ?
Vue générale : il y a pas mal de cellules qui n'ont pas mordu
(Il y a une sorte de dédoublement de l'image en rouge et bleu et cela vient de mon capteur et du fait que ce n'est pas un oculaire de projection )
-
Bonjour à tous,
voilà bien longtemps que je voulais refaire cette manip basique des tp bio qu'est l'observation de la mitose de racine d'ail, oignon..etc
Seulement je rencontre un probleme : les cellules refusent de se colorer..
J'ai trouvé des protocoles avec du bleu de méthylène, du bleu de toluidine car je n'ai que ça à la place de l'orcéine ou du camin acétique.
J'ai aussi du violet de gentiane, de la fuschine..
Est ce que mes colorants sont hs ?? ça fait pas mal d'année que je les ai en poudre dans des tubes à essais bien fermés et ausec.. et quand j'en met une pointe d'aiguille dans de l'eau ça colore pourtant bien...
l'autre jour sur des tissus d'abeille frais les noyaux se coloraient très bien au bleu de méthylène par ex...
Est ce parceque mes bout de racine ne sont pas assez ramolis par l'HCl ?? ou bien justement ils sont trop acide et devrais je neutraliser l'acidité d'abord genre avec du bicarbonate pour colorer ensuite ?
qu'est ce qui ne va pas?
Il y a pourtant les cellules allongées (celles après le méristème) qui se colorent à peu près....
Chris
-
c'est superbe!! merci ; ça donne envie de tester auss i :)
-
ok ; vu que ce sont quand même des Zeiss de qualité (même s'ils sont "vintage je pense ; je veux dire pour tube 160mm) je ne veux pas courir le risque de les abimer :)
merci des infos en tout cas
-
ET sinon , question idiote peut être :
Et si je fait immersion à l'eau dans la préparation SANS la lamelle? je veux dire : normalement le lentille est bien scéllée donc l'eau ne rentrera pas. Certes l'indice de réfraction est un peu plus faible mais est ce que c'est faisable ? ou contre_indiqué ?
-
aaahhhhhh je vois mieux mainenant : je comprends :)
je vais essayer de suite !
merci Tryphon !
-
euuh ...vous voulez dire que je dois mettre 4 micro point dhuile de vaseline a chaque coin une fois la lalelle posée ou avant ?
peux tu décrire la manip plus precisément s'il te plzit ?
-
Bonsoir tout le monde...
Je viens vers vous pour des conseils et vos expériences :
Comment observer les protozoaires vivant avec le x100 immersion (huile) sans créer de raz de marrée sous la lamelle à chaque déplacements et mise au point???
Peut être met_je trop d'eau? devrais je par ex créer un lutage à la cire sur 3 coté de la préparation ? un micro aquarium sur 3 coté avec un "U" peint au vernis à ongle pour y poser la goutte d'eau et faire reposer ensuite la lamelle ?
Comment faites vous ?
Je faisais souvent de l'immersion pour observer les frottis sanguins (secs et colorés) mais là c'es simple...
Chris





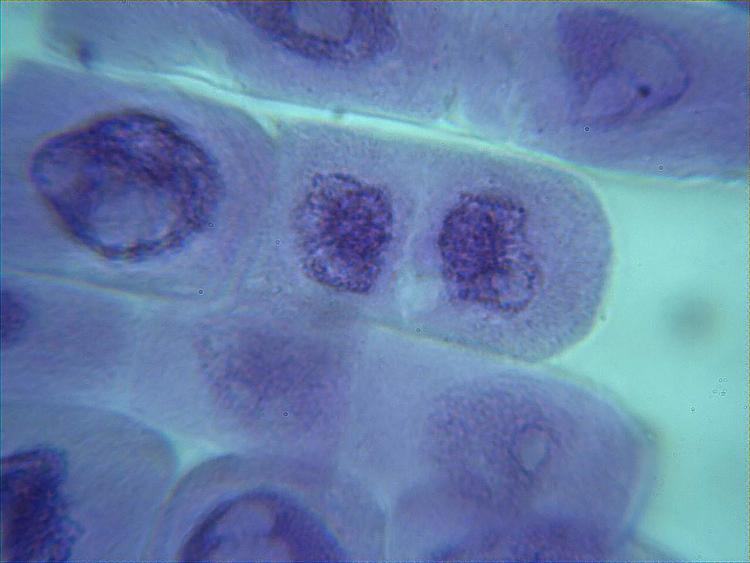
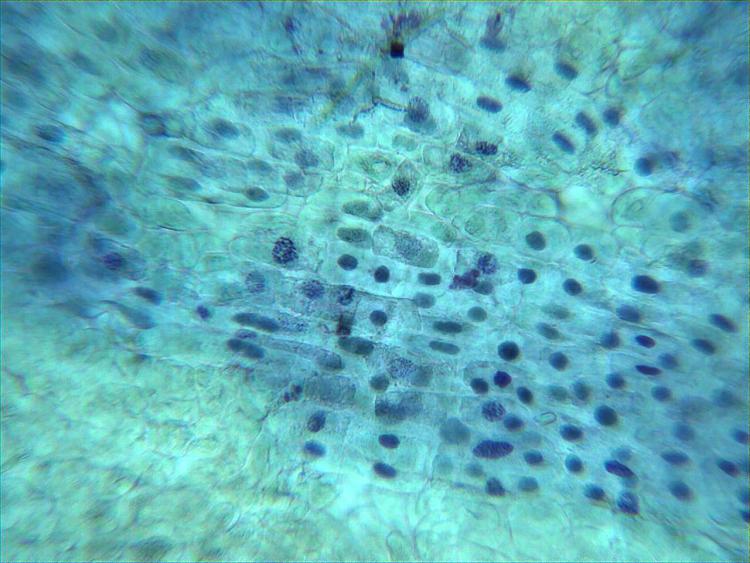
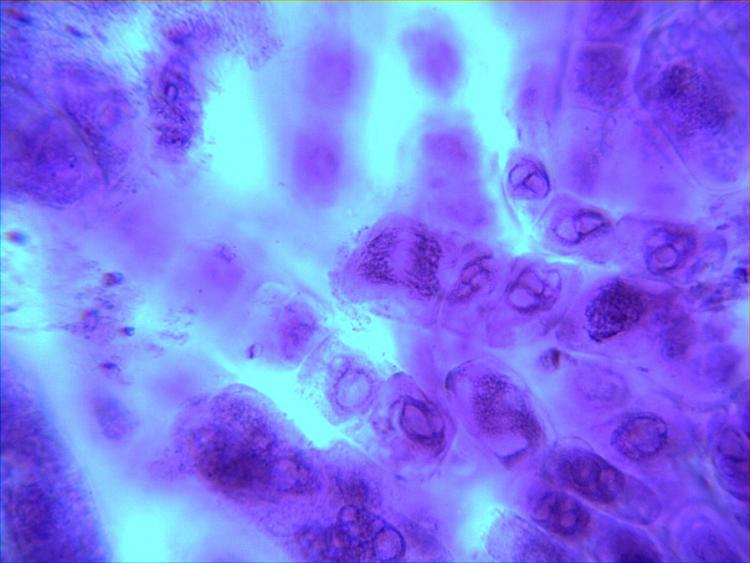
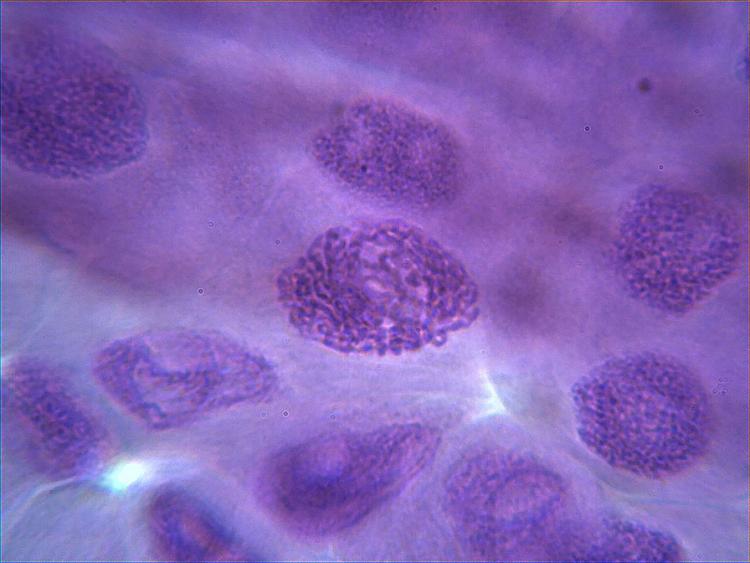

mitose racine d'oignon : les cellules ne prennent pas le colorant
dans - Préparations microscopiques
Posté(e)
Bonjour Tryphon,
Je retrouverai les sources mais il est souvent question d'utiliser la colchicine non pas parcequ'elle stimule la motise mais parcqu'elle la bloque et à un certain stade et donc on observe davantage de cellules bloquées à ce stade sur la lame. La cochicine était mentionnée dans plusieurs protocoles que j'ai trouvé au boulot. J'ai tout téléchargé sur ma clé USB et il faut éplucher tout ça mais tkt je le ferai ;).
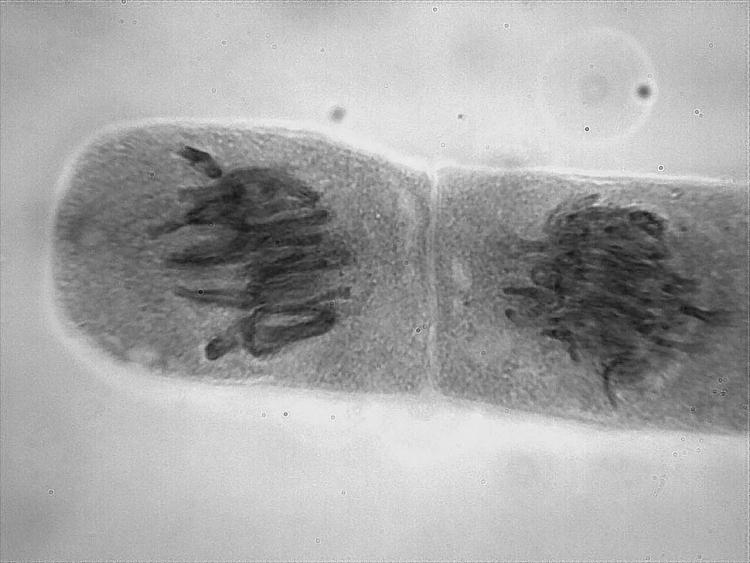
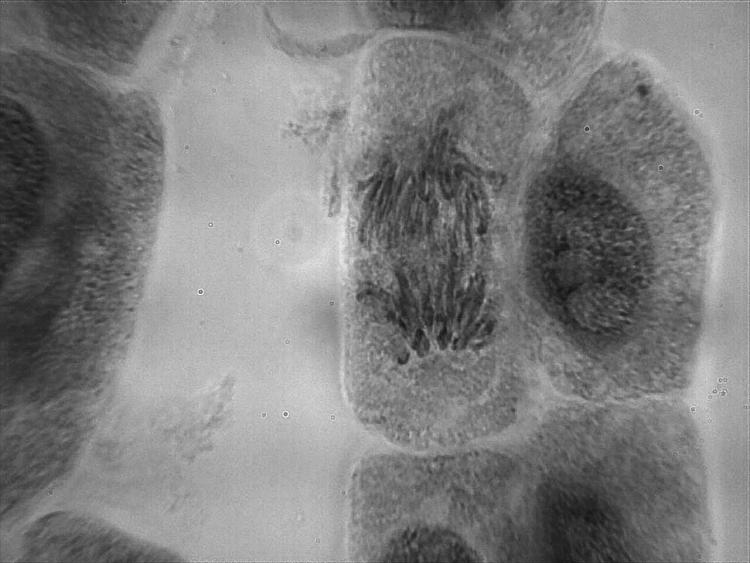
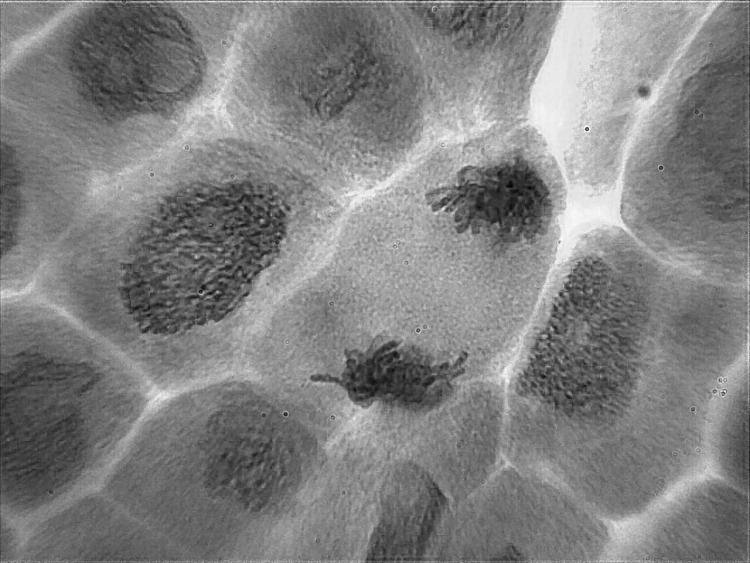
En attendant je viens de faire des lames avec une fixation avec du vinaigre seul (donc à 14% d'acide acétique) et effectivement les chromosomes sont plus visibles que lorsque je ne fixais pas du tout avant.
voici quelques photos.
Les chromosomes semblent plus "gonflés" que lors de mes essais de samedi dernier..
Quand je commence directement par l'hydrolyse à l'HCl il arrive souvent que les cellules ont du mal à prendre la coloration...j'ai eu des tentatives ou il n'y avait plus de noyau dans les cellules et seule les parois se coloraient...