-
Compteur de contenus
96 -
Inscription
-
Dernière visite
Messages posté(e)s par †Claude Lejeune
-
-
Salut à tous,
Autre sujet créé sous "Observations : Mycologie" qui lui aussi pourrait relever de la curiosité publique. J'ai profité de la venue, en ce moment même, de petits champignons à lames sur des cônes de conifère pour expliquer sommairement et brièvement comment s'attaquer (pour s'y initier) à l'observation d'un champignon à lames. En commençant par le début : les lames, précisément !
C'est LA
Amitiés,
Claude
-
Bonjour à tous,
Avec le redoux réapparaissent les premiers champignons à lame.
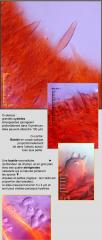
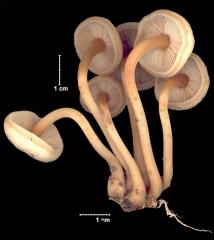
La Collybie des cônes (ici, plus précisément Strobilurus tenacellus) fait partie au printemps de leurs plus gracieux représentants . Elle vient sur cônes enfouis de Pin. On trouvera sa soeur, la Collybie commestible, Strobilurus esculentus (1), sur cônes d'épicéa. Deux autres "collybies" des cônes (2) existent encore, qu'on ne différentie avec certitude que sur leurs critères microscopiques.
Fouinez sous les résineux : vous ne manquerez pas de la trouver. Et profitez-en, si le coeur vous en dit, pour la passer au micro. Ses lames s'ornent de grandes et très frappantes cellules en cigare, des cystides (cellules stériles) comme vous les verrez dans le second message.
Leurs parois sont épaissies, réfringeantes dans l'amoniaque et leur extrémité est souvent ornée d'un capuchon de cristaux. (On ne le voit pas sur ces photos : l'amoniqaque justement les a dissout).
C'est en outre facile à observer - et permet de s'initier à l'examen microscopique des champignons à lames.
(1) Commestible ? Peut-être ! :o mais sa taille n'invite guère à la récolte. Ce nom lui vient sans doute, comparativement, de la légère âpretée de son sosie, la collybie ici même représentée.
2. Collybie reste l'appelation vernaculaire courante mais le genre a déménagé et s'est mué en "Strobile" depuis une trentaine d'années, sur la foi de nombreuses particularités micromorphologiques.
Ce qu'on peut voir
Comment on fait ?
Facile.
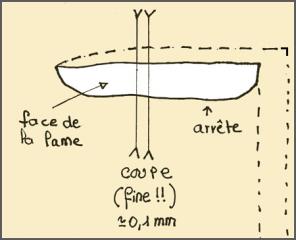
1. Prélever une lame du champignon avec une pincette.
2. La déposer sur sa lame de verre et y faire une serie des coupes transversales aussi fine que possible (disons 0,1-0,2 mm, ce ne sera déjà pas mal et ça se fait facilement à main levée avec un rasoir et les doigts dans le nez sous une bino).
3. Ne conserver que trois ou quatre coupes (les plus fines - celles qui ont l'air raté ou à peine visible).
4. Mettre une goutte de colorant (congo, cresyl, ou tout autre ; acqueux ou amoniacal pour le congo - acqueux ou alocolique pour le crésyl).
4. Recouvrir. Presser délicatement mais fermement avec une l'embout gomme de votre crayon par exemple (en sorte d'écraser votre prépartion).
5. Observer (x 100 pour repérer, x 400 ou plus - 100 et immersion) pour détailler.
Cette methode vaut pour l'observation des surfaces fertiles de tous les champignons à lames.
On peut aussi (et parfois : avantageusement) n'effranger que l'arrête de la lame du champignon.
Au rasoir, en détacher son "filet" extérieur.
Les cystides y sont fréquemment d'un autre type que celle des faces - et plus spectaculaires.
(Cela va dépendre du genre observé).
Amicalement,
Claude
-
Comme ça fait un bail que je n'ai plus rien mis à l'étal, je profite de quelques photos faîtes cette nuit en étudiant une (vieille) russule un tant soi peu problématique, pour tenter de commencer à remonter mon handicap.
Commençons par jeter un coup d'oeil à la bête ; désolé si sa mystérieuse splendeur vous laisse de marbre : il y en aura de plus flatteuses... Il s'agissait d'un apport ayant voyagé 24 heures quand je l'ai photographié.
Il ne s'agit pas là de prétendre vous initier à la détermination d'une russule (encore que ce ne soit pas nécessairement aussi compliqué qu'on le dit) mais, comme annoncé en introduction (c'est à dire tout en bas) de profiter de l'occasion pour mettre deux ou trois photos micro en lignes.
Outre les informations (nombreuses) qu'ils nous livrent quand on les examine sous toutes leurs coutures : macroscopiques, écologiques et organoleptiques (saveur et odeur), la vraie traque, quand on a un doute sur un champignon, commence sous le microscope.
Et, les spores mises à part (nous y reviendrons plus tard), les éléments les plus riches en informations pour les russules "habitent" souvent dans la cuticule (la pellicule qui recouvre leur chapeau). Sous la forme des cellules différentiées (ou non) qui les composent.
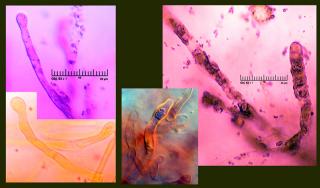
Ici : à gauche, deux "poils". Ce sont les éléments les plus banaux, présents dans toutes cuticules. On notera par exemple qu'ils sont, dans ce cas, dotés de terminaisons plus ou moins capités, en tout cas nettement renflées. C’est un indice.
A droite : ce que l'on appelle des "hyphes primordiales incrustées". Ce sont des articles beaucoup moins fréquents, présents chez certaines russules uniquement. C’est un indice plus fort encore.
Leur particularité : ces hyphes (hyphes = cellules) pluricloisonnées exsudent un suc incolore qui cependant fixe la Fuchsine basique et résiste ensuite temporairement (quelques minutes) à une décoloration par l'acide chlorhydrique faiblement dilué (3-4 %). On parle de décoloration différentielle.
En insert, l'une de ces hyphes primordiales, débarrassée de sa gangue et des ses exsudats mais laissant néanmoins apercevoir, au sein de sa cellule terminale, un amas granuleux qui peut aussi (mais ce n’est pas suffisant) signer sa vraie nature. Un résidu, en quelque sorte…
Bonsoir ClaudeA part la fuchsine,as tu utilisé des filtres de Rheinberg pour obtenir ces contours colorés à bon escientet particulièrement esthétiques? Ou bien est- ce dû au DIC ?
Pour avoir des (d'autres) indications, ou des réponses aux questions innombrables que tu peux te poser face à la mycologie microscopique (et à la mycologie tout court d'ailleurs) n'hésite surtout pas à poser des questions ! L'occasion fait le larron. Je parle pour moi bien sûr, trop souvent et trop longtemps silencieux sur ce forum. "Action - Réaction" comme disait l'autre : si tu demandes, je réponds !!
...les deux mon capitaine ! Voire les trois. Je m'explique :
Les seules photos faites en DIC, c'est :
- le "poil" supérieur gauche (*) (Fuchsine et contraste interférentiel) ;
- et l'incruste du milieu. C'est à dire l'"Hyphe primordiale" dénudée (débarassée de sa gangue) mais avec son contenu résiduel granuleux. Montage sans fuchsine mais dans du Rouge Congo amoniacal au contraire ; "au contraire" car l'amoniaque, comme tout autre alcali, a pour propriété de dissoudre l'exsudat incolore évoqué. Par contre il met bien en relief les parois. Un coup de "niveaux automatiques" plus tard sous Photoshop et on obtient par bonheur cette accentuation effectivement bienvenue quoique partiellement involontaire.
Pour la photo des deux HP de droite ("rouge et noire") : bain préalable de 10 minutes dans de la Fuchsine phéniquée ; rinçage d'une trentaine de secondes à l'acide chloridrique à 4-5 %, observation dans le même milieu mais à 1 % environ.
C'est précisément cette technique de coloration et elle seule (ou presque) qui permet de mettre en évidence cette gangue ruguleuse autrement invisible et qui "signe" l'Hyphe primordiale et permet donc de la diagnostiquer avec certitude.
Et c'est cette méthode que j'évoquais en parlant de "décoloration différentielle". L'HCL dissoud rapidement la coloration rouge communiquée aux divers tissus par la Fuchsine, à l'exception notoire et exclusive (ou presque : gare aux artefacts !) de la coloration pourpre vineuse prise par l'exsudat des HP qui seule y résite plus longtemps. Photo sans filtre. Accentuation des contrastes sous Photoshop.
J'ai bien sûr choisi une russule où je savais cette réaction flagrante, même sur exsiccatum (c'est le cas ici). Il y a malheureusement bien des cas où le résultat est d'interprétation plus délicate, même sur le frais. Et comme d'baitude : ce sont les plus nombreux !
Bien à vous deux,
(et aux autres !)
Claude
PS
Noter au passage que cette technique n'a vu le jour que vers la fin des années 20, mise au point par le premier grand russulologue "moderne" (Vaclav MELZER) à qui l'on doit aussi l'invention du réactif qui porte son nom et permet de colorer en gris-noirâtre les ornements (dits amyloïdes) des spores de russules.
Au paravant toutes les spores, évidemment hyalines (= incolores) sous le microscopes, étaient uniformément décrites comme "échinulées" point barre. Quand on sait que seul le dessin de leur ornementation permet parfois de différentier avec certitude deux russules assez proches, on imagine le souk qui règne encore dans "les noms anciens" des pères fondateurs de la mycologie. Et malgré des oeuvres titanesques plus récentes (1950 ; 1985 ; 1998 pour ne citer que quelques jalons de l'histoire de la "russulologie") et tout l'arsenal micro et macrochimique d'aujourd'hui, des interprétations polémiques sur tel ou tel taxon continuent de faire rage parmi nous ! :lol:
(*) Des fois, en se relisant, on se demande la tronche que ferait un quidam en lisant des morceaux de nos phrases. Ben mon Cher, ces gens-là, ils sont capables de disserter jusqu'à point d'heure sur "le poil supérieur gauche". Y a du vrai, remarquez, y a du vrai...
... et avec un montage photo, c'est plus digeste ?! ;)
-
Nouveau sujet (point de départ dans "Clitocybe nébuleux", ici-même)
Je n'avais pas pensé aux corticiacées, comment fait-on pour prélever, on gratte? On décolle? On prélève avec le substrat?Cher Bret,
Cher Tous,
Les Corticiacées compensent l'archaïsme de leur morphologie et leurs modestes atours (c'est un euphémisme) par la beauté plastique de certaines de leurs cellules, à l’origine d’authentiques coups de foudres mycologiques et micrographiques : ces champignons scellent indiscutablement ces deux passions.
C'est sur la face inférieure du bois mort que tu feras les plus belles récoltes. Il suffit en général de "s'attabler" à un vieux tas de bois et de le démonter en inspectant méthodiquement les morceaux : les branches du dessous, et notamment celles qui sont restées au contact du sol (humidité préservée), sont les plus riches en croûtes.
Tu récoltes au couteau ou à la serpette avec une tranche de substrat (en général, écorce ou bois à nu : attention, on se blesse facilement !) ; tu transportes tes spécimens dans du papier journal pour éviter une trop brutale déshydratation, et face inférieure maintenue dans sa position originelle (1).
Ensuite tu réhydrates éventuellement (en imprégnant d'eau ton papier journal, par exemple, et en laissant ta croûte y séjourner un quart d’heure) puis :
- tu grattes, s'il s'agit d’un Corticié pelliculaire, "crémeux" ou très finement membraneux ;
- tu fais une très fine coupe plus ou moins radiale si ta croûte est plus épaisse ;
- tu colores : rouge congo amoniacal, ou mieux : KOH (ou soude domestique) à environ 5% + rouge Phloxine B ; ou, encore mieux : les deux, successivement (2) ;
- tu recouvres d'une lamelle, tu écrases à la fois délicatement et fermement ta préparation (p. ex. avec l'emboût gomme d'un crayon) et observes à x 400 au minimum puis tu détailles en immersion.
Les corticiés ou croûtes "résupinées" (= totalement étalées sur leur support et donc privées de "chapeau" et de pied) ont une structure simple : une assise externe de cellules allongées dans le sens du support, qui se redressent progressivement et dans le prolongement desquelles s'épanouissent les basides et différents types de cystides (éléments stérils entre les basides, ou immerses, dans la trame même de la croûte). Ce sont ces cystides qui peuvent être étonnamment belles : couvertes de cristaux, encapuchonnées de gros globules, gavées de sucs qui noirciront ou bleuiront dans certains réactifs, etc.
D'autres corticiés ont évolué vers une plus grande différenciation : amorce de "chapeau" (un bout plus ou moins grand de la croute se détache légèrement du substrat) : on dit alors qu'ils sont "étalés-réfléchis".
Ils sont primitifs, certes, mais leur rôle écologique est important (vital même !): ils sont les tout premier à s'attaquer au bois mort, à le décortiquer et (ou) à préparer l'arrivée des autres champignons "lignivores" qui, tous armés de puissants enzymes, vont réaliser cette "extraordinaire performance biochimique" (l'expression n'est pas de moi : suis hélas nul en chimie...) qui consiste à décomposer la cellulose et la lignine et, partant, à recycler le carbonne.
Ci-joint deux représentations "idéales" de ce qu'on peut voir (dessins repiqués, pour leurs vertus pédagogiques, dans des monographies citées en Légende).
Envoie-nous des photos en cas de problèmes (dont des photos macro de tes récoltes), j'essayerai de te guider (toi, ou quiconque voudra t'accompagner virtuellement dans cette chasse à la croûte !).
Amicalement,
Claude
Notes
1. Les croûtes abandonnées un jour ou une après-midi, dans une boîte humide, continuent de se développer. Leur cellules, partiquement réduites à leur "hyménium" (= leur surface fertile, l'usine à spores en quelque sorte) continue de croître, en respectant son géotropisme. Les cellules d’une croûte séjournant à l'envers s'enchevêtreront donc cul par dessus tête…
2. En mycologie le rouge congo est un colorant pariétal (les parois des cellules – hyphes - sont essentiellement composées de chitine). La Phloxine B quant à elle colore le cytoplasme. Mais ce n’est jamais que de la cuisine : tu peux aussi tester d’autres colorants ! La présence d’un alcali aide à regonfler et à dissocier les structures.
3. Corticiacées (famille) et Corticiés (tribu) sont bien sûr employés ici dans un sens très larges (tout ce qui à l’apparence d’une croûte est loin d’être un Corticium (4) ou même une Corticiacée ; tu risques de tomber sur des Ordres ou sous Ordres (5), voire des Classes (6), différents. Les basidiomycètes ne sont pas les seuls à avoir développé cette stratégie élémentaire (un organisme pour ainsi dire réduit à sa fonction reproductive). Mais ne compliquons pas : l’essentiel pour l'instant est de commencer par « voir » quelque chose.
4. Il n’existe pratiquement plus que deux ou trois Corticium « vrais » : les autres ont été pulvérisés dans maints nouveaux genres.
5. Par exemple les phragmobasidiomycètes ou encore hétérobasidiosmycètes (à baside compartimentées) ou : 6. ... des Ascomycètes.
7. …il n’y a pas de 7.
Légende
Planches (figurant la structure d’une croûte et certaines de ses cellules) extraites de 1990, Hjorstam K. & L. Ryvarden : « Lopharia and Pododostereum » et 1997, Nunez M. & L. Ryvarden : « The genus Aleurodiscus » (Synopsis Fungorum, T. 4 et 12 – Fungiflora – Oslo).
Amicalement
Claude
-
Bonjour Bret,
Bonjour à tous,
Épargne-toi ce supplice, Bret ! Les polypores sont LES champignons dont l'étude microscopique, ingrate et laborieuse, exige le plus d'adresse, de patience et d'expérience technique !(…) j’ai vu aujourd’hui, sur une souche, des polypores versicolores (Trametes versicolor) que je vais me faire une joie d’observer (…)Il y a encore moyen de trouver des champignons charnus : sur les souches (ou sur tronc vivant) de frênes, de saules ou de peupliers, dans les forêts riveraines, pousse l'hivernale Collybie à pied de velours (Flammulina velutipes) ; et ici et là, en bordure de chemin, sur brindilles enterrées, parmi les feuilles, vient la Tubaire d'Hiver (Tubaria hiemalis).
En fouillant bien, on peut trouver des champignons à lames presque toute l'année.
Sans parler des "croûtes" (les Corticiacées), qui sont un pur bonheur pour le microscopiste.
Mais c'est une autre histoire, dont je vous entretiendrai prochainement, lors de l'initiation méthodique promise.
Claude
NB : indépendamment des deux espèces citées, c'est dans les épaisses litières d'aiguilles des forêts de conifère (épicéas de plaine par notamment), relativement protégées du gel, qu'on trouvera, le plus facilement, les champignons de l'arrière automne. Pensez à faire des exsiccata (= à dessécher des spécimens, pour étude ultérieure).
Photo :
= Marcel Leconte Je reviens avec un peu de retard sur ce sujet !Merci Claude (et amitiés en passant...) d'avoir clairement situé la microscopie des Polypores car c'est effectivement du travail de spécialiste et de technicien maîtrisant tous les tours de main ....
M :)
Salut Marcel,
(& le bonjour à tous)
La réponse est : non, à l'exception (si l'on parle de test macrochimique) de l'acide cyanydrique, qui se décèle facilement avec des tampons ad hoc: mais comme un très grand nombre de champignons (y compris les champignons commestibles) contiennent de l'acide cyanydrique...Ta question : Existe-il des réactifs mettant en évidence au microscope la localisation de toxines? Je n'en ai jamais entendu parler ...D'ailleurs et en passant, les champignons contiennent, ou sont susceptibles de contenir (pollution donc métaux lourds) une foule de saloperies !
les lames d'Amanita phalloides deviennent mauve violet sous l'action de l'acide sulfuriqueCher Marcel, le jour ou les morfalous qui sont "en mesure" aujourd'hui de confondre (par exemple) une coulemmelle et une amanite phalloïde, battront librement les bois avec un flacon d'acide sulfurique dans leur poche, c'est nous (et nos Zamis les Mycètes !) qui aurons tout lieu de "baliser"... :blink:
Amitiés,
Claude
PS
"La (re)connaissance des champignons à travers leurs seuls caractères botaniques est le seul moyen sûr de ne pas s'empoisonner" (Jenesai P. Luqui ; mais je sais que tu seras d'accord !). Comme il n'y a qu'une petite quinzaine de champignons mortels pour plus d'un bon millier de commestibles avérés (je n'ai pas dit "savoureux" ; et encore moins d'une totale inoccuité), c'est par la connaissance botanique et macroscopique (...qui ne pose aucun problème sérieux) de ces "tueurs systématiques" qu'il faut commencer.
-
En Bavardages, Frédéric alias Bret a écrit :
Je profite de ce sujet pour poser une question un peu simpliste concernant la mycologie et la microscopie:A part les spores, quels éléments du champignon peut-on observer au microscope?
J'imagine, bien sûr que l'on peut faire des coupes, les colorer et les observer, mais plus de détails m'intéresserais!
Une autre question: Quel livre conseillez-vous? J'ai déjà des "guides des champignons" mais j'aimerais un manuel qui soit plus scientifique et qui aborde les moyens d'études comme la colorations, la microscopie, l'étude du terrain etc...
Merci d'avance,
Frédéric (Bret)
Faisons bref, car comme dit en bavardages, pour répondre correctement, il faudra un peu plus de temps et surtout de la méthode. Ca viendra...
Ceci n'est qu'un très rapide aperçu.
Que voir ?
Les réponses varient selon la catégorie des champignons qu'on étudie. En règle générale :
- Les spores (mures), bien sûr.
Taille et forme ; métachromasie (c'est à dire changement de couleur induit par certains réactifs : l'iode et le bleu de crésyl étant les grands classiques) ; dessin ornemental en cas d'ornements (et taille de ces ornements), etc.
Mais le niveau d'information de ce caractère lui-même est fluctuant selon les genres : relativement pauvre par exemple chez les tricholomes, les clitocybes, etc., il peut être crucial dans d'autres genres (ou sous-genres ou sections...).
Les spores de russules sont ainsi parmi les plus riches en informations.
(Cette relativité s'applique bien sûr à tous les caractères observables).
- les cellules stériles de l'arrête et (ou) des faces des lames (voir ici même sous "cystides")
- les cellules constitutives du revêtement du chapeau (la "cuticule"et ses différentes "states") : forme, contenu, taille et tutti quanti
- les pigments (localisation du pigment : vacuolaire, membranaire, etc.).
- la présence de cloisons et (ou) de boucles - des petites anses au niveau des cloisons - sur les cellules. Cellules qu'on appelle en fait les "hyphes" chez les champignons, en raison de leur nature filamenteuse.
Ces observations se font, par ordre croissant de difficulté, sur :
- des dilacérats (fragment écrabouillé) quand on sait ce qu'on cherche et que l'organisation des tissus importe peu;
- des scalps (prélèvement des surface en coupe fine ou en "épluchage");
- des coupes radiales.
On observe les tissus dans un colorant "universel" d'abord (rouge congo SDS ou amoniacal), on affine en fonction de ce qu'on cherche ensuite.
Que lire ?
Vaste sujet.
Commencer par un incontournable, passage obligé ou presque de tous les apprentissages : "La description des champignons supérieurs" de Marcel Josserand, un Maître du siècle révolu, à l'écriture fluide, belle et précise - un humaniste comme il n'en existe plus guère.
(Fouiller le Net : les deux premières éditions, 1952 et 1983, sont épuisées, la troisième, dont je n'ai pas les références, serait en passe de l'être...)
Ensuite : un clé d'orientation générale. Là encore, la meilleure des clés "généralistes", pour démarrer (...et aller bien plus loin ensuite), est épuisée : La Flore des Champignons supérieurs de R. Kühner et H. Romagnesi (1953). En fouillant, on trouve - ou on photocopie...
Enfin : des clés monographiques (dédiées à un seul genre et réservées non pas à des "spécialistes" mais à des "généralistes" déjà familiarisés avec les techniques d'observation de base).
La connaissance d'une ou plusieurs langue étrangères étend évidemment le champ bibliographique. Le vocabulaire nécessaire est assez restreint : on apprend vite (pour peu qu'on le veuille !). Il existe d'ailleurs des glosssaires en 6 langues ou plus.
Je reviendrais un de ces quatre plus en détail sur la question, comme promis et en l'illustrant. En attendant, n'oubliez pas qu'un moteur de recherche judicieusement utilisé et un peu d'entêtement permet déjà de trouver des réponses à quantité de questions, notamment bibliographiques...
Cordialement,
Claude
-
Re-bonjour Michel et tous,
Christian Lechat, ascomycétologue brillant et mycobidulologue expérimenté répond, sur "Mycologia Europaea" :
"Je pense qu'il pourrait s'agir d'un Helicoon ou Helicodendron plutot qu'un Helicosporium, ceci à cause de la profondeur de l'image et de l'habitat, Helicosporium etant spiralé à plat alors que Helicoon est sipralé en colimaçon sur plusieurs étages.
Si tu pouvais faire une photo de la conidie de profil tu serais fixé."
En guise de bibliographie, il nous signale :
"Voir H.L. Barnett , Illustrated Genera of Imperfecti fungi
et Kiffer, E. & Morelet, M. 1997. Les Deutéromycètes. Classification et clés d'identification générique. INRA Editions, 305 p."
Son collègue Robert Colot, sur le même Forum, va dans le même sens, apporte une précision et pose une question :
"(...) d'autant que les conidies semblent être plutôt brun-olivâtres qu'hyalines. Sont t-elles isolées ou en chaîne ?"
Clairement en chaîne il me semble - j'attends qu'il me précise en privée en quoi la photo laisserait-elle à ses yeux planer un doute là-dessus...
Dernière minute L'info vient de tomber dans mon aut'louque. Christian Lechat répond :
"(...) les conidies "en chaine" s'opposent aux conidies isolées parce qu'elles sont attachées les unes aux autres et non solitaires, réparties sur les conidiophores. La photo envoyées ne permet pas de le dire. Les conidies d'Helicoon ou Helicodendron ressemblent de profil à un tonnelet. Pour les photographier il faut les observer dans l'eau additionnée d'un peu de liquide vaisselle (remouillant) sans lamelle couvre objet et avoir un peu de chance !!"
A défaut d'avoir les ouvrages cités (mais peut-être un abonné de MirOscOpieS les a-t-il ?), voilà un tableau sur les sympodulosporés, et diverses représentations shématiques de deutéromycètes "spiralés". En jpg joint (le .pdf reste trop lourd ou cesse d'être lisible).
Je regarderai demain si je trouve quelque chose de plus pointu, quelque part sur mes étagères et sur les Helicodendron & les Helicoon : TBMS (voir infra), je dois avoir ça, au moins de manière lacunaire.
"Dominique Lactaire Schott", qui a la collection complète je crois, nous dépannera le cas échéant. Pour autant qu'il ait enfin réussi à s'inscrire à ce Forum -ou (et) ait réglé son problème de droits pour pouvoir y intervenir.
Bonne nuit, je vous souhaite à tous de faire de beaux rêves spiralés.
Claude
-
...j'ai des doutes (...) je ne crois pas trop que ce soit "myco"
Michel, Tous,
J'aurais dû surtout avoir un doute sur mes doutes, et ne pas "causer" trop vite.
Du côté des Hyphomycètes aquatiques, plus ou moins associés à des Arthropodes, "Helicosporium" est une proposition très pertinente, au contraire !
Je fouille encore un peu et essayerai de te dire "que regarder" pour essayer de "déterminer" plus finement...
Claude
-
il pourrait s'agir d'une conidie de champignons
Bonjour Michel,
Bonjour à tous,
...j'ai des doutes : c'est beau, ton hypothèse est séduisante : après fractionnement, les logettes pourraient faire penser sans doute à des conidies mais, sans trop savoir pourquoi (réfringeance, taille totale supposée ?) je ne crois pas trop que ce soit "myco".
Je n'ai, il est vrai, pratiquement aucune connaissance de ce qu'on appelait naguère les "fungi imperfecti", et peut-être y-a-t-il des deutéromycètes qui ressemble à ça ; je n'ai pour l'instant aucun souvenir d'avoir jamais vu représentée une telle forme.
Je vais fouiller dans les bouquins ad hoc.
Peux-tu nous en en dire un peu plus :
- support de ta récolte ;
- regarder à x 100 à quoi ça ressembkle de très près (parois - et la cas échéant contenu cellulaire) ;
- et tester quelques réactifs mycologiques de base : bleu coton, iode, rouge congo.
Si c'est (issu d') un champignon, on finira par trouver lequel...
Amicalement,
Claude
-
Michel,
Re-mar-quable.
Les deux jeux se complètent bien : le premier permettant d'apercevoir le très curieux "voile tendu" qui semblent réunir certaines crètes de manière très singulière (en fait, probablement des portions de crètes translucides et non amyloides).
En contemplant cette spore, on pourrait aussi longuement débattre pour savoir s'il s'agit de Russula laurocerasi ... ou de Russula fragrans ! (je n'ai pas dit R. fragrantissima).
La différence sporale porterait :
1. sur leur taille hors ornements ; les petites, vers 8 µm : "laurocerasi" ; les grosses > 8-9 µm : "fragrans"
2. sur la hauteur (> 1.5 voire > 2 µm pour fragrans) et le nombre de ces ornements ailés, qu'on peut bien dénombrer en vue "par le cul" de la spore (en coupe polaire), quand on a la chance de coincer une spore dans cette posture, d'où les crètes semblent partir d'un point central pour rayonner longitudinalement comme autant de méridiens. (Jusqu'à 8-12 déjà dénombrées pour "cf. fragrans", moins abondantes pour cf. laurocerasi)
De toutes façon, après avoir opbservé X spores de N récoltes, et après avoir consciencieusement reniflé puis goûté des dizaines de spécimens (âcre dans le stipe pour laurocerasi avec une odeur non pure (sic) d'amande amère, contre l'inverse pour fragrans) il me semble que l'ensemble de ces différences énoncées par l'immense Romagnesi , qui a créé fragrans (d'abord sous forme de variété de laurocerasi Melzer, puis qui l'a élevée plus tard au rang d'espèce), sont tout sauf ...constantes ! Caractères "croisés" trop fréquents, donc, pour être tout à fait honnêtes. Russula laurocerasi Melzer, sensu lato : c'est un bon choix !
(Opinion qui n'engage que moi..., mais que partage aussi Mauro Sarnari )
Je ne sais pas ce qu’est une ondelette (Vu en astronomie)euh... Qu'est ce que l'ondelette (que je ne connais pas non plus) a à voir avec cette histoire ?
Amitiés
Claude
Message-"Embryon de Réponse" promis par ailleurs ci-dessous suivra dans la semaine.
-
Bonsoir à tous, Michel, Marcel, Michel et les autres,
1. Ta photo de spore de russule, comme le note Michel, est plus qu'honorable. Toute la difficulté avec ses petites bêtes là, en photo, c'est d'arriver à avoir assez de profondeur de champ pour en rendre manifeste l'ornementation. Et de ce point de vue, c'est une réusssite !
Une retouche ultérieure via un logiciel de traitement de l'image, en augmentant les contraste et bidouillant un peu le "trait", devrait t'aider à régler le problème (grisaille) qui reste. Cf. infra - mais il faudrait repartir de la haute déf. initiale
Par contre pourquoi pas développer des articles sur l'aide a la détermination des genres par exemple à l'aide du microscope quand cela est possible puisque le site n'est pas vraiment voué à la mycologie?Est-ce là, la question qui n'est pas comprise par M&M ?
J'apporterai mon embryon de réponse demain, dans un Nouveau sujet consacré à cette question spécifique (...j'avais commencé ici-même : et j'ai réalisé à temps :o que le présent sujet (M-Spores de chamipi) - allait, pour le coup, méchamment redéraper une troisième fois !).
NB
Superbes photo de cystides, Marcel !
Bonne nuit - ou bon début de journée -, et à tout à l'heure.
Claude
-
Bonjour Michel,
Bonjour Marcel,
Bonjour aux autres (...s'il en reste),
Bravo. Pas si loin : Collybia aquosa (et même, si l'on a un sens étroit des espèces : var. oedipus sensu Bon).De toute façon je me lance : Un collibie printanier ,à cuticule type dryophila à base à strigueuse et à rhizoîdes jaunâtre ;je dirais ………collybia verna ?Les rhizoïdes rosâtres (et pas ocres, Michel) et la présence de cheilocystides fréquemment claviformes (vs. plus grêles, ou plus régulièrement toruleuses et contournées chez dryophila, qui est sa plus proche parente) plaident pour cette détermination.
La poussée précoce et en milieu mésophile (ici: litière « banale » de feuillus mélangés en stations pas spécialement hygrophiles) caractérisent le maintien par Marcel Bon d'une var. "oedipus", épithète généralement considéré par les autres auteurs comme simple synonyme d'aquosa).
C. verna (souvent synonymisée à C. nivalis) est macroscopiquement bien différente (mais ça tu ne pouvais pas le savoir), a des spores un plus longues ... et surtout n'aurait pas de vrais cheilos (juste des poils).
Sinon pour les devinettes ,c'est marrant, ça fait se creuser les méninges et donc en apprendre un peu plus .Il est souvent si difficile de mettre un nom quand on a tout ,alors avec des photos de micro!!!C'est juste pour le fun... Mais crois-tu Michel que ce soit bien le lieu ?
J'avais exprimé mes réserves initialement, dans ma réponse à ta propre devinette.
« Ma » devinette (pourtant considérablement plus riche en informations que la tienne) ne visait ni plus ni moins qu'à te démontrer malicieusement la perversité possible - et souvent l’impasse scientifique totale - de cette démarche.
En privé, ou en comité très restreint de potes mycologues plus ou moins chevronnés ...et plus ou moins bravaches ! le jeu peut à la rigueur se concevoir.
Sur un forum, et a fortiori un forum non dédié à la mycologie, je crains SURTOUT qu'il ne défrise ou n'ennuie profondément un nombre considérable de membres, qui s'en retrouvent de fait exclus et assistent (pour les plus patients d'entre eux) à un ping-pong abscons.
Ne crois-tu pas qu’il vaut mieux attiser leur curiosité et la satisfaire, par une démarche plus ouvertement « pédagogique » ?
Il en va tout autrement, bien sûr, de « L’aide à la détermination » où un membre, intrigué par une trouvaille, la soumet à la collectivité en lui fournissant la totalité des informations qu’il aura été, à son niveau de compétence, en mesure de rassembler…
Voilà un sport réellement stimulant !
Bien amicalement,
Claude
Je suis bien sûr disposé à reprendre « en clair » et dans un sujet distinct, mes explications sur la Collybie aqueuse et sa petite sœur « dryophila » (ce qui veut dire « ami du chêne » : épithète impropre, car ladite sœur se compromet avec à peu près toutes les essences !), leur différence et leurs points communs. La collybie dryophile est l’un des champignons parmi les plus communs : il est rare qu’on fasse une sortie sans tomber sur elle à tout bout de champ. …euh, enfin, de bois (car elle n’est jamais champêtre).
-
Bonjour Michel,
Bonjour Michel,
Bonjour à ceux qui ont encore la patience et la témérité de s'aventurer à nous lire
(L'est bien silencieux Lactarius, en ce moment...)
Derniers indices. Dans une devinette, tout compte, ok ?Résumons: la cuticule semble de type hymenodermique avec des cellules assez piriformes(est ce bien ça qu'on dit)Pour les cheilos certaines on l'air difformes mais ne semblent pas presenter de paroies epaisses.Allez encore un indice pour le petit débutant
Relis bien ça :
cuticule (cette dernière en coupe radiale, c'est important et c'est un tout petit piège)Pourquoi était-ce un piège ? Parce que que l'on pratique rarement des coupes radiales sur ce genre autour duquel tu tournes, mais toujours des scalps.
Comment peut on sortir de ce piège (qui n'était pas d'ailleurs purement malveillant ! Je te dirai pourquoi après) ?
En regardant attentivement toutes les cellules terminales photographiés, dans cette coupe radiale. Il y en a une (vers la gauche) qui ne colle clairement pas du tout avec la forme des éléments dressés et homogènes sur une cuticule hyménodermique. Suit ses contours tortueux et restitue lui son volume réel. Tu commence à le voir tel qu'il est ?
Il est typique de la structure de la cuticule que tu recherches. Demande toi à quoi cette cuticule pourrait alors ressembler ...en scalp.
Cette structure cuticulaire a même été baptisée en référence directe au nom d'une espèce de ce genre, espèce extrèmement proche, par surcroît de celle que tu es censé découvrir (au point qu'elle n'en fut longtemps considérée que comme une variété).
Là, je suis sûr que tu connais maintenant ce genre, aussi trivial que le genre marasme - et avec tous mes petits cailloux blancs, le nom de l'espèce par la même occasion.
D'autant plus que tu as une photo macro (enfin un bout) pour t'aider. Et que je t'avais dit que la coupure du genre X avec le genre marasme était un éternel problème (ce seul élément te disait clairement le genre concerné - il n'y en a qu'un qui puisse prêter vraiment à confusion ; et certaines de leurs espèces "borderline" se promènent toujours, depuis deux siècles, d'un genre à l'autre, dans un mouvement pendulaire.
Pour "verrouiller" l'espèce elle-même, relis enfin mes autres premiers indices. (Et je t'en ai ajouté d'énormes ci-dessus).
...il s'agit d'un champignon plus commun qu'on ne le croit et qui pousse partout en ce moment (...)Puis :
(...) regarde bien les cheiloscystides (...) il y a dedans à boire et à manger (...) et c'est la source d'où pourra peut être jaillir une proposition définitivement convaincante
Et puis balance un nom : t'en mourras pas si tu te plantes ! Il faut arrêter de sacraliser cette connaissance des noms et le prétendu talent des Lucky Luke de la Détermination ! Ils me font gentiment sourire : ils connaissent plein de noms, certes, un bon millier voir 1500 taxons (pour les Superstars) qu'il reconnaissent en douze seconde ou 2/10e de seconde sur le terrain. Mais pose leur une seule question qui concerne, non plus le nom, mais plus généralement le champignon qu'ils ont si fièrement nommé plus vite que tout le monde : écologie, position dans la systématique, particularité microscopique, historique de ses interprétations à travers les âges, voire simplement l'étymologie de ces binomes dont ils ont la bouche pleine : ils en perdent parfois l'usage du langage...
Ce n'est plus ni de la mycoloqie, ni même du naturalisme. Autant apprendre le bottin ou les 300 nombres premiers pour les réciter à l'envers !
Amicalement,
Claude
NB
1. Je suis aussi "un petit débutant" à ma façon : plus ça va et de moins en moins nombreuses sont mes certitudes...
2. Je joins à nouveau, pour plus de clareté, les deux montages photos.
-
Bonsoir Michel,
Bonsoir à tous,
Tu peux me tutoyer !
sauf les dimensions qui n’ont pas l’air de coller ( donc problème d’échelle ou c’est que je me gourre completPas complet... !
Tu n'est pas tombé bien loin ; le champignon dont tu cherrches le nom fut naguère un marasme - mais il en est (définitivement ?) sorti, pour rejoindre un genre tout aussi ancien, tout aussi commun - et dont la coupure avec les marasmes à toujours posé problèmes...
Sinon, pour M. oreades, c'était presque plausible si mes spores n'étaient pas presque deux fois plus petites (5-5.5-6 (7) x 3-3,5 (4) ici : donc pas de problème d'échelle) si "ma" cuticule n'était pas un peu plus fantaisiste, et "mes" cheilos, plus...).
Quand tu auras presque trouvé, regarde bien lesdites cheiloscystides justement : il y a dedans à boire et à manger (sans aucun jeu de mot) et c'est la source d'où pourra peut être jaillir une proposition définitivement convaincante ... ?
J'ajoute un indice.
(Je rendrai bien sûr tout cela beaucoup plus transparent pour tous, et pédagogique, quand Michel aura trouvé... C'était la réponse du berger à la bergère... ;)
Cordialement,
Claude
-
Bonjour Michel,
Bonjour à tous,
La réponse, si tu la lis mieux, était dissimulée dans ma question :
"tricholomes" (ou les Lyophyllées) plus ou moins goniosporés... lâchons donc un nom puisque tel était ta demande : il s'agit du rarissime "Tricholoma" goniosporum Bres. , probablement sur le point, aujourd'hui de voir sa position taxinomique plus ou moins remise en cause par les molécularistes.
Mais sans vouloir trop te taquiner, si ta photo de spore y faisait un peu penser, ce n’était rien moins qu’à cause …de ta mention « champignon peu commun ». Rien dans cette image un peu floue ne permettait cependant de l'affirmer catégoriquement : le manque de profondeur de champ et la couleur jaune du fond (observation dans l'ammoniaque ? ou mauvais réglage du point blanc ? Ou les deux combinés ?) ne permettaient pas d'être aussi catégorique que tu l’affirmes. Il s’en fallait de peu : la simple mention "sporée blanche" aurait suffi à parfaire la devinette ...pour les seuls "afficionados".
"Inconvenant" ? Je ne suis pas administrateur et ce n'est pas à moi d'en juger. Non, les jeux de devinettes (de mon point de vue) sont toujours plaisants :
- pour autant qu'on en applique la règle : fournir une information nécessaire et suffisante
- ... et par dessus tout, pour autant qu'on soit assuré de trouver des joueurs en nombre suffisants !
Je voulais amicalement attirer ton attention sur le fait que les mycologues sont encore très peu nombreux sur ce merveilleux forum - et que ces quelques "isolés" s'efforcent d'abord aujourd’hui d'y faire oeuvre pédagogique (sinon, mais pourquoi pas ! prosélyte). Et ça commence souvent par le B-A BA. Loin en tout cas de la face Nord de l’Everest que tu leur proposais.
Comme mettre un nom sur une chose n'est jamais qu'un prétexte à s'ouvrir au monde et à mieux le comprendre, pourquoi n'en profiterais-tu pas pour expliquer un peu à nos correlégionnaires :
- ce qui caractérise un tricholome et quel sont leur place dans la classification des champignons supérieurs lamellés. Tu auras du succès : c’est un genre sympathique - il recèle quelques comestibles recherchés, et face à ces Bons, même un Méchant, pour faire bonne mesure ! Et ils se déterminent par surcroît presque tous macroscopiquement.
- la place très particulière, « transitoire », de "T." goniospermum (puisque c'est en fait un Lyophyllum)
- ainsi que la réaction qui permet de faire la coupure entre ces deux genres supposés. Comme elle est d'ordre microchimique, cela interesserait probablement divers microscopistes non mycologues).
A ton tour maintenant :o
Sporée blanche.
Milieu d'observation :
Spores : congo amoniacal + milieu d'observation de Clémençon
Cheiloscytides et cuticule (cette dernière en coupe radiale, c'est important et c'est un tout petit piège) : Rouge Congo SDS
Quiconque a vu ses trois éléments - et surtout les cheilos après avoir compris de quoi il s'agissait avec la cuticule et les spores - peut d'autant moins se tromper qu'il s'agit d'un champignon plus commun qu'on ne le croit et qui pousse partout en ce moment.
Cordialement,
Claude
NB
Planapo 100 DIC pour les spores, planapo 63 DIC pour le reste.
-
Bonjour à tous,
Bonjour Michelchel
Est-ce un jeu, aurais-tu la réponse ?
Ou un appel à détermination ?
Comme tu parles de "champignon peu commun" j'imagine que tu sais de quoi il s'agit. Mais attention, nous ne sommes pas sur un forum mycologique ! Et même si c'était le cas, la photo ne permet pas de se faire une idée sérieuse ne serait-ce que du genre !
Entre les inocybes, les entolomes et les "tricholomes" (ou les Lyophyllées) plus ou moins goniosporés, sans parler de certaines "croutes" à spores gibbeuses, on pourrait allègrement se promener d'un bout à l'autre de la classifacation des basidiomycètes pour faire des conjectures qui de toutes façons n'intéresseraient pas je le crains, en l'état de tes renseignements 99,5 % des abonnés de ce forum....
Attendons détails complémentaires, donc.
Cordialement,
Claude
-
Salut André,
Bonjour à tous,
Est ce que la présence ou non de ces macrocystides sert à la détermination de certaines espèces?...Si c'est le cas,je reste dans mes mousses!!!Bon, cette photo plait (j'en suis ravi - mais essentiellement pour ce qu'elle montre ; je la trouvais simplement moins sexy que la précédente !) : désolé d'avoir paru jouer les faux modestes. De toute façon, c'est le hasard qui souvent décide...
Pour en revenir à ta question un brin taquine, tu n'échapperas pas au pensum de ma réponse !
Dans le cas des russules (et des lactaires, mais je connais moins bien) leur présence est (presque) sytématique. Ce n'est donc pas présence vs absence qui est déterminant (à deux ou trois exceptions près).
Et rassure-toi : cette présence saute aux yeux. Ces cellules sont en général émergeantes ; on rame beaucoup plus, surtout sur exsiccata, quand elles sont immerses, ce qui arrive , ou rares. Mais alors leur singularité chimique abrège nos tracas.
Un peu de sulfoaldhéyde (acide sulfurique + vanilline ou benzaldéhyde ou pipéronal) et le tour est joué : elles se colorent en gris noirâtre ou en pourpre violacé, selon l'aldhéyde. Et à petit grossissement (x 10 ou x 40) le "paysage" devient très parlant. Voir Photo jointe à cet effet (*)
C'est plus leur forme, encore que cette forme soit monotone (fusiforme ogivale), le fait qu'elles soient immerses ou saillantes et leur taille (d'où mon courriel initial) qui peuvent fournir des indications. La manière (vive ou faible) dont elles réagissent aux réactifs susnommés est un autre trait.
Leur abondance aussi, parfois : un ami russulologue a établi un système de comptage, et donc une cotation "objective", basé sur leur fréquence par mm2 !
En fait, ce caractère, comme quelques autres, a été jusqu'à présent absolument négligé du fait de son apparente monotonie (et Bart Buyck, dont je parlais, tente de le réhabiliter : travaillant sur les russules exotiques, et principalement africaines, il en tire un précieux parti).
Tempérons toutefois : c'est souvent plus au niveau des sections, qu'on a d'autres moyens de distinguer, que des espèces, que ces observations ont une certaine homogénéité et sont pertinentes).
Pour résumer : la détermination d'une russule au niveau spécifique est un sport passionnant, qui fait entrer en jeu un nombre considérable de caractères mais qui ne s'appuie pratiquement pas, pour l’instant, ou rarement, sur les attributs des macrocystides.
Tu peux donc dormir en paix : lorsque tu croiseras, entre une touffe de Polytric et un coussin de Leucobryum, une russule mystérieuse, tu pourras la cueillir pour tenter de lui donner un nom sans avoir à lui triturer ses macrocystides. Mais ce qui t’attend ne sera pas moins coton pour autant…
Amicalement,
Claude
(*) Fragment de lame regonflé comme le précédent, immergé dans une goutte d'acide sulfurique à 80 % additionnée de pipéronal (d'où la réaction rougeâtre sombre et non noire ou grise comme dans la sulfovanilline) . Obj. Plan Neofluotar x 40 (et prise de vue en champ très large).
-
Bonjour à tous,
Bien que la photographie ne soit pas de très bonne qualité, j'ai eu envie de vous faire partager cette observation.
Les russules (et les lactaires) ont toujours de très grosses cystides fusiformes (qu'on appelle macrocystides)....disais-je.
Le nom de "macrocystides" rappelle certes la taille de ces éléments mais ce ne sont pas leurs très grandes dimensions (jusqu'à 80-100 µm de long pour un diamètre au sommet de 10-15 µm) qui justifient en soi cette appellation particulière. Au terme de macrocystides, d'autres auteurs préfèrent d'ailleurs celui de pseudocystides.
Disons, pour résumer, qu'une cystide au sens strict est une cellule stérile qui peu ou prou prend naissance au même niveau que les basides et s'intercale entre elles. Les unes et les autres s'enracinent dans ce qu'on appelle l'hyménopode (*).
Les macrocystides des Russules et des Lactaires (notamment) sont d'une autre nature. Chimiquement (j'y ai déjà fait allusion) et morphologiquement.
Elles prennent naissance bien plus profondément que les basides, sur une autre assise de cellules.
Si vous vous reportez à ma précédente photo, vous verrez qu'on n'y distingue pas cette base. En général, il faut fortement dissocier sa préparation pour arriver à voir quelques rares macrocystides éparses et encore entières.
Ici au contraire, un coup de chance (et le contraste interférentiel) m'ont permis d'observer et de photographier une macrocystide entière, encore en place.
(*) de : hymenium (= surface fertile) et pode : pied. Hyménopode = assise des cellules de la surface fertile.
Fragment d'exsiccatum regonflé dans quelques gouttes d'amoniaque portées à ébullition, examiné dans de la potasse à 5 %. Obj. 63, DIC.
-
Salut Marcel, Bonjour à tous,
Cela dit, si tu pouvais m'en récolter un peu pour des travaux pratiques de microscopie, cela m'aiderait beaucoup !Tu mets les pieds dans n'importe quelle sapinière après la pluie : le sol, les mousses, les lichens, les feuilles des arbres mêlés - tout en est jonché !
Tes photos sont superbes.
Je ré-envoie, recadrée, uniquement par plaisir narquois : il faut savoir que Disney Corp. est champion de la protection de l'image et un redoutable ferrailleur juridique quant il s'agit de poursuivre quiconque leur "pique" un petit Mickey
:P
Amitié,
Claude
-
Modèle acheté en 2002
Objectifs
Plan-Néofluar 2,5/0.075
Achroplan 10/0.25
Plan-Néofluar 40/0.75
Plan-Apochromat 63/1.4 DIC (immersion)
Plan-Apochromat 100/1.4 DIC
Occulaires
Pl 10/23 Br. foc.
Condenseur
Universel achro.-apla. 0.9 H D Ph DIC
Tube binoculaire
30°/25
Eclairage
Hal. 100
Divers
Modules Optovar : 1.25 et 1.6
Tube à dessin Zeiss. Réglable de x 4 à x 14, ce qui représente une perte par rapport au tube à dessiner de 160 mm qui montait, lui, à x 1,8 ; perte compensée par l'adjonction futée de deux positions de sortie, par rotation de la tête : x1 équipée d'un filtre vert et x2. Qualité irréprochable, comme le précédent mais gros mangeur de lumière.
Particularités
Platine 75x50 motorisée
Moteur MCX-2 (non représenté : c'est un petit parallélépipède H < 10 cm, L. 20 cm, P. 15 cm. environ).
Logiciel Axiovision 3.1 (pour sa fonction Mark and Find, la seule que j'utilise ; ce logiciel propriétaire n'étant pour le reste compatible qu'avec une caméra AxioCam de chez Zeiss, laquelle coûte la peau des fesses pour une résolution semble-t-il inférieure ou tout au plus égale à celle des APN d'aujourd'hui).
Remarques
Adaptateur Coolpix sur sortie vidéo : ils me l'ont bidouillé pour. Conséquence : il est très fragile (la partie chromée - i. e. l'adaptation pas de vis - ayant tendance à se décoller (sic). Déjà remplacé une fois). J'ai donc en réserve (non représenté) un adaptateur Zeiss classique avec sa propre bague compatible avec le pas de vis du Coolpix. Inconvénient : tirage plus important, donc champ plus petit (mais c'est du costaud !).
Quelques gadgets bien pratiques :
- un petit bouton poussoir (non visible : au dos du statif) qui permet de mémoriser (via le couplage lociel) la quantité de lumière par objectif et type de filtre ou d'éclairage enclenché (DIC, Optovar, filtres optionnels)
- un "up-down" motorisé de la platine
- une série de filtres neutres pour l'éclairage (cf. vignette inférieure) et une position automatique 3200° K
- ...et un tas de boutons qui ne sont pas actifs, seule la platine étant pour l'instant motorisée.
Avantage de la motorisation ?
Permet (notamment) un repérage et une mémorisation de n positions xy. Très commode pour un pré-repérage à un faible grossissement et une promenade ultérieure en immersion. Cette fonction (précise à 80 nm. soit, en arrondissant 0,1 µm) suppose un couplage micro+moteur & pc et l'utilisation du logiciel Axiovision. On peut de la sorte se constituer des bibliothèques de positions pour des montages permamnents. Ca n'a de sens bien sûr que pour retrouver en immersion des détails "fins".
Pour la petite histoire, le technico-commercial Zeiss qui a bâti ce modèle sur le papier et établi le devis ignorait que la version complète du logiciel Axiovision était nécessaire pour récupérer la fonction "mark & find". Il a donc été obligé de me l'offrir (ça tombait bien parce que ce soft, protégé par clé physique et tout le toutim, mais au fond assez trivial au vu des logiciels classiques de traitement de l'image, est lui aussi hors de prix).
C'est du beau matos et j'en suis très content. Mais le jour où vous vous ferez ce genre de cadeau, ne larguez pas votre ancien micro…
Celui-ci est quasi intransportable (> 30 kg) ; je m'y suis hasardé une fois et ne recommencerai pas. Je suis donc en train de mettre à niveau mon "vieux Lab 16" (Zeiss également, fiche suivra) avec lequel je me suis initié à la mycologie et à la microscopie, qui m'a fidèlement suivi pendant quinze ans, m'accompagne en vacances (eh oui, c'est encore là qu'on a le plus l'occasion d'herboriser) et surtout dans tous les congrès, séminaires, et autres journées mycologiques.
-
Bonjour André,
Bonjour à tous,
Volontiers. Je peux dire "comment je le fais marcher" et ce que je regarde avec mais certainement pas "comment ça marche" (MpX et d'autres sont bien plus calés et résumeront le pourquoi du comment si nécessaire ; il est d'ailleurs probable que le sujet ait déjà été détaillé sur le site). Dès que j'ai un petit moment, je reviens avec quelques exemples sur le forum ad hoc.
Amitiés,
Claude
-
Salut à tous,
et tout d'abord merci à Aphylla pour avoir "lâché ce fauve" sur le forum et à Fred pour ses images superbes et ses explications.
Et que m'importe le nom exact de cet animal, je sais que c'est un rotifère, que de plus c'est un chasseur, et ça me suffit!... Pas tout à fait d'accord avec toi, Christian : nommer fait partie intégrante de notre plaisir, et fait corps avec l'activité-même de tout naturaliste, je crois. Tout ceux qui regardent comme absurdes nos passions (99.9 % de la population : tant pis pour eux...) oublient tout simplement que l'identification (avec ses limites ! ...les TRUC spec., TRUC cf. Machin, TRUC affine Bidule et consorts) et l'activité que cette démarche suppose en amont participent de notre humanité elle-même : êtres de langage qui tentons à travers lui de donner du sens au chaos. C'est un autre débat, peut-être, qui aurait dans ce cas davantage sa place sur "Bavardages". Mais c'est aussi l'une des richesses des "sciences naturelles" que de nous ouvrir à autre chose que la contemplation pure. En nommant "mes" champignons (enfin, en essayant...), je partage un peu mieux leur intimité, j'ai l'illusion de comprendre un peu mieux leur mystère et le mystère du vivant ET je rejoins, à travers les siècles, tous les naturalistes sans le travail desquels cette démarche serait impossible. D'une certaine façon, je maintiens ainsi avec eux un dialogue qui se joue du temps...
Cet humanisme me paraît extrèmement précieux.
Amitiés,
Claude
-
Bonjour Micromars,
Joli correction. Et par surcroît tu nous fais découvrir un excellent petit logiciel dédié et gratuit. Deux fois merci.
Claude
-
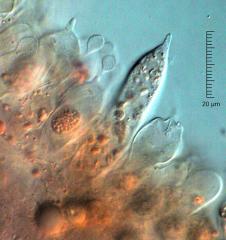
Bonjour à tous,
Suite de l'échange commencé avec des photos de basides puis de spores de russules.
Entre les basides (qui engendrent, portent au bout de leur stérigmates cornus puis expulsent les spores) on peut parfois observer des cystides. Ce sont des cellules stériles. Quand elles existent, elles sont alors présentes en grand nombre sur l'arrête de la lame et disséminées (...ou tatalement absentes) sur ses faces.
Les russules (et les lactaires) ont toujours de très grosses cystides fusiformes (qu'on appelle macrocystides). Leur contenu cellulaire est riche d'un suc qui réagit plus ou moins fortement en gris noirâtre en présence de certains réactifs (sulfoaldhéides : mélange d'acide sulfurique à 50 % et de vanilline par exemple)
Voici une cystide de russule. A sa gauche, deux basides portant des spores naissantes. A sa droite, une baside qui a déjà lâché les siennes et dont les parois commencent à se collapser.
Exsicc. regonflé au chloral-lactophénol, rincé, coloré au bleu de crésyl, rincé puis dissocié dans de la potasse à 5 %. (On peut faire plus simple !)
Obj. 63, contraste interférentiel, accentuation sous photoshop.
La photo est un peu sombre, mais elle est je l'espère suffisament didactique.
Bon après-midi,
Claude









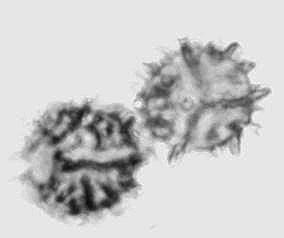
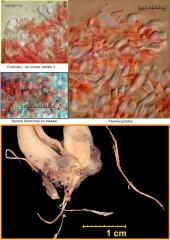
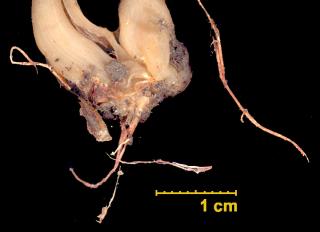




Buxus sempervirens L.
dans Pollens et Spores
Posté(e)
Bonjour Chris,
Superbe. Et merci pour l'info sur la Buxaie de Coudraie. Allant souvent en vacances en Savoie, j'y ferai un saut.
Amicalement,
Claude
PS
...Je ne peux m'empêcher de signaler, pour les mycofêlés, ou tous amateurs de (gracieux) brimborions, que la litière de feuilles de buis pourrisantes accueille parfois (à l'automne) un petit Marasme strictement spécialisé dans leur décomposition : Marasmius buxi. Allure très classique de petit (tout petit) champignon à lames ; son pied est littéralement greffé sur la feuille. Donné pour rare : mais qui passe son temps, en automne, à quatre pattes le nez dans la litière d'une buxaie... ?