-
Compteur de contenus
473 -
Inscription
-
Dernière visite
Messages posté(e)s par Sébastien Klein
-
-
Bonjour Dominique et tous,
Merci pour cet excellent exposé, encore une fois j'ai appris pleins de choses.
Admirativement
Seb
-
Bonjour Sébastien,
Joli petit coin de paradis... Quand j'ai commencé c'était dans ma chambre avec un minuscule bureau...
Amitiés
Seb
-
Bonjour Scrophulaire,
On en parle en MP.
@+
Seb
-
Par ici aussi on en parle : http://www.microscopies.com/DOSSIERS/PRATIQUES/TPM-3/COUPARAF%20.htm
Seb
-
Bonjour Michel et à tous,
Pour ce qui est de 10 fois une seconde, je me posais la question si ce n'était pas une question d'oxydation du colorant ou autre à chaque sortie du bain ? mais comme je suis sure de rien, je me suis pas avancé sur ce sujet....
Pour le terme fixer :
Fixation : c'est technique de conservation des cellules et des structures. La fixation rend les membranes plasmiques perméables aux colorants et stabilisent les macromolécules.
J'avoue, je suis le premier à faire l'amalgame, mais ça ne change rien à ce que j'ai conseillé plus haut, il faut dégraisser les lame avant l'étalement cellulaire .. et ça je l'ai testé, c'est du vécu.
En tous cas, merci Tryphon pour ce petit rappel car avec le temps, quotidiennement nous employons des mots et on en oublie souvent le sens.
Amitiés
Seb -
Bonjour Phil,
Merci, oui la première fois, mais maintenant ça me fait plus grand chose..
Curieusement
Seb
-
Ok,
si jamais Marcel Lecomte t'envoie une réponse négative, dit le moi, je t'enverrai 1 gramme gracieusement, ça sert à ça aussi un forum .. :D
Amicalement
Seb
-
Bonjour vardar,
Malheureusement c'est pas de moi. :(
Il te faut combien de grammes ? je peux peut être te dépanner ??
Amicalement
Seb
-
Bonjour Jean Marie et Michel,
Jean Marie, c'est bien 10 fois 1 seconde, je t'avoue que je n'ai pas de réponse, de plus je n'ai pas essayé dans l'autre sens... j'ai des protocoles de chez RAL qui se font ainsi donc j'ai essayé comme ça ... désolé... (si quelqu'un a une réponse ??)
Michel, pour rincer j'utilise une pissette ou parfois un tube de borel rempli d'eau ou alcool selon la coloration. Normalement si ton frottis est bien fixé rien ne se décolle, le mieux pour que la fixation se fasse correctement il faut dégraisser la lame à l'alcool ou à la flamme, ça m'est arriver d'oublier de dégraisser une lame avant un frottis sanguin, ba pendant la coloration l'étalement cellulaire se fait la malle...
Amitiés
Seb
-
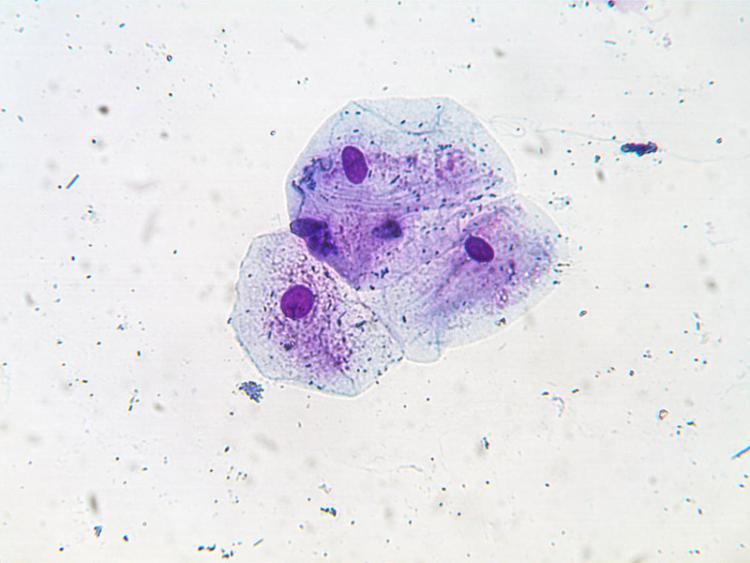
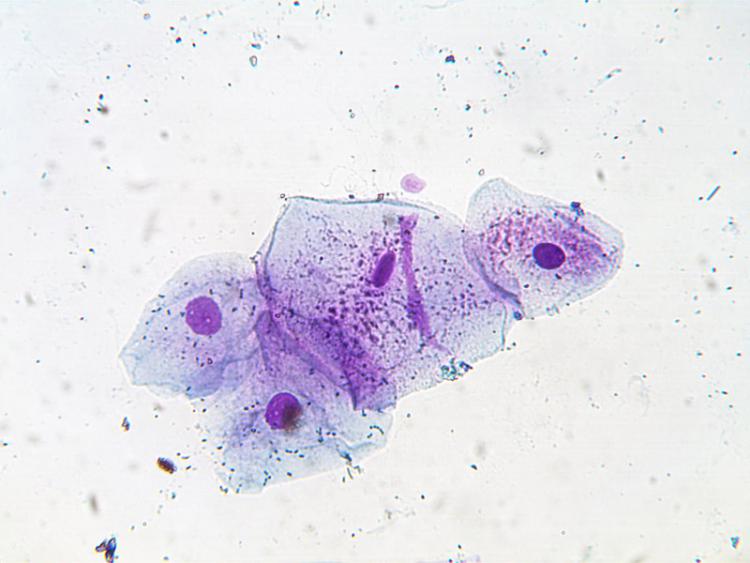
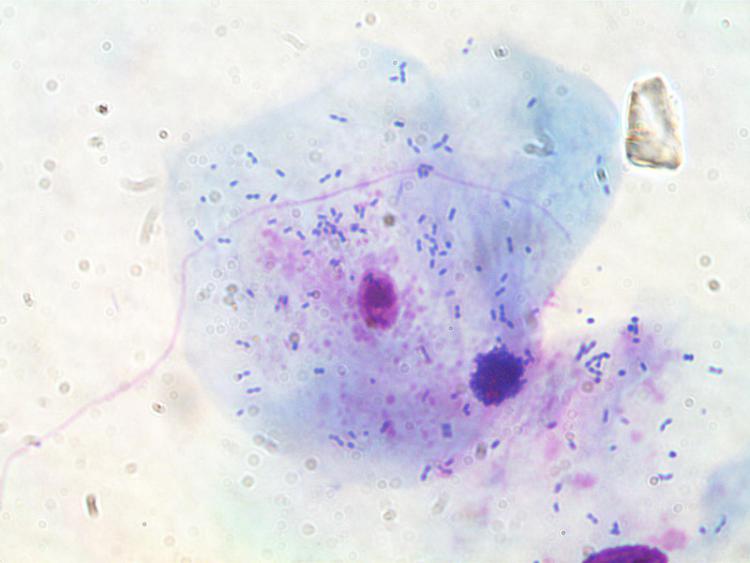
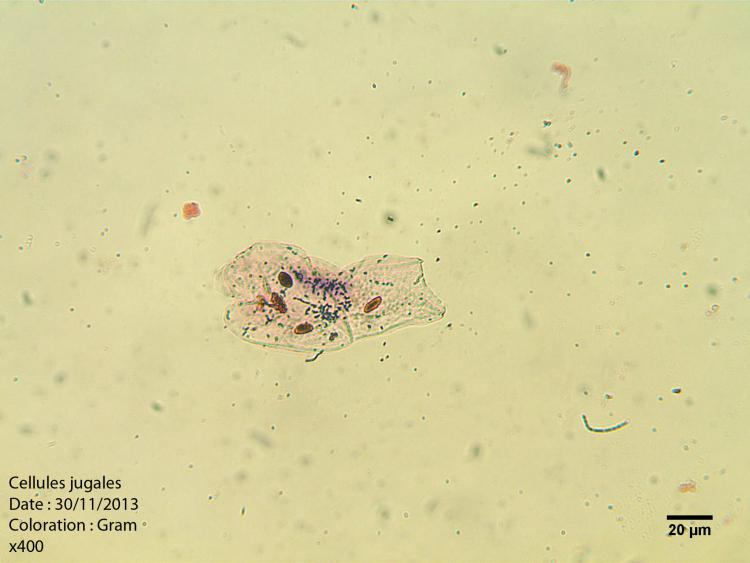
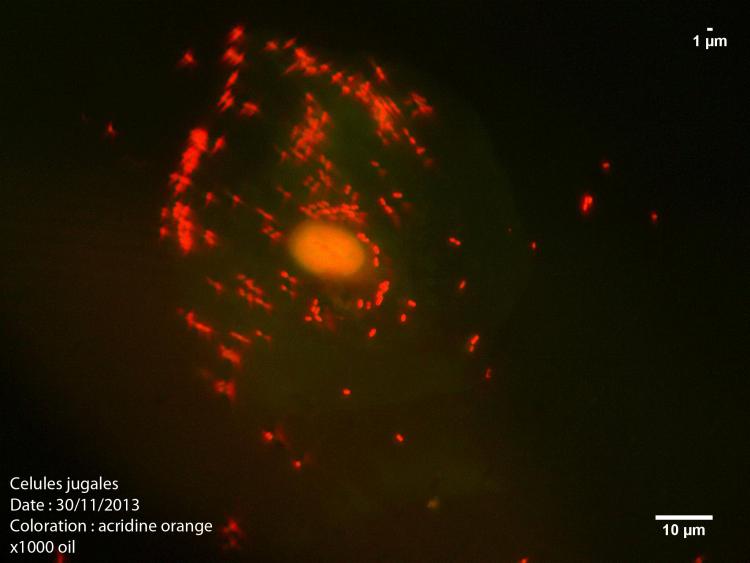
Bonjour à tous,
Les cellules jugales, grand classique me diriez-vous.... mais si intéressantes pour tester toutes sortes de colorations...
En voici une :
Frottis fixé à l'alcool,
tremper 10 fois 1 seconde dans l'éosine, puis rincer à l'eau,
tremper 10 fois 1 seconde dans le bleu RAL, puis rincer à l'eau,
éponger l’excédent avec un papier filtre, puis observer.
x400
x1000
On distingue bien :
La membrane plasmique,
le cytoplasme,
les plis cytoplasmique,
les noyaux,
les bactéries,
et les granulations cytoplasmique.
Bonne observation.
Seb
-
Bonjour Vardar et tous,
Merci pour les infos sur le Qdot, effectivement j'ai vu les prix chez life technologie c'est super chère !!!
Pour l'acridine orange c'est la première fois que je l'utilisais, j'ai utilisé 1g/100ml et je sais pas du tout si c'est correct, je savais qu'il fallait un pH +/- de 5 donc j'ai utilisé de l'eau déminéralisée qui est à peut près de 5.5.
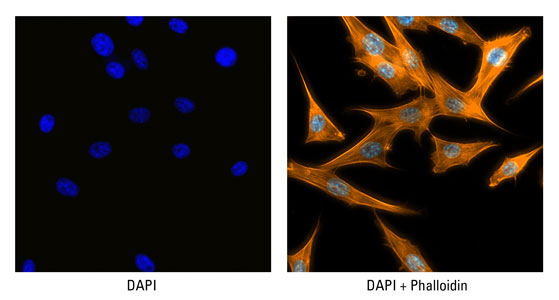
En revanche pour l'ADN j'ai déjà utilisé le DAPI, EX max à +/- 360 nm, EM +/- 460 nm, il faut que j'en commande un de ces jours pour vous faire quelques clichés. Il existe aussi des contre-colorations, en voici une le DAPI + phalloïdine voir photo ci-dessous.
le DAPI colore l'ADN et la phalloïdine colore les filaments d'actine.
Amitiés
Seb
-
Ok.....
Alors dans mon premier post je dis "Ex : 513 à 593 nm" je me suis trompé, j'ai utilisé le filtre de λ 435 - 480 nm, donc oui pour le FITC.
Vu que tu enseignes la fluo, j'ai une question, as-tu déjà utilisé les filtres en 655 nm à utilisé avec le fluorochrome Qdot ?
en fait on m'en a donné un neuf de chez OMEGA (400$) il est installé (je peux avoir 3 filtres dans le touret) mais je n'ai jamais pu l'essayer, je crois qu'il peut servir en immunofluorescence avec ce fameux Qdot..
As-tu plus d'info ?
Curieusement
Seb
-
Bonsoir Michel et Vardar,
Vardar pour les filtres cela dépend de ce que tu souhaites faire ?? on choisit le filtre en fonction du fluorochrome utilisé... j'ai écris un petit article sur la fluorescence ici : http://forum.MikrOscOpia.com/topic/13079-microscope-fluorescence/?hl=fluorescence
Michel voici mon microscope.
Amicalement
Seb
-
-
Ce n'est pas des trace de doigts (en fin je crois) je l'ai vu aussi tout à l'heure, regarde la dernière photo en FLUO avant celle en fond clair, il n'y a plus rien, en fait je prenais mes photos en fluo lumière du labo allumé, j'ai cherché un moment ce matin d’où cela venait..... une fois dans le noir ça disparait ....
Je vais refaire une coloration et poster deux photos identique une en fluo et l'autre en fond clair.
-
-
-
Bonjour Michel,
C'est la première fois que j'utilise l'acridine orange, je sais juste que ça marque l'ADN et l'ARN comme je l'ai dis plus haut.
Je peux passer au 400 et 1000, je poste tout ça dés que possible.
Merci
Seb
-
Bonsoir Tryphon,
L'acridine orange sert à marquer l'ADN et l'ARN en fluorescence, c'est la première fois que je l'utilise..
Amicalement
Seb
-
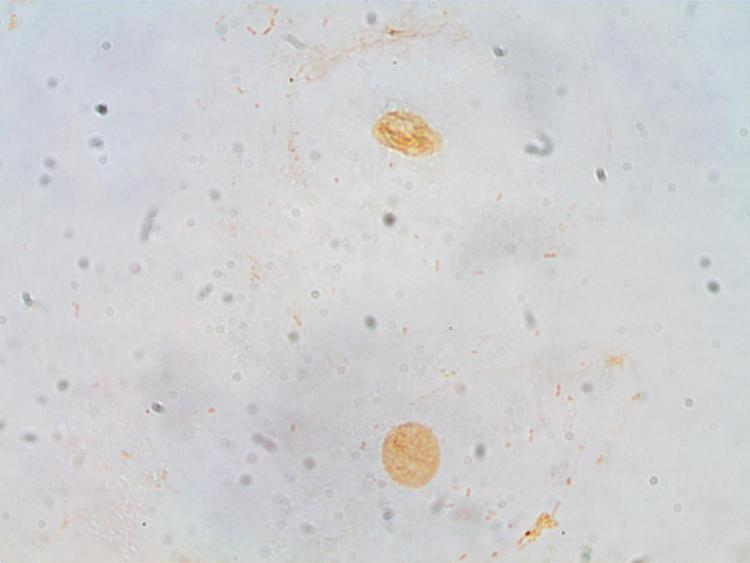
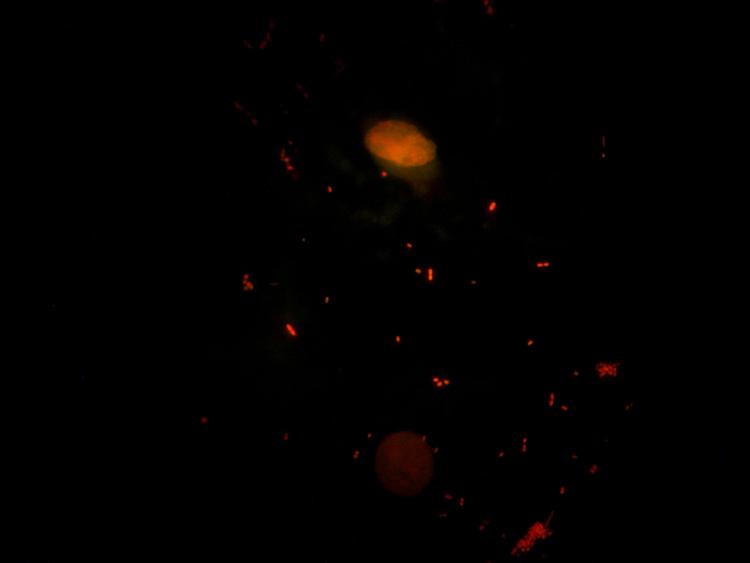
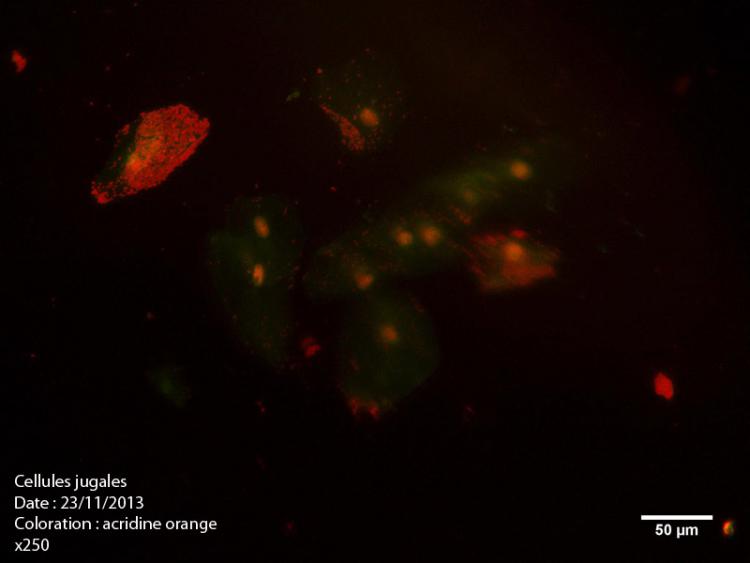
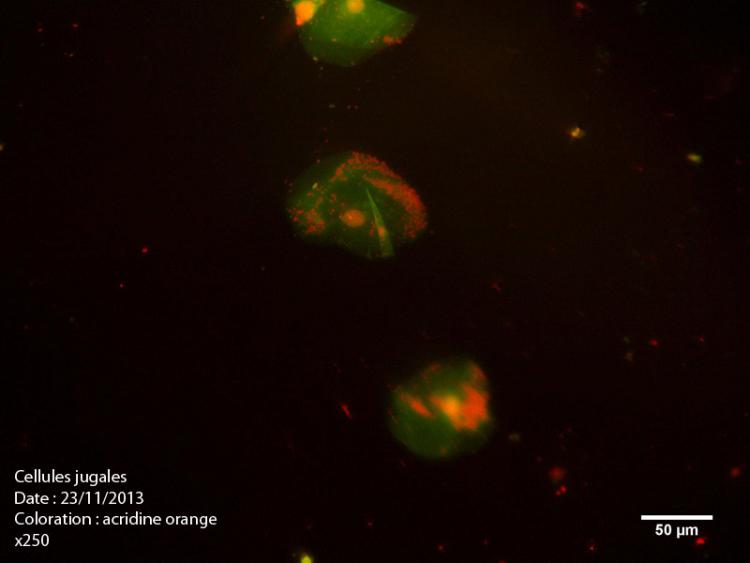
Bonsoir à tous,
Je me suis procuré de l'acridine orange (en poudre), donc je procède à quelques tests.
Voici le premier sur des cellules jugales :
Solution à 1% Acridine orange + eau déminéralisée,
Temps de coloration 1 minute.
Ex : 513 à 593 nm
Vous en pensez quoi, avez vous des suggestions ?
D'autres essais sont à venir...
Amicalement
Seb
-
Me revoilà,
Bleu d'aniline - Colore la callose (bleu de méthyle employé en solution à 1% acidulée par 3% d'acide acétique)
Ziehl Nielsen - Colore les membranes cutinisées.
Rouge de ruthénium - Colore les composés pectiques.
Soudan III - Colore en rouge les lipides
Mais également des colorants spécifiques au constituant des menbranes:
lignigne
cellulose
callose
cutine
pectine
Je pense avoir répondu à tes questions ?
Amicalement
Seb
-
RE,
Alors voila ce que je peux te dire (possible que tu connaisses déjà)
Carmin aluné - Colore en rose les tissus contenant de la cellulose
Vert d'iode - Colore en vert les tissus lignifiés
Carmino vert de Mirande - C'est un mélange de vert d'iode et de carmin aluné pour obtenir une double coloration.
Rouge neutre - Colore les vacuoles
Orcéine acétique - Colore les chromosomes de racines des liliacées
Lugol - Colore les noyaux des cellules végétales et met en évidence les grains d'amidon
Sinon voici mes essais :
http://forum.MikrOscOpia.com/topic/13067-ra%C3%A7ine-terminale-de-bulbe-de-dahlia-en-fluorescence/
http://forum.MikrOscOpia.com/topic/13070-tubes-spiral%C3%A9s-feuille-d%C3%A9pinard-en-fluorescence/
http://forum.MikrOscOpia.com/topic/13069-tubes-spiral%C3%A9s-du-poireau-en-fluorescence/
Amicalement
Seb
-
Bonjour scrophulaire,
De tête comme ça je peux pas te répondre, je vais feuilleter mes classeurs et je reviendrais vers toi.
En revanche en fluorescence on peut mettre en évidence certaines membranes, fait quelques recherches sur mes sujets en FLUO voir si c'est ce que tu cherches c'est juste des essais de colorations, je suis désolé je peux pas te mettre de liens car je réponds avec mon smartphone.
Je reviens vers toi plus tard.
Amicalement
Seb
-
Bonjour à tous,
Merci pour vos commentaires.
Amicalement
Seb




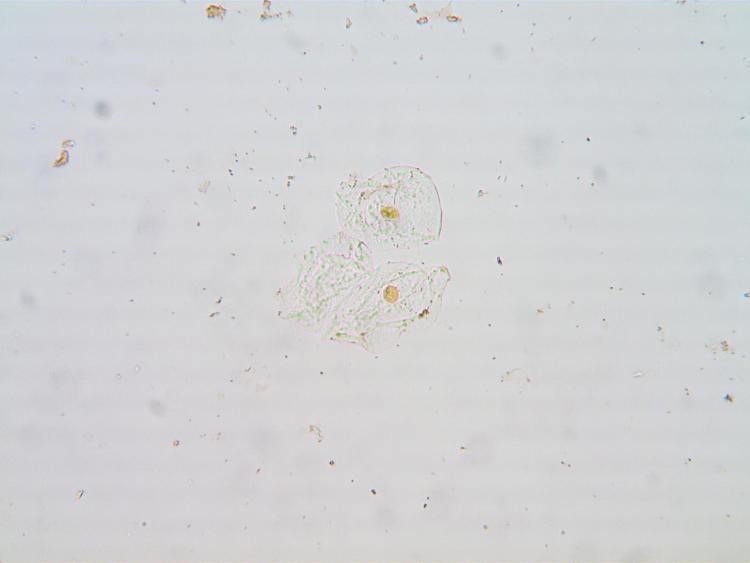
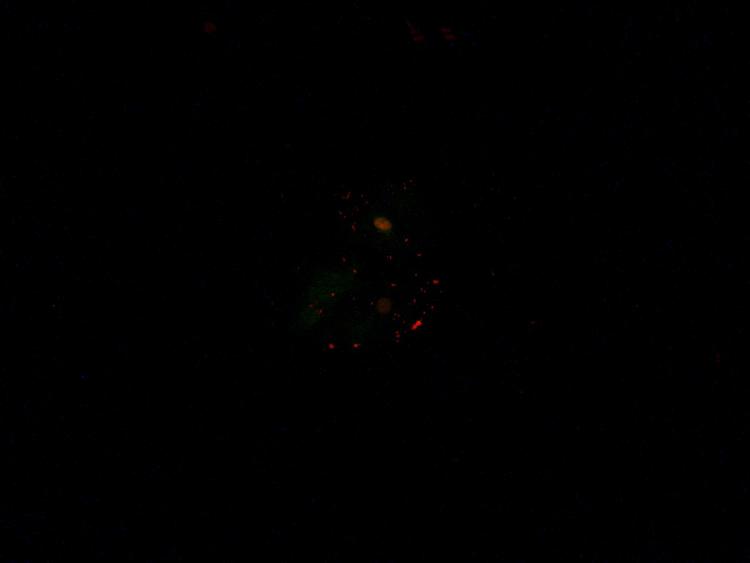
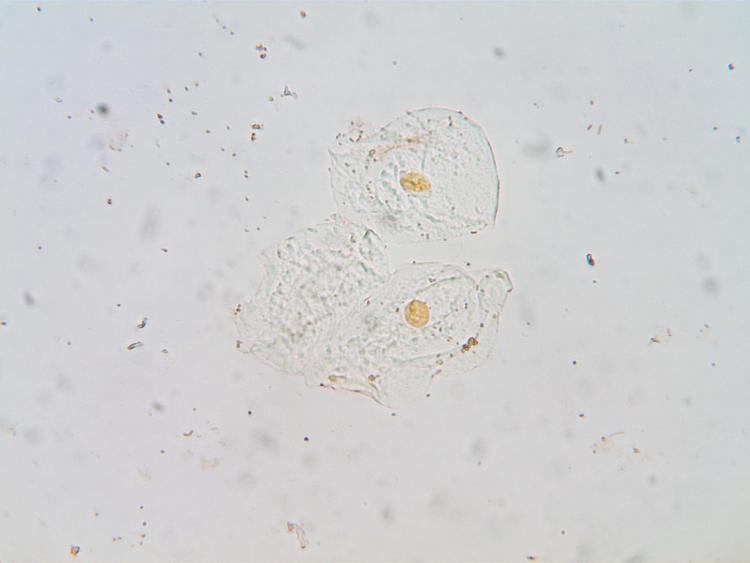
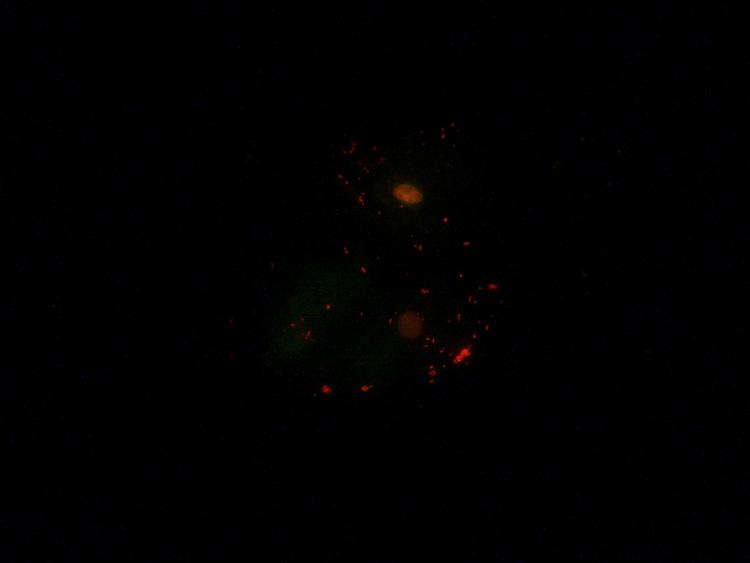


Cellule de joue
dans Anatomie Pathologie Humaine
Posté(e)
Bonjour,
Pas mal, ce que j'aime bien avec les cellules jugales c'est que l'on peut tester plein de colorations, celle que j'ai la mieux réussi pour moi et là http://forum.MikrOscOpia.com/topic/13361-cellules-jugales-test-coloration/?do=findComment&comment=46385.
Amicalement
Seb