
JPL80
-
Compteur de contenus
141 -
Inscription
-
Dernière visite
Messages posté(e)s par JPL80
-
-
D'une grande complexité, mais éducatif et passionnant, comme toujours.
Merci Dominique.
JPL80
-
Très instructif!
Merci Dominique
JPL80
-
Un article passionnant, et une chose que je découvre: les nutriments des feuilles sont "rapatriés" dans le tronc avant la chute de celles-ci.
Peut-on assimiler ces nutriments à de la sève élaborée, et cette migration se fait-elle par les mêmes canaux (vaisseaux du phloème)?
Merci pour ce formidable partage de connaissances Dominique.
Jpl80
-
Bonsoir Dominique
Tout à fait d'accord avec Christian.
Merci
JPL80
-
Merci à tous les deux.
Je vais essayer la seconde formule. Combien de temps le bain?
JPL80
-
Merci Dominique.
Les botanistes se régalent à la lecture de tes articles.
Les coupes et colorations au Aslim III sont très parlantes.
J'ai à nouveau une question d'ordre technique: les pétioles et rhizomes sont plutôt durs; est-ce que tu les ramollis pour faire les coupes?
J'ai moi même essayé de ramollir des jeunes tiges lignifiées de noisetier dans un bain d'acétone/acétate de cellulose, et ceci durant 2 mois environ, sans obtenir aucun ramollissement.
A quand la suite?
Jpl80
-
Bonjour, et merci Dominique!
C'est toujours aussi instructif et on en vient à attendre tes articles avec impatience.
Comment réalises-tu tes coupes? (Ranvier?).
JPL80
-
Passionnant!
(Comme toujours)
JPL80
-
Bonjour Klaus
En effet, c'est une très belle coloration, et avant cela une très belle coupe!
As-tu procédé par inclusion dans la paraffine avant de passer au microtome?
Le résultat est gratifiant, mais surtout il y a une très bonne différenciation des tissus.
J'espère que tu nous feras savoir quand tu commenceras la production.Bon courage§
JPL80
-
Passionnant, comme toujours.
L'amateur de botanique que je suis se régale en te lisant.
Merci Dominique.
Nb. Il serait intéressant de conduire la même étude sur des plantes proches morphologiquement comme le Chénopode ou l'ambroisie...
Peut-être m'y mettrai-je un jour!
JPL80
-
Bravo et merci à tous!
Je me régale!
JPL80
-
Bonsoir à Tous
Depuis quelque temps j'utilise du PEG 1000 acheté sur mon-droguiste.com (24,45€ le kg).
C'est très facile d'emploi: fusion à 42°C environ (donc les échantillons ne sont pas endommagés par un échauffement trop fort), coupe aisée (personnellement avec le rocking microtome) et dissolution dans l'eau... Donc pas de manipulation de produits toxiques.
Je l'utilise surtout avec des tissus végétaux, et j'ai fait quelques tentatives avec des tissus animaux, sans trop de succès pour l'instant mais je vais persévérer.
J'ai essayé également le PEG 4000, mais ne suis jamais parvenu à faire des coupes exploitables à cause de l'effritement important de ce produit lors de la coupe.
Bon courage à toi Jean-Louis.
JPL
-
Merci Dominique
J'apprends beaucoup de choses.
JPL80
-
Merci à tous!
C'est vraiment sympa et encourageant.
Je vais m'attaquer aux colorations.
JPL80
-
Merci Dominique.
C'est encourageant
JPL80
-
Bonjour
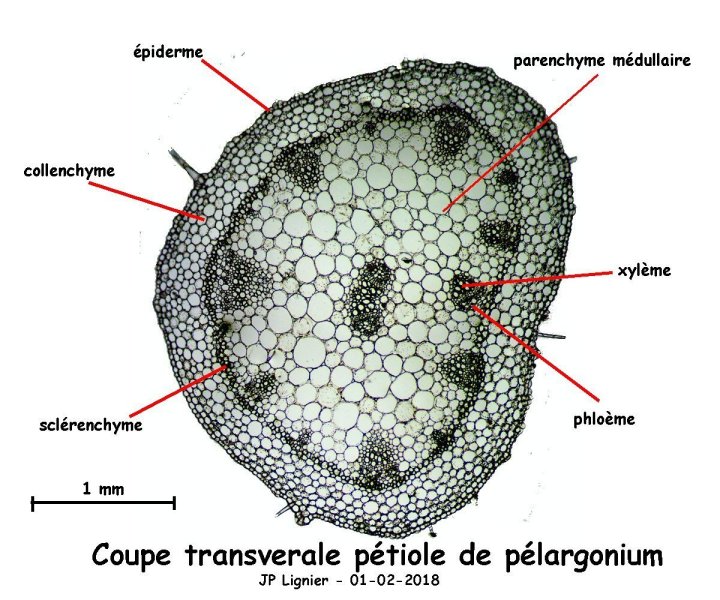
Ayant à peu près réussi une coupe dans un pétiole de Pélargonium, je me suis essayé à identifier les tissus en recherchant les informations dans la documentation à ma disposition (Atlas de la structure des plantes, Biologie Végétale, et bien sûr les textes publiés sur le forum). Voici ce que cela donne:
Je ne suis pas absolument sûr de la localisation de certains tissus (le sclérenchyme par exemple) et je m'interroge sur le faisceau situé au centre qui montre des lumières cellulaires larges et à paroies épaisses (xylème?) et d'autres plus petites. Habituellement on trouve plutôt à et endroit du parenchyme médullaire et parfois de la moelle.
JPL80
-
Travail qui s'apparente à une véritable enquête. Passionnant!
JPL80 -
Bonsoir Dominique
Merci pour ta réponse.
Je possède 2 microtomes de type Ranvier:
- l'un d'assez bonne fabrication, mais sans doute un peu fatigué; le filetage a des points durs, et il est dépourvu de mâchoires. L'avancée de l'échantillon (dans de la moelle de sureau ou du polystyrène) subit des à-coups, notamment à cause du frottement.
- j'en ai acheté un autre il y a quelques mois sur Internet, fabriqué apparemment en Espagne; il est équipé d'une seule mâchoire, et je pensais que cela irait mieux. Mais en réalité il est si mal fabriqué que c'est une honte de le commercialiser (pièces mal ajustées, filetage déplorable); je ne l'utilise plus.
En ce qui concerne les deux modèles que tu présentes:
- le premier est doté de 2 mâchoires; je croyais que c'était un plus car ce dispositif évite les frottements; cela ne suffit visiblement pas puisque tu écris qu'il ne donne pas de bons résultats.
- l'autre, que tu présentes comme meilleur, n'a pas de mâchoires. Est-ce que, malgré tout, le bloc polystyrène/échantillon coulisse et avance régulièrement dans le puits? Et l'avancement de 20 µm par division n'est-il pas important? Quelle épaisseur de coupe peut-on escompter en s'appliquant et en utilisant la schavette (que j'utilise déjà avec mon Ranvier)?.
Pour en revenir aux coupes dans la glace:
- en faisant quasiment "glisser" la lame sur la glace, sans chercher à l'enfoncer, j'obtiens assez souvent des coupes qui me semblent n'avoir que l'épaisseur d'une seule cellule; c'est facile, sans aucune résistance ni écrasement des tissus; je publierai des photos prochainement.
- sur les quelques végétaux que j'ai utilisés, il n'y a aucun endommagement par la congélation. Mais je ne suis pas sûr qu'il en serait ainsi pour tous les végétaux (on sait que le froid endommage certaines fleurs, feuilles etc.). Je n'ai pas encore essayé les champignons.
Bien à toi!
Jpl80
-
Bonjour
Je ne suis sans doute pas le seul microscopiste amateur à se désespérer d’obtenir des coupes suffisamment fines avec le classique microtome de Ranvier et le coupe chou, et ce malgré toute l’application que j’apporte à l’opération.
De plus, mon intérêt premier portant sur la botanique, je me heurte à une quasi impossibilité lorsqu’il s’agit de faire des coupes dans des tiges creuses ou des tissus mous.
Certes, il y a la solution du microtome de laboratoire type Minot et les inclusions dans la paraffine, le paraplast ou le PEG. Mais mon budget ne me permet pas de l’envisager.
J’ai donc essayé de faire des coupes après inclusion dans de la glace et je relate ici cette modeste expérience qui, je le dis d’entrée de jeu, me donne beaucoup de satisfactions.
1. Le matériel : l’investissement initial a été le suivant :
- un petit étau de bijoutier (12,99€ sur Internet), que je fixe sur un coin du bureau.
(nb. Très pratique, orientable, avec mâchoires de 50 mm protégées par du caoutchouc)
- un bac à glaçons (moins d’un euro) :
(nb ; celui que j’utilise est bombé dans le fond de chaque alvéole, ce qui n’est pas pratique ; préférer des alvéoles à fond plat. Par contre, il vaut mieux que les parois des alvéoles soient légèrement obliques car cela facilite le démoulage).
- des plombs de pêche plats (1,80€ les 8) :
(nb. Avec un marteau et un clou ou une vis utilisée comme poinçon, j’ai fait 2 ou 3 creux dans chaque plomb ; ils serviront à maintenir en position les prélèvements de tige qui y seront enfoncés légèrement et coincés).
- quelques petits bacs en plastique récupérés ici ou là (jeux de construction d’enfants, etc.) (nb. Ils doivent être légèrement plus grands que les alvéoles du bac à glaçon), et punaises plates:
- pour le reste, il s’agit du matériel que tout microscopiste possède : coupe chou, lames et lamelles…
2. La procédure pour les tiges :
2.1- l’échantillon de tige, de 3 cm environ, est enfoncé en position verticale dans un creux d’un plomb de pèche ou sur la pointe d’une punaise :
(nb. Si la tige est creuse, il faut d’abord la boucher sur quelques mm avec un petit morceau d’une autre tige pleine d’un diamètre approprié, de sorte qu’elle puisse rester dans la position verticale)
2.2- puis placé dans un alvéole du bac à glaçon :
2.3- qui est alors rempli d’eau et placé dans le compartiment à glace du réfrigérateur.
(nb. Le plomb, la punaise, ou tout autre dispositif approprié, ne servent qu’à maintenir l’échantillon en position verticale et à l’empêcher de flotter à la surface).
2.4- Parallèlement, un petit bac pas tout à fait rempli d’eau est également placé dans le compartiment à glace du réfrigérateur :
2.5- Après congélation, le glaçon contenant l’échantillon est démoulé, posé sur la glace du bac préparé en 2.4, collé avec quelques gouttes d’eau et remis dans le compartiment à glace du réfrigérateur pour consolidation :
2.6- Le bloc est alors placé dans l’étau et la surface est régularisée au cutter:
2.7- Utilisation du coupe chou pour les coupes :
2.8- Qui sont directement déposées sur la lamelle, dans une goutte d’eau :
pour être ensuite préparées pour l'observation.
3. Procédure pour les tissus mous :
Le plus simple est de mettre un peu d’eau dans l’alvéole du bac à glaçon, de le mettre à congeler, de placer ensuite l’échantillon à la surface de la glace, et enfin de remplir l’alvéole en plusieurs fois, avec congélation à chaque fois, afin que l’échantillon soit emprisonné dans la glace et qu’il ne remonte pas en surface.
J’ai essayé avec des tissus animaux et cela fonctionne fort bien aussi.
4. Tissus fins types pétales, feuilles : les placer à plat dans l’alvéole, sur un fond de glace et recouvrir progressivement, avec congélation intermédiaire, comme ci-dessus.
Le glaçon sera ensuite collé sur sa tranche dans le petit bac présenté en 2.5.
En guise de conclusion (provisoire)
Ce procédé est très simple, peu coûteux, et il évite l’emploi de substances toxiques. Mais surtout, après quelques essais sur l'angle d'inclinaison de la lame du rasoir et la pression à exercer, il permet l’obtention de coupes fines réellement exploitables.
A la lumière ce cette modeste expérience et des quelques rares lectures sur le sujet que j’ai trouvées sur la toile, je donne quelques conseils :
- pour éviter la formation de cristaux qui endommagent les cellules, il est souhaitable que la congélation soit rapide (dans un congélateur plutôt que dans le compartiment à glace) ; l’utilisation d’un dispositif cryogénique comme ceux qui sont utilisés avec certains microtomes serait idéal, mais il a un coût.
Pour ma part, je me contente du compartiment à glace pour l’instant.
- la lame du rasoir coupe chou doit être très froide ; je la place donc quelques minutes dans le compartiment à glace avant de l’utiliser, et je l’y remets 5 mn après quelques coupes.
- de préférence il faudrait que la coupe se fasse en atmosphère froide (dans les cryostats de laboratoires cette température est maintenue à – 20°C), mais comme il n’est guère commode d’installer l’étau dans un congélateur, je fais l’impasse sur cette recommandation.
- dès que la surface du glaçon commence à fondre, il faut la replacer au froid quelques minutes. Cela se produit généralement après 6 à 10 coupes.
Les commentaires et nouvelles idées seront les bienvenus.
JPL80















Gui Viscum album
dans [VEGETAUX]
Posté(e)
Merci Dominique.
Un excellent "reportage" sur la vie d'un végétal que, le plus souvent, on ne regarde que de loin.
JPL80