-
Compteur de contenus
276 -
Inscription
Messages posté(e)s par +bertrand
-
-
Bonjour à tous,
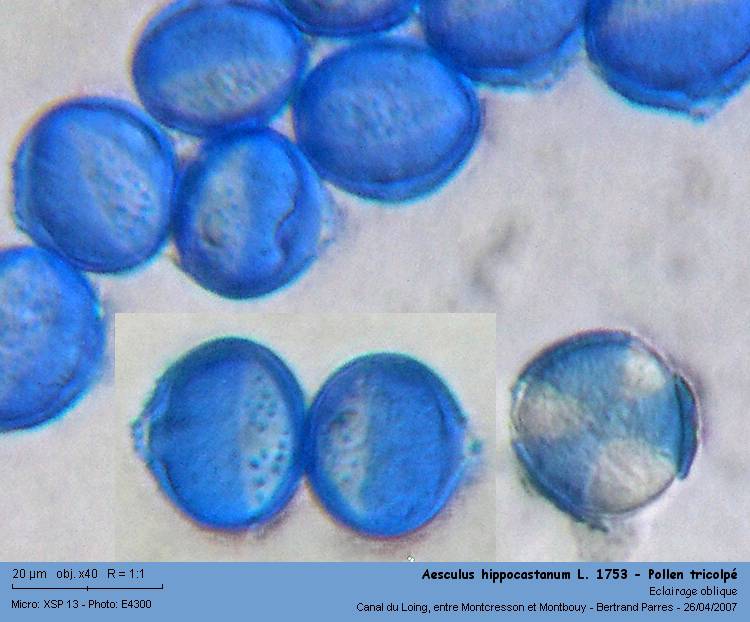
Le pollen de marronier d'Inde est décrit comme tricolpé.
01 - Fleurs de Marronnier d'inde.
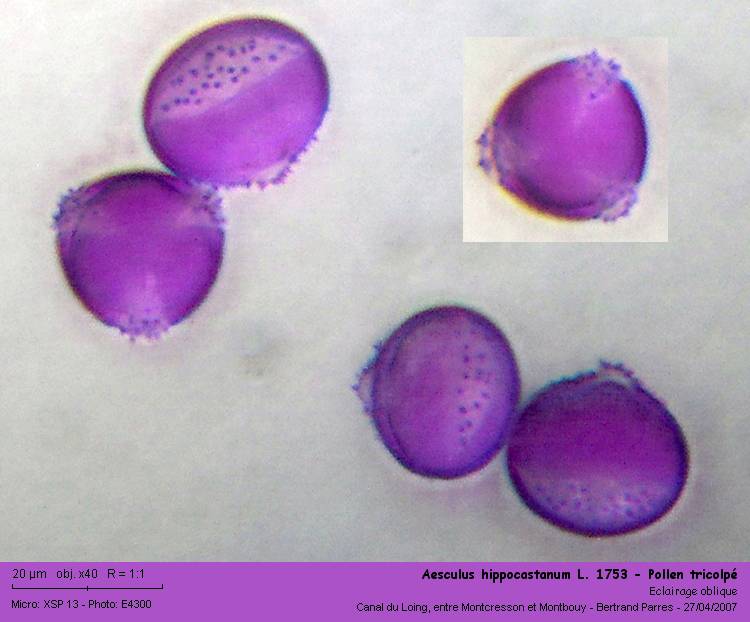
Coloré au Violet Cristal, le pollen présente une exine finement granuleuse. Bien qu'il soit décrit comme tricolpé, il semble tricolporé. La coloration montre ce qui semblent être de fines (de 0.8 à 1.2 µm) ponctuations dans les colpi.
02 - Les grains sont ovoïdes, de 26 à 28 µm de long et 22 à 24 µm de diamètre.
Coloré à la Fuschine de Ziehl (diluée au quart), ce qui semblait-être des ponctuations dans les colpi ressemble plus à des "micro-épines".
03 - Colpi "hérissés".
Comme Christian Colin l'avait déjà remarqué :
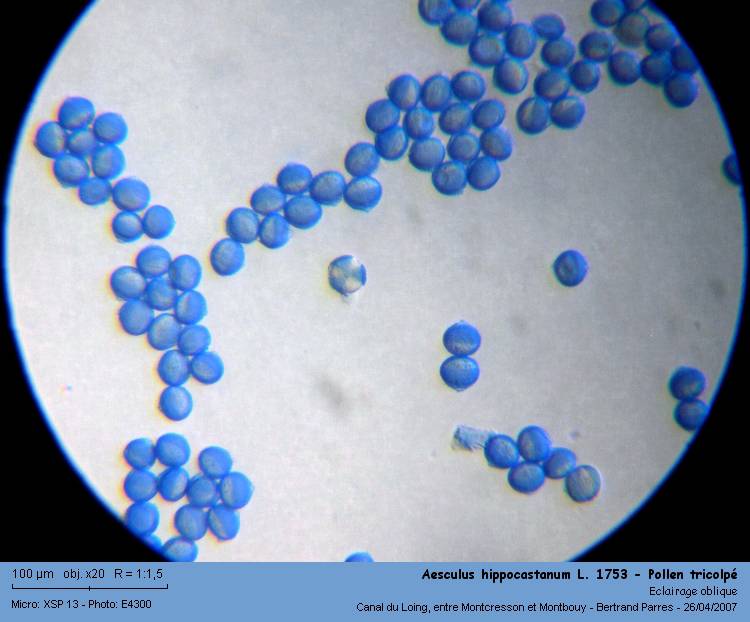
Sur trois lames, je n'en ai jamais trouvé un présentant le sommet!on observe extrèmement peu de grains de pollen vus de dessus. Sur la photo suivante, on en compte 1 sur 85 (1.2%).
04 - Très rares grains vus de dessus.
-
Bonjour à tous,
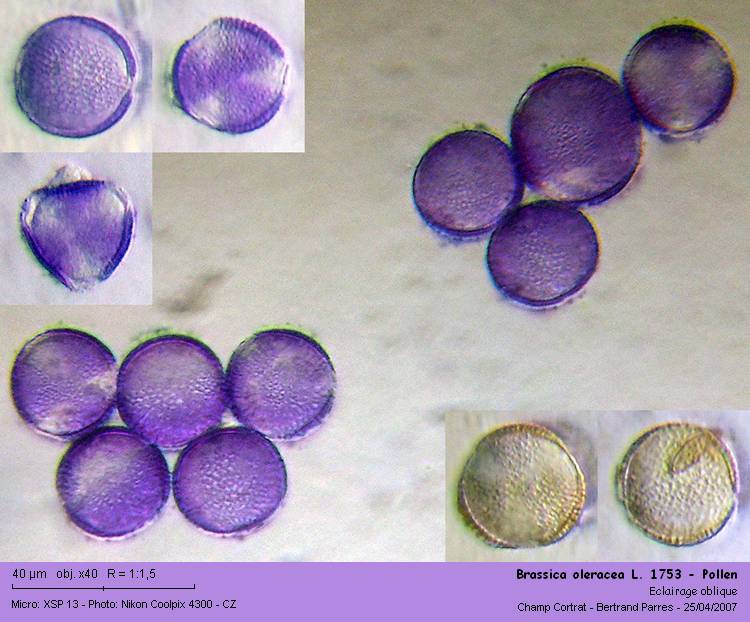
Tout comme le pollen de Colza (Brassica napus), le pollen de chou (Brassica oleacera L. 1753) est tricolpé, à exine finement réticulée.
Un agriculteur m'a expliqué qu'il laissait fleurir les choux pour produire des semences qu'il utiliserait plus tard pour produire des choux destinés à la consommation.
01 - Champ de chou "à semences".
Sur une lame sans coloration sans montage et sans lamelle, le pollen juste collé à la lame avec de l'albumine de Mayer, il apparaît oblong à l'état naturel, environ 1.6 fois plus long que large (Hauteur du grain = 35 µm, diamètre du grain = 22 µm).
02 - Pollen juste collé à la lame à l'albumine de Mayer.
Après coloration au Violet Cristal, ou même simplement après montage dans la Glycérine Gélatinée sans coloration, les grains de pollen prennent une forme sphérique d'un diamètre variant de 25 à 28 µm.
03 - Coloration au Violet Cristal.
-
Brassica napus L. 1753 var napus est une plante annuelle à fleurs jaunes cultivée pour l'alimentation animale et la production d'huile alimentaire, plus récement pour la production de biocarburants.
01 - Brassica napus L. 1753 var napus en plein champ et détails morphologiques.
Son pollen est tricolpé et finement réticulé. Il semble sphérique après coloration (Diam = 30 µm)
02 - Pollen coloré à la Fuschine de Ziehl.
En vue épiscopique, SANS préparation aucune, les grains de pollen sont nettement ovoïdes, 40 µm de long pour 25 µm de diamètre.
03 - Vue épiscopique.
Pour terminer, une planche :
04 - Brassica napus L. 1753 var napus
-
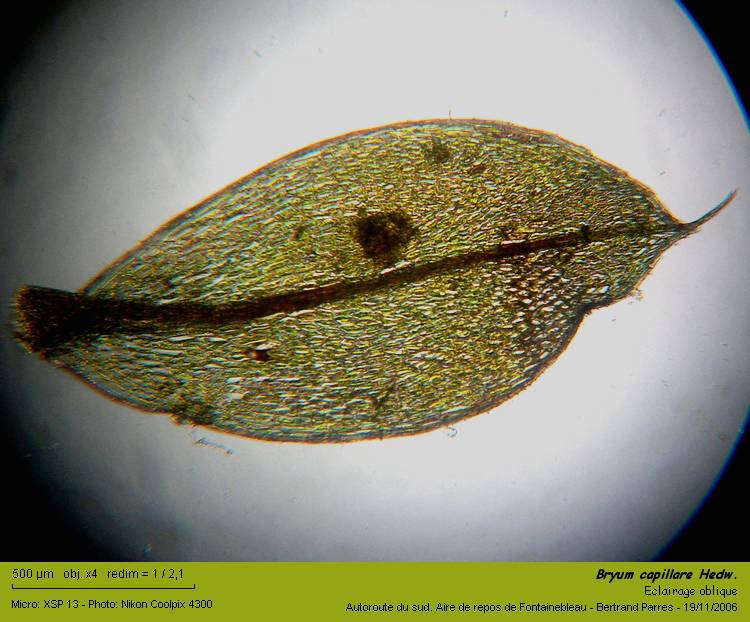
Bryum capillare Hedw. est une mousse acrocarpe dioïque1 se développant en coussinets.
01 - Bryum capillare Hedw. Macro.
Les capsules, portées par un pédicelle de 1 à 2,5 cm de long sont légèrement inclinées vers le bas.
Les feuilles, ovales, sont denticulées, nervurées, acuminées et possèdent une marge histologiquement différenciée. Les feuilles apicales présentent une décurrence plus marquée que les autres feuilles du rameau :
02 – Feuilles apicales. Elles présentent une décurrence plus marquée que les autres feuilles du rameau.
La nervure, assez élargie à la base de la feuille est légèrement excurrente à l'apex.
03 – Feuille entière, ovale, nervurée, denticulée.
04 – Région apicale de la feuille. La lumière polarisée met en évidence l'excurrence de la nervure et la différenciation histologique de la marge.
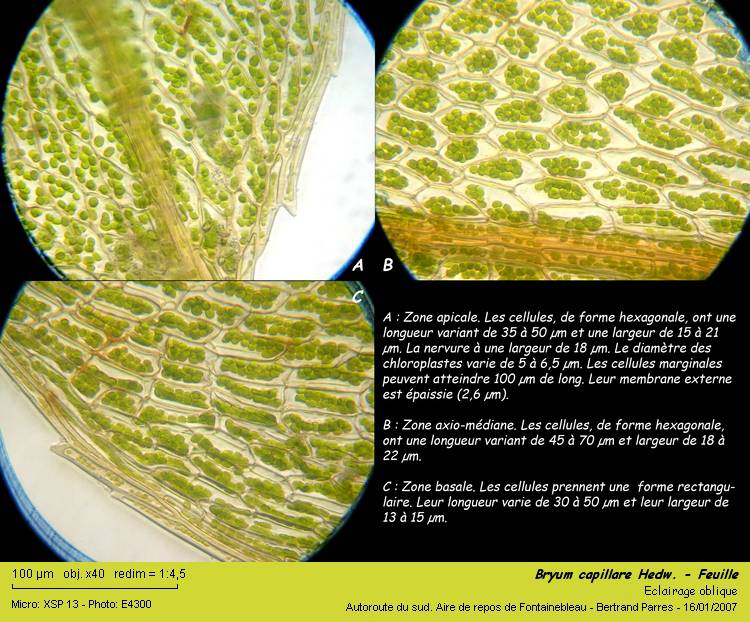
Les cellules du limbe sont hexagonales sur les deux tiers supérieurs du limbe. Elles deviennent rectangulaires dans le tiers proximal.
La marge est composée de deux couches de cellules très allongées (jusqu'à 100 µm de long).
Les cellules de la couche externe forment de légères dents. Leur membrane externe est épaissie.
05 – Détails des cellules.
La capsule est longue (5mm) et étroite (1mm dans sa plus grande largeur). On y observe deux rétrécissements, l'un sous-apical, l'autre à l'union du tiers proximal et du tiers moyen.
06 – Capsule, vue générale.
Dans la capsule arrivée à matûrité, l'exothécium2, brun-roux, est plissé. Les dents de l'exostome sont composées de 2 colonnes de cellules.
07 – Capsule : vue de l'exothécium et de l'exostome.
Le péristome est composé de 32 dents réparties en deux couches de 16, l'exostome3 et l'endostome4
08 - Capsule : Exothécium, exostome et endostome.
Les dents de l'endostome sont appendiculées / trabéculées5 à l'apex :
09 – Dents de l'endostome appendiculées / trabéculées.
On observe la présence de protubérances sur les cils (cils noueux) à l'apex des dents endostomiales.
10 – Cils noueux de l'endostome.
J'ai ouvert longitudinalement une capsule. Les dents de l'endostome sont composées de 3 colonnes de cellules.
11 – Les dents de l'endostome sont formées de 3 colonnes de cellules
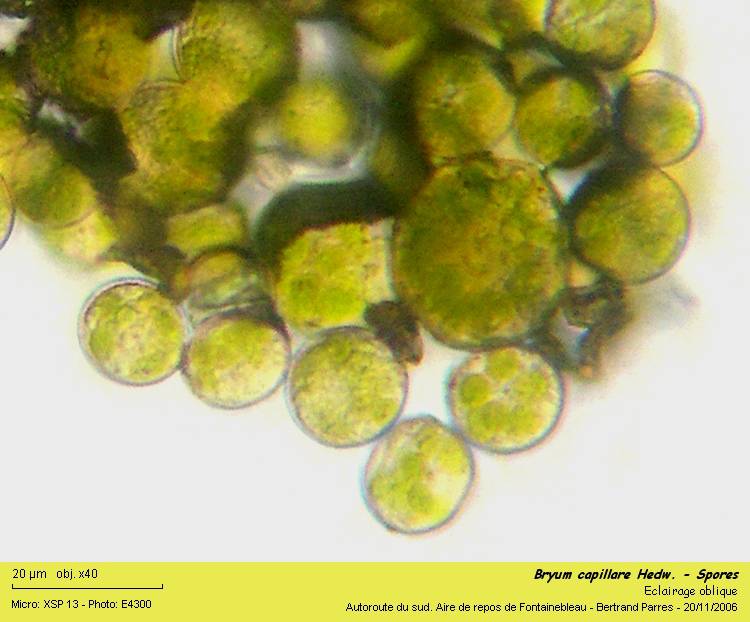
La capsule, arrivée à matûrité était remplie de spores.
On y trouve des spores de deux tailles différentes. De très nombreuses petites (14 à 16 µm de diamètre) mélées à quelques grandes (24 à 26 µm de diamètre) : Anisosporie6.
12 - Anisosporie.
Les définiitions des termes techniques viennent du GLOSSARIUM POLYGLOTTUM BRYOLOGIAE du Missouri Botanical Garden
- Dioïque : Dont les archégones et les anthéridies sont portés par des plantes séparées.
- Exothécium : Couche externe de la paroi de la capsule, épithélium de la capsule.
- Exostome : Cercle des dents externes du péristome.
- Endostome : Cercle des dents internes du péristome.
- Appendiculé - Trabéculé : Portant des projections transversales courtes.
- Anisosporie : Spores dimorphiques. En général, les spores les plus petites donnent naissance au gamétophyte mâle. On ne trouve pas chez les bryophytes d'hétérosporie vraie (micro et mégasporanges séparés).
- Dioïque : Dont les archégones et les anthéridies sont portés par des plantes séparées.
-
L. : Linné - Dum. : Dumortier
Un très grand merci à André pour son aide et ses explications.
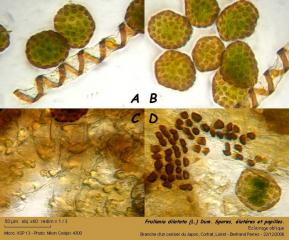
01 – Frullania dilatata (L.) Dum. Vue rapprochée, in situ.
J'ai trouvé cette hépatique sur une branche d'un cerisier du Japon, dans le Loiret (Cortrat, près de Montargis).
Dans toute cette présentation, j'appellerai face dorsale la face supérieure du rameau et face ventrale sa face inférieure.
La clef d'identification des familles d'hépatiques de la « Flore des hépatiques et anthocérothes de Belgique » (C. VANDEN BERGHEN, Ed. Jardin botanique national de Belgique - 1979) nous conduit à la famille des Jubulaceae :
Jubulaceae Klinggr.
Syn : Frullaniaceae Lorch in Lindau
« Plantes délicates à très robustes, à rameaux se développant en remplacement d'une partie ventrale de feuille, donc insérés à l'aisselle d'une feuille modifiée; rhizoïdes insérés à la base des amphigastres. Feuilles comdupliquées incubes, divisées jusqu'à proximité de leur ligne d'insertion sur la tige en deux parties très différentes l'une de l'autre : un lobule ventral généralement enflé et présentant la forme d'un capuchon, d'un casque ou d'une petite outre, relié à la tige par un pédoncule étroit souvent pourvu d'un appendice subulé ou foliacé formé d'un petit nombre de cellules (= le stylet); lobe dorsal beaucoup plus grand que le lobule, suborbiculaire ou ovale, (habituellement) entier. Cellules foliaires à parois souvent pourvues de trigones noduleux et d'éppaississements pariétaux localisés. Amphigastres toujours présents, bidentés et bilobés au sommet. Périanthe brusquement contracté au sommet en un bec étroitement cylindrique. Capsule subglobuleuse, brièvement pédicellée à maturité; paroi formée de 2 strates de cellules, se divisant en 4 valves droites restant soudées entre elles dans leur moitié inférieure. Spores divisées avant la déhiscence de la capsule, en un petit massif de quelques cellules irrégulièrement globuleux ou ellipsoïdal, à exine habituellement ornée de petites verrues courtes ordonnées en étoiles. Elatères à paroi renforcée par (1-2) bandes spiralées épaissies, élargies en trompette à leur extrémité distale, restant fixées par leur base à la partie apicale des valves de la capsule après la déhiscence de celle-ci. »
« Frullania dilatata : Lobules foliaires approximativement aussi longs que larges. Pas d'ocelles dans les lobes foliaires dorsaux. Périanthe à surface verruqueuse. »
« Lorsque le contenu de la capsule arrive à maturité, une hormone est diffusée. Elle provoque l'hydrolyse de l'amidon contenu dans les cellules du pédicelle et, en corollaire, une augmentation de la pression osmotique à l'intérieur de celles-ci. Il en résulte un étirement considérable des parois cellulaires. Sans que le nombre de cellules augmente, le pédicelle s'allonge fortement. En quelques heures, sa taille passe de 1 mm environ à 1-2,5 cm; il devient hyalin et fragile. L'élongation du pédicelle, qui hisse la capsule loin au dessus du périanthe, a pour effet de rompre la coiffe. »
Extraits de la « Flore des hépatiques et anthocérothes de Belgique » (C. VANDEN BERGHEN, Ed. Jardin botanique national de Belgique).
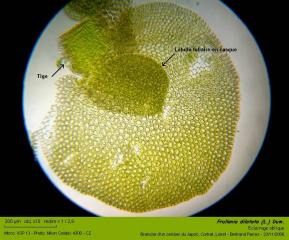
02 – Frullania dilatata (L.) Dum. Lobules foliaires dorsaux, suborbiculaires, approximativement aussi longs que larges. Diamètre variant de 800 µm à 1 mm.
03 – Frullania dilatata (L.) Dum. Face ventrale d'un rameau. La tige a un diamètre d'environ 65 µm.
- Amphigastre, bilobé, bidenté à l'apex. Hauteur 250 µm. Largeur : 190 µm
- Lobule foliaire ventral, en casque . Hauteur : 160 µm
- Ouverture basale du lobule foliaire ventral . Largeur : 180 µm
- Lobe foliaire dorsal. Diamètre environ 500 µm
- Stylet
04 – Frullania dilatata (L.) Dum. Feuille.
05 – Frullania dilatata (L.) Dum. Cellules foliaires.
- Feuille très jeune. Les chloroplastes emplissent totalement les cellules. Les trigones sont peu marqués. Les épaississements pariétaux sont inexistants.
- Feuille jeune. Les chloroplastes commencent à se disposer en un anneau périphérique. Les trigones sont plus marqués. Les épaississements pariétaux sont peu marqués.
- Feuille arrivée à maturité. Les chloroplastes forment un anneau périphérique. Les trigones sont nettement présents. Les épaississements pariétaux sont bien marqués. On note que les chloroplastes des cellules marginales ne forment pas un anneau complet mais un C ouvert sur la face externe des cellules. Taille des cellules : de 15 à 20 µm.
- Feuille arrivée à maturité, zone basale. Mêmes caractéristiques que C, mais plus accentuées. Les cellules sont plus grandes, de 20 à 25 µm, pouvant aller jusqu'à 30 µm.
Encadré : Oléocorps06 – Frullania dilatata (L.) Dum. Périanthe.
- Périanthe brusquement contracté au sommet en un bec étroitement cylindrique(1). Il possède une carène dorsale (2). Eclairage oblique, Obj. plan x 10
- Périanthe face ventrale. On perçoit au centre le renflement (3) que forme la capsule se développant dans son marsupium. Eclairage épiscopique, Obj. plan x 4.
- Périanthe, face ventrale. On perçoit la carène dorsale (4). Eclairage oblique, Obj. plan x 4.
- Périanthe face dorsale. Eclairage épiscopique, Obj. plan x 4.
07 – Frullania dilatata (L.) Dum. Bractéole.
08 – Frullania dilatata (L.) Dum. Capsule, vues épiscopiques.
- Capsule pas tout à fait à matûrité. Episcopie, Obj. plan x 10.
- Capsule pas tout à fait à matûrité dans sonmarsupium. J'ai « pelé » lesbractéesles plus externes pour que l'on puisse voir la capsule. Episcopie, Obj. plan x 4.
- Capsule parvenue à matûrité. Le pédicelle s'est considérablement étiré et porte la capsule bien au dessus du périanthe. Episcopie, Obj. plan x 4. La déchirure apicale du périanthe et son replis sur lui même ne sont que des artefacts dùs au montage pour l'observation.
- Deux capsules ouvertes et vidées de leur contenu, portion apicale d'un périanthe. Episcopie, Obj. plan x 4. Bien que les capsules soient venues ainsi accrochées au périanthe, un périanthe ne produit qu'une seule capsule. Je suppose que deux capsules très proches l'une de l'autre ont vu leurs pédicelles s'enrouler ensemble, se solidariser d'une manière ou d'une autre.
09 – Frullania dilatata (L.) Dum. Capsule ouverte et spores
J'ai tranché une capsule mûre pour voir l'intérieur :
- Section proximale de la capsule tranchée sur son pédicelle. Episcopie, Obj. x 10. On perçoit des élatères au milieu des spores.
- Section distale de la capsule tranchée. Episcopie, Obj. x 10. Au centre de la photo, on perçoit deux élatères.
- Valve d'une capsule naturellement ouverte. Episcopie, Obj. x 10. Elle porte encore des spores à sa base et ses élatères apicales.
- Spores et élatères, Episcopie, Obj. x20.
10 – Frullania dilatata (L.) Dum. Capsule mûre naturellement ouverte
11 – Frullania dilatata (L.) Dum. Elatères.
Elatères :
- Longueur = 350 µm
- Largeur = 14- 20 µm
- Extrémité distale "en trompette" = 25 µm
- Extrémité distale = 25 µm
12 – Frullania dilatata (L.) Dum. Spores, élatères et papilles.
- Spores et élatères, Obj. x 40. Les spores ont une taille de 40 à 55 µm. Les groupes de verrues en étoile de 4,5 à 7 µm. Les verrues de 0,5 à 2 µm. Largeur de l'élatère : 22,8 µm. Largeur de la bande spiralée : 6,8 µm.
- Spores et élatères, Obj. x 40.
- Paroi interne de la capsule. Les papilles ont une hauteur moyenne de 8,5 µm et une largeur moyenne de 7 µm.
- « Ces papilles vers les coins des valves, deviennent de plus en plus sombres pour ensuite donner ces formations brun noires » (André Advocat).
Amphigastre (un) : Feuille ventrale chez les hépatiques feuillées. Les amphigastres, insérés transversalement sur la tige, sont habituellement plus petits que les feuilles latérales.
Bractée (une) : Chez les hépatiques feuillées, feuille latérale plus ou moins modifiée insérée à proximité d'une anthéridie ou d'un archégone.
Bractéole (une) : Chez les hépatiques feuillées, feuille ventrale plus ou moins modifiée insérée à proximité d'une anthéridie ou d'un archégone.
Carène (une) : La crête d'un pli. L'angle formé par les deux surfaces d'un pli.
Condupliquée : Se dit d'une feuille dont la ligne d'insertion sur la tige a la forme d'un V plus ou moins fermé.
Distal(e) : Se dit de la partie d'un organe la plus éloignée de la base de cet organe. Opposé à « Proximal » et à « Basilaire » (ou Basal).
Elatère (une) : Cellule morte, généralement très allongée et à paroi renforcée par une ou plusieurs bandes épaissies spiralées, assurant la dissémination des spores par des mouvements saccadés provoqués par de faibles variations dans l'état hygrométrique de l'air. Les élatères se forment, avec les spores, dans la capsule.
Incube : Se dit d'une feuille dont l'extrémité distale de sa ligne d'insertion sur la tige est située sur la face dorsale de celle-ci.
Marsupium (un) : Chez certaines espèces d'hépatiques feuillées, poche charnue au fond de laquelle se développe un sporogone. Le marsupium, ou sac marsupial, est généralement pendant et enfoncé dans le substrat.
Ocelle (un) : Cellule spécialisée contenant une gouttelette d'une substance réfringente.
Oléocorps (un) : Corpuscule, généralement hyalin et réfringent, contenent des huiles éthérées. Les oléocorps, solitaires ou en nombre plus ou moins grand, sont présents dans les cellules de la plupart des hépatiques.
Pédicelle (un) : Partie du sporogone qui relie le pied à la capsule chez la plupart des hépatiques. Le pédicelle s'allonge souvent considérablement lorsque les spores arrivent à matûrité. Syn : Soie (une).
Périanthe (un) : Chez les hépatiques feuillées, enveloppe la plus interne, généralement en forme de tube, entourant un groupe d'archégones ou un sporogone.
Rhizoïde (un) : Cellule en forme de filament très allongé qui fixe l'hépatique à son support et qui assure son alimentation en eau et en substances minérales.
Sporogone (un) : Généralement formé de 3 parties : un pied, un pédicelle et une capsule.
Stylet (un) : Cellule ou groupe de cellules, habituellement surmonté d'une papille à micillage, situé à proximité de la ligne d'insertion du lobule foliaire sur la tige, chez certaines Lejeunéacées et chez les hépatiques di genre Frullania.
Subulé(e) : Qui se termine insensiblement en pointe aigüe.
Trigone (un) : Epaississement, triangulaire en vue optique, des parois cellulaires le long de leur ligne d'insertion.
Lexique extrait de la « Flore des hépatiques et anthocérothes de Belgique » (C. VANDEN BERGHEN, Ed. Jardin botanique national de Belgique - 1979).
-
Bonjour à tous,
Bonjour Pascale,
Quelques liens intérressants sur les foraminifères :
1.. Le livre entier est disponible au téléchargement, en haute résolution () et en VO (Allemand). Les planches sont en fin d'ouvrage, p. 355 à 375.2.de nombreuses photos (plus d'une centaine) de Foraminifères au MEB.3.4.5.Présentation d'un livre publié par le Muséum National d'Histoire Naturelle.Bien amicalement,
Bertrand
-
Bonjour à tous,
Thuidium tamariscinum (Hedw.) B.E. tire son nom de sa ressemblance avec les rameaux du Thuya.
C'est une mousse pleurocarpe, à tige allongée, rameuse, tripennée.
01 - Thuidium tamariscinum (Hedw.) B.E.
J'ai trouvé cet échantillon sur l'humus d'un petit bois de chènes, entre Montcresson et Amilly, dans le Loiret (E 2° 47' 01'' – N 47° 56' 44'', si quelqu'un est intéréssé, allez sur le site de l'IGN . Par « Recherche avancée », entrez les coordonnées et augmentez ensuite l'échelle au 1:1500 èmè : on peut compter les arbres!!!).
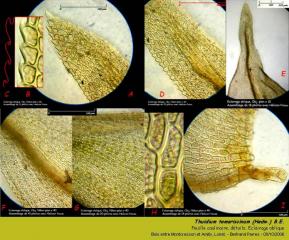
Les feuilles raméales ont une longueur qui varie selon le niveau de ramification du rameau qui les porte et leur position sur le rameau. De plus de 510 µm pour les feuilles de la base des rameaux N° 2 à moins de 170 µm pour celles portées par l'extrémmité apicale des rameaux N° 4. Elles sont de forme ovée lancéolées, à marge denticulée, très papilleuses, sans paraphylles. Elles possèdent une nervure centrale évanescente à mi-hauteur.
02- Thuidium tamariscinum (Hedw.) B.E. Correspond à un rameau N° 3 sur la photo 01. Ces feuilles raméales ont une longueur de l'ordre de 300 µm.
Les feuilles caulinaires sont nettement plus grandes, 1,6 mm de long pour 1 mm de large. Triangulaires subulées, papilleuses, elles possèdent une nervure centrale hémicylindrique évanescente à l'apex encadrée par deux plis longitudinaux de chaque côté, une marge dentée, elles portent des paraphylles à la base.
03 - Thuidium tamariscinum (Hedw.) B.E. Feuille caulinaire.
04 - Thuidium tamariscinum (Hedw.) B.E. Feuille caulinaire, détails.
A : Cellules apicales grossièrement rhomboïdales, de 10 à 15 µm de long.
B : Dents de la région apicale de la feuille (encadré A) . Elles ont une forme en S.
C : Surlignage mettant en évidence la forme en S des dents de la zone apicale.
D : Zone sous apicale, d'évanescence de la nervure centrale.
E : Tiers supérieur de la feuille. La nervure centrale est hémicylindrique.
F : Union du tiers distal et du tiers moyen de la feuille. Les cellules passent de grossièrement rhomboïdales à grossièrement carrées.
G : Tiers moyen de la feuille. Les dents marginales s'atténuent et perdent leur forme en S. Les cellules s'allongent un peu (12 à 22 µm) et n'ont plus de forme vraiment définissable.
I : Région alaire. Les cellules sont nettement plus allongées, (très) grossièrement rectangulaires. Longueur variant de 25 à 30 µm valeurs extrèmes de 15 et 38 µm).
H : Cellules alaires, détail (encadré I). Membranes épaissies, de 1,6 à 2,2 µm. Chloroplastes circulaires de 4,5 à 5 µm.
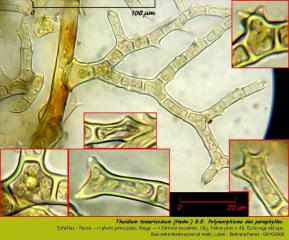
Les paraphylles sont portées exclusivement par les tiges et les feuilles caulinaires. Elles sont extrèmement abondantes, polymorphes et ramifiées.
05 - Thuidium tamariscinum (Hedw.) B.E. Paraphylles. A gauche, paraphylles isolées par gratage de la tige principale.
La tige principale est litéralement gainée par les paraphylles.
06 - Thuidium tamariscinum (Hedw.) B.E. Paraphylles sur tige principale (après élagage de quelques feuilles caulinaires pour mieux voir les paraphylles).
07 - Thuidium tamariscinum (Hedw.) B.E. Feuilles caulinaires - A : On perçoit les papilles au centre des cellules. B : Mélange papilles – paraphylles. C : Paraphylles.
08 - Thuidium tamariscinum (Hedw.) B.E. Diversité morphologique des paraphylles.
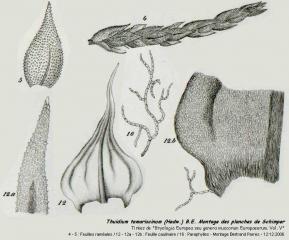
09 - Extraits des deux planches de Schimper illustrant Thuidium tamariscinum (hedw.) B.E.
Vous pouvez voir ces deux planches dans leur intégralité à ces adresses :
Ainsi que le texte : http://imgbase-scd-ulp.u-strasbg.fr/displa...133&pos=205
Notes :
1.Voir aussi:2.Thuidium tamariscinum (Hedw.)B.E.: Bryologia Europea (Bruch, Schimper et Gümbel) [Douin, p. 49]3.Subulées: En pointe longue et fine [Pierrot, p. 114]Merci à André pour son aide et ses conseils.
-
09 - Reproduction des planches originales de Flotow
Haematococcus pluvialis peut-être cultivée sur ce milieu de culture :
http://www.bio.utexas.edu/research/utex/me...mes-volvox.html
http://www.bio.utexas.edu/research/utex/genus/h.html
MES-volvox mediumGeneral purpose medium for freshwater strains, especially those requiring ammonium. Suitable for xenic and axenic cultures. Modified volvox medium.
Preparation: to 988 mL of glass-distilled water, add 1.95 g MES buffer (Sigma Co.) and the following in the amounts indicated:
mL..................stock solution...........................g/100 mL H2O
1....................Ca(NO3)2. 4H2O..............................11.8
1....................Na2glycerophosphate. 5H2O...............6.0
1....................MgSO4. 7H2O....................................4.0
1....................KCl...................................................5.0
1....................NH4Cl...............................................2.67
1....................biotin..............................................25.0 x 10-6
1....................vitamin B12.....................................15.0 x 10-6
6....................PIV metal solution
Adjust to pH 6.7 using 1 N NaOH and autoclave.
PIV metal solution :
To 1000 mL of glass-distilled water, add 0.750 g of Na2EDTA, and dissolve fully. Add the following salts in the amounts indicated:
FeCl3. 6H2O.................97 mg
MnCl2. 4H2O................41 mg
ZnCl2............................5 mg
CoCl2. 6H2O..................2 mg
Na2MoO4. 2H2O.............4 mg
Optional ingredients: agar at 15 g/L to solidify.
Haematococcus pluvialis est utilisée pour sa production d'astaxanthine naturelle dans diverses branches industrielles :
1.Cosmétique, dans certains autobronzants
2.Diététique, dans les compléments alimentaires pour les propriétés antioxydantes de l'astaxanthine (on parle d'une activité antioxydante 500 fois supérieure à celle de la vitamine E)
3.Alimentaire, l'astaxanthine est utilisée comme colorant alimentaire
4.Pisciculture, l'astaxanthine est utilisé en complément alimentaire pour donner aux poissons (saumons notament) leur couleur rose.
L'astaxanthine est par ailleurs le pigment qui donne aux crustacés leur couleur rose (in vivo). C'est aussi elle qui est responsable de la couleur rouge des crustacés cuits (après dissolution des autres pigments à la cuisson, ne reste plus que l'astaxhantine).
De nombreuses recherches ont été faites (et brevets pris!) sur la production industrielle d'Haematococcus pluvialis pour sa production d'astaxanthine. Un kilo de pigment naturel vaut +/- 150 $ contre +/- 3000 $ pour un kilo d'astaxanthine de synthèse!!!
Quelques liens concernant Haematococcus pluvialis et/ou l'Astaxanthine (Il va sans dire que je n'ai aucun lien avec les sites comerciaux cités) :
ANTIOXYDANTS :
http://www.franceisrael.info/breves.php?p=10 (15 juillet 2005 / 19h22 - un nouveau produit anti-radicaux libres)
http://www.fiteurope.com/fr/fitness-et-san...oxydant-aoc.php
http://www.aromatic-provence.com/vente-pro...rcus-rohrer.php
AUTOBRONZANTS :
http://www.pharmaservices.fr/cgi-local/aff...au_bronzage.htm
ALIMENTAIRE :
http://www.food-info.net/fr/qa/qa-wi9.htm
PISCICULTURE :
http://www.cbb-developpement.com/00/.%5C22%5C2213.htm
http://www.aquamedia.org/aquainnovation/kn...456&Aflg=fr
http://techniques-aquatiques.com/articles/...iment-crevettes
CULTURE INDUSTRIELLE d'Haematococcus pluvialis :
http://www.cbb-developpement.com/00/10/1040.htm
http://www.parrynutraceuticals.com/Natural...astaxanthin.asp
http://www.cri-sud-ouest.net/opportann.asp?Id_ann=7948
Les deux liens suivants m'ont permis de discerner le cycle de vie de cette algue :
1 :http://www.astafactor.com/techreports/tr3004-001.htm] http://www.astafactor.com/techreports/tr3004-001.htm[/url]
http://www.motivando.com/index.php?mod=dep...ard&sid=262 (« Reseña histórica del Astaxanthin. »)
Je recherche :
Elliot A M. Morphology and life history of Haematococcus pluvialis. Arch Protistenk, 1934, 82:250—272
J'ai eu beau le chercher sur Google, bien qu'il soit cité dans la bibliographie de dizaines et de dizaines de documents sur la production d'astaxanthine par Haematococcus pluvialis, pas moyen de le trouver.
Je n'ai pas non plus put obtenir les légendes des planches de Flotow.
-
Bonjour à tous,
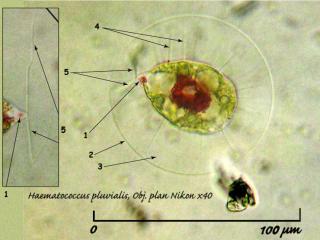
Haematococcus pluvialis Flotow est une algue verte (Chlorophycée), contrairement à ce que son aspect macroscopique pourrait laisser croire; biflagellée unicellulaire. Pendant ses périodes végétatives, elle produit un pigment rouge caroténoïde, l'Astaxanthine. On la trouve assez fréquement dans des dépots d'eau stagnante. Je l'ai rencontré fréquement dans mon jardin dans des récipients de plastique contenant de l'eau pluviale stagnante ou elle forme un dépôt rouge dans le fond (01 – H). L'intense couleur rouge de ce dépôt est dù à la production d'astaxanthine. J'ai parfois trouvé des thalles de Nostoc commune (01 – N) dans les récipients contenant H. pluvialis et toujours une unique espèce de rotifère, Philodina roseola.
01 – Haematococcus pluvialis Flotow, in situ.
J'ai souvent été intrigué par la diversité des formes que j'observais chez cette algue; parfois jusqu'à douter de l'identification que j'en faisais. Cependant, des recherches sur le web montraient la même variété morphologique; sans pour autant l'expliquer. J'ai fini par tomber sur un ou deux sites qui présentaient différents éléments de compréhension de ces aspects si divers. A ma grande surprise, j'ai découvert que cette petite algue avait bien des implications industrielles et avait fait l'objet de nombreuses études scientifiques et brevets.
CLASSIFICATION
ORDRE DES VOLVOCALES
Les cellules végétatives sont normalement flagellées (le plus souvent avec deux fouets égaux structuralement et fonctionnellement). Les Volvocales sont unicellulaires libres ou réunies en colonies. (...) Le ou les chloroplastes sont verts; les réserves sont constituées par de l'amidon (...).
P. BOURRELLY « LES ALGUES D'EAU DOUCE » T. 1 (algues vertes), p. 35
FAMILLE DES CHLAMYDOMONADACEES
Cellules toujours libres, solitaires, mobiles, portant de 1 à 4 fouets et pourvues d'une mince membrane cellulosique indéformable. (...)
Dans beaucoup de cas, stigma et vacuoles contractiles. Flagelles de même longueur (...)
P. BOURRELLY « LES ALGUES D'EAU DOUCE » T. 1 (algues vertes), p. 49
GENRE Haematococcus
Cellule solitaire, ovoïde ou ellipsoïdale portant 2 fouets égaux et entourée d'une membrane très ample, séparée du cytoplasme par une gelée. De fins prolongements plasmatiques radiaux joignent la cellule à la membrane.
P. BOURRELLY « LES ALGUES D'EAU DOUCE » T. 1 (algues vertes), p. 56-57
Haematococcus pluvialis a été décrit dès 1844, bien que des espèces qui peuvent être considérées comme synonymes aient été reconnues bien plus tôt. (cf Table 1). Il est largement répandu en Europe, en Afrique et en Amérique du nord.
Table 1 : Haematococcus pluvialis Flotow, 1844, synonymies :
1802 Volvox lacustris Girod-Chantrans1824 Lepraria kermesina Wrangel1824 Sphaerella Wranglelii Sommerfelt1824 Protococcus nivalis Agardh em. Greville1825 Chlorococcum kermesinum (Wrangel) Fries1826 Byssus kermesina (Wrangel) Wahlenberg1828 Haematococcus noltii Agardh1828 Haematococcus Grevillei Agardh1833 Protococcus monospermus Gorda1833 Microcystis grevillei (Agardh) Kutzing1836 Globulina kermesina (Wrangel) Turpin1841 Discerea purpurea A. et C. Morren1843 Protococcus cordae Meneghini1844 Haematococcus pluvialis Flotow1848 Protosphaera pluvialis (Flotow) Trevisan1848 Protosphaera cordae (Meneghini) Trevisan1849 Protococcus pluvialis (Flotow) Kutzing1852 Chlamydococcus pluvialis (Flotow) Braun1852 Hysginum pluviale (Flotow) Perty1875 Haematococcus lacustris (Girod-Chantrans) Rostafinski1896 Sphaerella pluvialis (Flotow) Wittrock1896 Sphaerella lacustris (Girod-Chantrans) WittrockLe cycle de vie d'Haematococcus pluvialis :
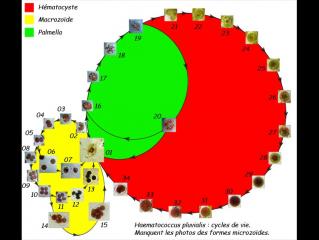
Haematococcus pluvialis change de morphologie pendant son cycle de vie.
MACROZOÏDE :
Le Macrozoïde, grand (50 - 70 µm de diamètre), vert et biflagellé est la forme la plus commune. Les réserves sont sous forme d'amidon. Les Macrozoïdes se multiplient par simple division cellulaire.
02 - Forme Macrozoïde d'Haematococcus pluvialis Flotow, Obj. plan Nikon x 40, éclairage oblique. Dans l'encadré, détail des flagelles, issu d'un autre macrozoïde.
1 : Stigma
2 : Membrane cellulosique
3 : Gangue glycoprotéique
4 : Prolongements plasmatiques
5 : Flagelles
Diam = 78 µm L = 50 µm l = 34 µm
Ep. Gangue = 22 µm Stigma = 2,5 µm
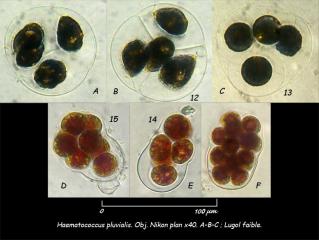
03 - Planche 01 : forme Macrozoïde d'Haematococcus pluvialis, Obj. plan Nikon x 40, éclairage oblique.
A, B, C : colonies de 4 cellules, lugol faible. On note sur la photo C que les macrozoïdes sont entourés d'une gangue commune.
D, E : Colonies de 8 cellules començant à se libérer de la gangue commune.
F : colonie supérieure à 8 cellules. J'en compte au moins 10, la logique voudrait qu'elles soient 16.
Multiplication des macrozoïdes :La multiplication commence par une invagination au niveau du stigma (H – 02). Le corps cellulaire se scinde en deux (C – 03 dans l'encadré, les flèches soulignent les deux flagelles qui signent la forme macrozoïde).
Sur la photo E – 04, le corps cellulaire est presque totalement divisé en deux. La division est achevée sur la photo G – 05.
Sur la photo F – 06, les deux corps cellulaires sont complètement séparés. Ils s'éloignent l'un de l'autre. La gangue glycoprotéique s'étire, subit une double invagination en son milieu préludant à la séparation en deux macrozoïdes indépendants.
Au lieu de se séparer pour former deux macrozoïdes indépendants, les deux corps cellulaires néoformés peuvent de nouveau se diviser en deux (H – 09) pour former 4 corps cellulaires (I – 10) au sein de la gangue glycoprotéique « mère ». Si le processus de multiplication s'arrète au stade 4, chaque corps cellulaire va ensuite s'entourer d'une gangue glycoprotéique propre, l'ensemble restant solidaire au sein de la gangue mère (photos A, B, C planche 01). Le processus de multiplication peut aussi se poursuivre pour former 8 corps cellulaires (photos D et E planche 01) ou plus (photo F planche 01). Dans tous les cas, les corps cellulaires vont ensuite s'entourer d'une gangue glycoprotéique individuelle puis se libérer de la gangue mère (photo D, E, F planche 01).
04 – Planche 02 : multiplication des formes macrozoïde (A, C, E, F, G, H, I) et palmella (B et D). Obj. x 40. Photos faites le 12/05/2003 avec une TouCam 740.
PALMELLA :
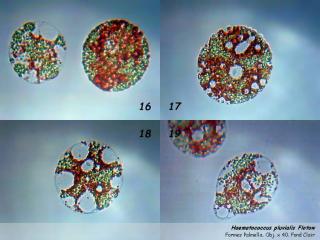
Quand les conditions environnementales se dégradent (désèchement lent, conditions extrèmes de pH et forte illumination), les macrozoïdes perdent leurs deux flagelles, présentent de nombreuses vacuoles (planche 02, photo B – 19; planche 04) , pour devenir des formes palmella qui flottent et restent verts (planche 03, photo A – 21; planche 05). Les palmella peuvent se diviser pour former d'autres palmella (planche 02, photo D – 20) ou redonner des macrozoïdes flagellés.
05 – Planche 04 : Formes Palmella, Obj. x 40. Photos faites le 12/05/2003 avec une TouCam 740.
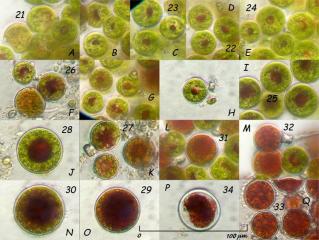
HEMATOCYSTES :
Si les nutriments se raréfient, les palmella cessent de se diviser et se transforment en des formes rouges, les hématocystes, qui occasionellement peuvent être issus directement des macrozoïdes. Les hématocystes ont une paroi cellulaire épaisse (planche 03, photo P – 34) et produisent de grandes quantités d'astaxanthine quand ils sont fortement éclairés par le soleil.
06 – Planche 03 : transition du stade palmella (A – 21) au stade Hématocyste. Obj. plan Nikon x 40, éclairage oblique. 26/08/2006
Si les conditions s'améliorent, les hématocystes peuvent se diviser en petites (+/- 20 µm) cellules cylindrique flagellées, les microzoïdes, qui pourront éventuellement perdre leurs flagelles, grandir et donner des formes palmella. Cependant, le plus souvent, les hématocystes se divisent pour reformer des macrozoïdes et le cycle se répète.
Le montage suivant tente de présenter le (les) cycle(s) de vie d'Haematococcus pluvialis Flotow. Je n'ai pas observé (ou pas su identifier) de forme microzoïde.
07 – Cycles de vie d'Haematococcus pluvialis Flotow.
Pour en terminer avec les illustrations, voici deux planches de Flotow que j'ai trouvées sur un site Danois aux adresses suivantes :
http://nrm.museum/kbo/krypt/haematococcus/...coccus5.html.se
http://nrm.museum/kbo/krypt/haematococcus/...coccus6.html.se
08 - Reproduction des planches originales de Flotow
-
Bonjour à tous,
La remarque d'André m'a rappellé que j'avais entrepris une paire de dissections de fleurs début avril de cette année. Je ne vous avais pas présenté les photos parceque je n'étais pas satisfait de certaines d'entre-elles.
Au départ, je voulais juste en observer le pollen. Compte tenu de la morphologie de cette fleur et de son immatûrité, j'avais été obligé de la disséquer pour atteindre les étamines et pouvoir récupérer du pollen. J'avais alors été surpris par la morphologie des étamines, en « zig-zag » et le tapis de poils les entourant.
01 – Vinca minor in situ.
02 – Vinca minor, dissection de l'appareil reproducteur.
03 – Vinca minor, étamines vues de dessus, éclairage épiscopique, Obj. plan x20.
04 – Vinca minor, détail des étamines vues de dessus, éclairage épiscopique, Obj. plan x20.
05 – Vinca minor, "tapis" de poils entourant les étamines vus de dessus, éclairage épiscopique, Obj. plan x20.
06 – Vinca minor, détail du "tapis" de poils entourant les étamines vus de dessus, éclairage épiscopique, Obj. plan x20.
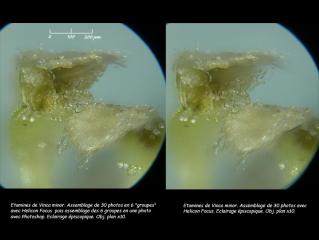
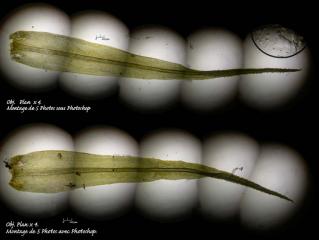
Je n'ai pas réussi à faire de bonnes photos des étamines. Lors de grandes séries de photos à assembler avec Hélicon, il m'est arrivé de devoir fractionner la série pour qu'Hélicon me donne plusieurs photos « partielles » convenables alors qu'il ne parvenait pas à assembler l'ensemble de façon satisfaisante. C'est alors sous Photoshop que j'assemble manuellement les photos « partielles ». Ici, dans un cas comme dans l'autre, le résultat n'est pas terrible :
07 – Vinca minor, détail des étamines,éclairage épiscopique, Obj. plan x10.
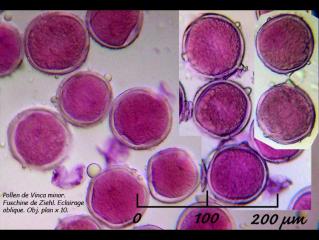
La surface du pollen est finement granuleuse. Je n'ai pas vu les 3 apertures qu'André nous a montré . Peut-être est-ce dù à l'immaturité de la fleur que j'ai observé.
08 – Vinca minor, pollen, fuschine de Ziehl, éclairage oblique, Obj. plan x10.
Pour finir, une planche que j'ai trouvé à l'adresse : http://caliban.mpiz-koeln.mpg.de/~stueber/.../tafel_081.html que nous avait transmise Olivier de la part de Christian dans ce message.
-
Bonjour à tous,
Bonjour Alain,
Quelques reflexions « en vrac » à propos des colorations :
Tout d'abord, cela a déjà été beaucoup dit sur cette page mais tant pis; AVANT de vouloir colorer quoi que ce soit, tu dois SAVOIR CE QUE TU VEUX OBSERVER.
Bien qu'il existe une incroyable variété de colorants et de colorations, ce sont, la plupart du temps, les mêmes que tu vas utiliser.
COUPES ou pas COUPES :
On peut distinguer 2 grands cas de colorations :
1.Sur des COUPES : Histologie végétale ou animale.
2.Sur des organismes entiers : tout ce qui est observable « directement » sous le microscope (PAS COUPE).
ORGANISMES ENTIERS : PAS COUPES :
NOYAUX : c'est le plus simple. Un peu de bleu de méthylène (on le trouve encore relativement facilement en solution aqueuse prête à l'emploi en pharmacie) et c'est gagné. C'est une coloration létale (certains auteurs présentent le bleu de méthylène très dilué comme un colorant vital mais les paramécies que j'ai pu colorer n'en n'ont jamais réchappé!). Tu peux donc avoir des problèmes de destruction du sujet avant la coloration. Ca reste, a mon avis, une des colorations les plus simples.
Bien d'autres colorants coloreront les noyaux. Personellement, je préfère le bleu obtenu avec le Violet de Gentiane ou Violet Cristal mais là, ça devient une question de goùts ... et comme chacun sait, les goùts et les couleurs...!!! (Je l'utilise aussi parfois sur des pollens http://forum.MikrOscOpia.com/index.php?s=&...ost&p=12794 ).
Le Vert de Méthyle Acétique donne des colorations spectaculaires de chromosomes géants (larve de chironome ou larve de drosophile) :
http://forum.MikrOscOpia.com/index.php?sho...p;hl=CHROMOSOME
VACUOLES DIGESTIVES : Avec du Rouge Neutre TRES DILUE (1/10 000 à 1/100 000). Les particules de rouge neutre sont absorbées et te permettent de suivre le trajet des vacuoles digestives. Mieux, le rouge neutre étant indicateur de pH, tu peux, si tu as de la chance (moi, je n'y suis pas parvenu mais j'ai dù mal m'y prendre) suivre non seulement le trajet mais aussi l'état d'avancement de la digestion.
ROUGE NEUTRE :
pH < 6,5 -----> rouge
pH > 8 -----> jaune
A pH < 5, le rouge neutre se fixe sur la membrane des vacuoles.
A pH = 7,5 le rouge neutre entre dans les vacuoles
http://wwwpsvt.free.fr/svt/bio/colorants/c...s.htm#colorants
lien donné par Christian dans un sujet qui recoupe tes préoccupations « S'équiper en colorants » http://forum.MikrOscOpia.com/index.php?s=&...ost&p=15929 posté par Loïc Boudinet.
Le Rouge Neutre permet aussi de mettre en évidence les vacuoles pulsatiles des paramécies comme l'a montré André dans ce sujet : http://forum.MikrOscOpia.com/index.php?s=&...ost&p=17474
Olivier Barth l'a utilisé avec succès sur des amibes dans ce sujet :
http://forum.MikrOscOpia.com/index.php?showtopic=4561
et sur un Héliozoaire : http://forum.MikrOscOpia.com/index.php?showtopic=4513
CILIATURE : Avec de la Nigrosine en suspension aqueuse. Il ne s'agit PAS d'une COLORATION mais d'un DETOURAGE. Les particules de Nigrosine en suspension dans l'eau permettent de mettre en évidence la ciliature et ses mouvements : « coloration » vitale.
La Nigrosine permet aussi de mettre en évidence la gangue muqueuse de certaines algues filamenteuses comme Zygnema :
01 – Zygnema, détourage de la gangue muqueuse à la Nigrosine diluée. Obj. x 40.
ou de certaines Volvocales : VOLVOCACEES http://forum.MikrOscOpia.com/index.php?showtopic=2657 / PANDORINA http://forum.MikrOscOpia.com/index.php?showtopic=2537]http://forum.MikrOscOpia.com/index.php?showtopic=2537[/url] / GONIUM http://forum.MikrOscOpia.com/index.php?showtopic=2539
ou de Cyanophycées : http://forum.MikrOscOpia.com/index.php?s=&showtopic=4782&view=findpost&p=21365 ://http://forum.MikrOscOpia.com/index....st&p=21365 ://http://forum.MikrOscOpia.com/index....st&p=21365 ://http://forum.MikrOscOpia.com/index....st&p=21365 (photos 02 et 03).
J'utilise aussi volontiers le Lugol faible. Le Lugol donne une coloration spécifique de l'amidon (bleu noir) et du glycogène (brun acajou) mais permet aussi de fixer protozoaires et métazoaires microscopiques, leur donnant une coloration (NON SPECIFIQUE) dans des tons de brun qui augmentent le contraste. Tu peux en voir quelques essais sur des ciliés et des rotifères ici : http://forum.MikrOscOpia.com/index.php?sho...hl=LUGOL+FAIBLE
et sur des amibes ici :
http://forum.MikrOscOpia.com/index.php?sho...hl=LUGOL+FAIBLE
Le Lugol faible m'a aussi permis de montrer certains détails (échinules) par défaut sur le pollen de Picris hieracioides http://forum.MikrOscOpia.com/index.php?s=&...ost&p=13087
Le Maître des pollens (je veux bien entendu parler d'André, le Yoda des Chloroplastes) utilise le Vert d'Iode http://forum.MikrOscOpia.com/index.php?showtopic=4385 ou la Fuschine de Ziehl http://forum.MikrOscOpia.com/index.php?showtopic=4449 pour les colorer.
COUPES :
Avant de les colorer, il faut parvenir à les réaliser!!! C'est pas simple. Les rares essais que j'ai tenté n'ont pas été très concluants, malgrès les excellents conseils de Christian. Ses photos magnifiques donnent envie... mais il y a loin de la coupe aux lèvres!!!
HISTOLOGIE VEGETALE :
La coloration la plus courante : Carmin aluné – Vert d'Iode (Carmino-Vert de Mirande, même résultat).
Ne surtout pas rater la coloration double Safranine et Vert Intense de Christian sur des coupes de turion d'Asparagus :
http://forum.MikrOscOpia.com/index.php?showtopic=1780
André nous a présenté début septembre une très belle coloration double Safranine et Bleu Astra http://forum.MikrOscOpia.com/index.php?s=&showtopic=4422&view=findpost&p=20924 ://http://forum.MikrOscOpia.com/index....st&p=20924 ://http://forum.MikrOscOpia.com/index....st&p=20924 ://http://forum.MikrOscOpia.com/index....st&p=20924
HISTOLOGIE ANIMALE :
Là, c'est une autre paire de manches. Avant même d'être confronté au problème des coupes, tu devras résoudre celui de la fixation et de l'inclusion. Je ne m'en suis jamais « vanté » sur le forum mais les rares essais que j'ai pu faire ont d'abord buté sur un problème de stabilisation de la température des bains de paraffine. Les premiers échantillons ont été « frits » dans la paraffine!!! Une fois réglé ce problème, je me suis trouvé face à un échantillon inclus dans un bloc de paraffine qui « collait » mal au porte bloc et qui finalement s'est fracturé. Je dois préciser que j'avais utilisé de la paraffine « pour confitures ». Peut-être (!!!) que j'aurais dù me procurer une paraffine spécialement dédiée à l'histologie.
Sans parler des coupes à congélation que tu évoques.
Mais même au cas ou je serais parvenu à obtenir des coupes convenables, les colorations en histologie animales sont encore plus complexes qu'en histologie végétale et les réactifs et colorants quasiment impossibles à obtenir pour un particulier.
Deux de mes favorites le PAS (Acide Periodique-Schiff) et le Trichrome Azan, par exemple sont hors de portée de l'amateur. Pas simple de trouver de l'Acide PerIodique (PAS) ou de l'Acide Phosphotungstique (Trichrome Azan), et en quantité raisonable (inférieure au litre)! Mon pharmacien me prend déjà pour un excentrique depuis que je lui ai demandé s'il pouvait me fournir un peu de formol!!! J'ai du mettre sous le coude la passion que je me suis découverte en fac pour l'histo-embryologie (animale)!
Mais la microscopie nous offre tant d'autres sujets d'observations qui deviennent vite passionants pourvu qu'on s'y attarde un peu.
Et comme l'a dit Jean Marie à propos des colorants : « je ne les utilise que dans moins de 10 % de mes observations »
Bref, si je devais établir une liste des colorants que j'utilise, quand j'en utilise :
Nigrosine
Lugol Faible
Fuschine de Ziehl
très exceptionellement :
Vert d'iode
Vert de méthyle Acétique
Violet de Gentiane / Violet cristal
Bleu de méthylène
Ajoute à cela :
de l'alcool Acétique que j'utilise pour la fixation des mousses (l'idéal serait de l'AFA mais ma pharmacienne n'a pas pu –voulu!- me fournir du formol)
Du liquide glycériné, pour le montage temporaire des feuilles de mousse (ne s'évapore quasiment pas contrairement à la traditionelle goutte d'eau)
de la Glycérine Gélatinée ( ou Gélatine Glycérinée, selon que tu considère que ce qui doit définir le nom est le composant majoritaire ou l'état final du produit, à mon avis, les deux nomenclatures peuvent se justifier!).
Pour finir (enfin!) je te suggèrerai simplement de te ballader sur les différents forums. Tu verras que l'identification de ce que l'on voit dépend bien plus souvent de la méticulosité de l'observation des plus petits détails du sujet que d'une quelconque coloration.
Pardon d'avoir été un peu long.
-
Bonjour à tous,
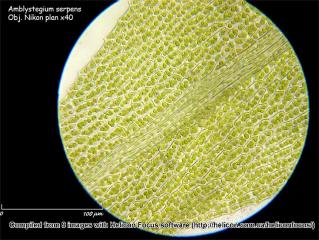
Amblystegium serpens (Hedw.) Schimper est une mousse pleurocarpe poussant à la base des troncs ou sur des rochers (Pierrot, Bryophytes du centre ouest, p,100).
Les feuilles sont alternées, de 1 mm de long pour 250 – 350 µm de large à nervure évanescente qui se prolonge jusqu'aux ¾ du limbe. La tige a 220 – 230 µm de diamètre.
01 – Amblystegium serpens (Hedw.) Schimper, Obj. plan x10
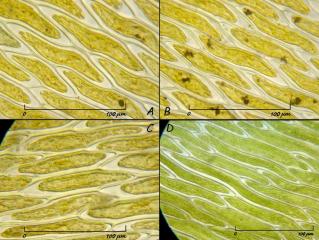
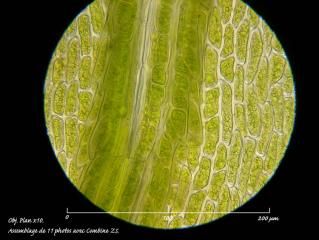
Dans le tiers apical du limbe, les cellules marginales très faiblement denticulées ont une longueur de 26 à 34 µm pour une largeur de 7 à 8 µm. Celles qui jouxtent la nervure sont légèrement plus courtes et plus larges, 26 à 30 µm de long pour 8 à 10 µm de large. Largeur de la nervure 17 – 18 µm.
02 – Amblystegium serpens (Hedw.) Schimper, Obj. plan Nikon x40; tiers apical du limbe.
Dans le tiers moyen de la feuille, les cellules marginales sont longues d'une trentaine de µm pour 8 à 9 µm de large. Près de la nervure, les cellules restent (comme dans le tiers apical) plus courtes et plus larges (15 à 23 µm de long pour 8.5 à 10 µm de large). Largeur de la nervure 25 µm
On compte environ 8 chloroplastes circulaires de 4 à 5 µm de diamètre par cellule. La membrane pecto-celulosique a une épaisseur de 0,5 à 0,75 µm.
03 – Amblystegium serpens (Hedw.) Schimper, Obj. plan Nikon x40; tiers moyen du limbe.
-
Bonjour à tous,
De la famille des Fontinalacées, Fontinalis antipyretica (Hedw.) est une mousse pleurocarpe aquatique. J'ai trouvé cet échantillon fixé sur une pierre immergée sur les bords du Loing (Loiret). Elle forme de longs rameaux flexueux et ramifiés.
01 – Aspect macroscopique de Fontinalis antipyretica.
Les feuilles sont grandes, de 4 à 7 mm de long sur l'échantillon prélevé, pliées en deux dans le sens de la longueur, carénées et fendues à la base, très légèrement décurrentes. Elles sont anervurées et ne présentent pas de marge histologiquement différenciée.
02 - Fontinalis antipyretica, vue générale d'une feuille.
Cellules foliaires :
A : cellules apicales : allongées, grossièrement trapézoïdales, de 80 à 125 µm de long pour 20 à 25 µm de large. On y observe une membrane pecto-cellulosique épaisse de 1,5 à 2 µm.
B : cellules médiales : elles présentent les mêmes caractéristiques que les celllules apicales.
C et D : cellules basales : Très allongées, grossièrement en forme d'un hexagone très écrasé. De 125 à 150 µm de long pour une vingtaine de µm de large (échantillon C) elles peuvent atteindre une longueur de 220 µm (échantillon D, grande cellule au centre de la photo).
03 - Fontinalis antipyretica, morphologie cellulaire (Obj. Nikon plan x40).
Les cellules alaires sont hyalines ou brun roux. Elles ont une forme moins clairement définie. Leur membrane pecto-cellulosique est plus épaisse, de 2,5 à 3 µm. Leur longueur varie de 50 à 80 µm, leur largeur de 20 à 45 µm (photo B ).
04 - Fontinalis antipyretica, cellules alaires. Photo A, Obj. plan x10; photo B, Obj. Nikon plan x 40.
-
Bonjour à tous,
Syntrichia ruralis (Hedw.) Web & Mohr est une mousse acrocarpe saxicole de la famille des Pottiacéesse. J'ai trouvé celle-ci sur des pierres calcaires.
Elle est verte à l'état humide et brun-roux à l'état sec.
01 - Syntrichia ruralis in situ.
Les feuilles, oblongues, spatulées sont nervurées. La nervure, très denticulée, est excurrente, formant un long poil dont la longueur peut atteindre les deux tiers de celle du limbe. Elles présentent une légère carène à l'apex. Leur longueur, poil compris, varie de 3 à 7 mm.
02 - Syntrichia ruralis, nervure excurrente, très denticulée, formant un long poil.
03 - Syntrichia ruralis, nervure excurrente, très denticulée, légèrement carénée à l'apex.
La nervure a une largeur d'une soixantaine de µm. Les cellules adjacentes, grossièrement hexagonales, ont une taille d'environ 15 µm.
04 - Syntrichia ruralis, détail de la nervure dans la partie moyenne de la feuille.
Les cellules marginales [A], grossièrement pentagonales, d'environ 15 µm, portent des papilles sur leur bord externe. Les cellules juxta-marginales sont grossièrement carrées et sensiblement de la même taille.
Les cellules médiales grossièrement hexagonales ont une taille variant de 15 à 20 µm.
Toutes les cellules portent des papilles [C] (papilles en "C" décrites par André) dont la taille varie de 3 à 5,5 µm.
05 - Syntrichia ruralis, détail des cellules.
Je n'ai pas trouvé de capsule mais ne ratez pas la présentation qu'en a faite André.
-
Bonjour à tous,
J'ai trouvé cette mousse acrocarpe dans un sous-bois près de chez moi (Cortrat, Loiret). Il n'y avait pas de capsules.
01 - Mousse acrocarpe, vue générale de l'échantillon.
Les rameaux sont courts et peu ramifiés.
02 - Mousse acrocarpe, détail d'un rameau.
Les feuilles sont lancéolées et nerviées. La nervuve remonte jusqu'à l'apex. La marge n'est pas histologiquement différenciée. La décurence est nulle.
La marge foliaire et la nervure sont denticulées sur le tiers distal de la feuille. Le tiers proximal de la marge foliaire et de la nervure est lisse. Le tiers moyen de la feuille sert de zone de transition. On observe des oreillettes à la base de la feuille.
La feuille du haut a une longueur de 7,6 mm pour une largeur(maximale, zone suprabasale) de 968 µm. La largeur de la feuille, à sa base, est de 626 µm. Sa largeur est de 394 µm au niveau du repli du limbe.
La nervure, quand à elle, a une largeur de 161 µm dans la zone suprabasale du limbe (avant de s'évaser à la base de la feuille).
La feuille du bas a une longueur de 7,1 mm pour une largeur(maximale, zone suprabasale) de 1048 µm. La largeur de la feuille, à sa base, est de 497 µm. Sa largeur est de 382 µm au niveau du repli du limbe.
La nervure, quand à elle, a une largeur de 158 µm dans la zone suprabasale du limbe (avant de s'évaser à la base de la feuille ou sa largeur passe à 248 µm).
03 - Feuilles, Obj. Plan x4.
Dans le tiers apical de la feuille, les dents marginales sont espacées de 60 à 90 µm. Celles de la nervure sont
espacées de 50 à 70 µm.
04 - Dents de la nervure et de la marge au niveau du tiers distal de la feuille. Obj. Plan x10.
Les dents marginales et celles de la nervure ne sont présentes que sur un peu plus du tiers distal de la feuille. Marge et nervure sont lisses dans la partie proximale de la feuille. Le tiers moyen de la feuille est une zone de transition "avec les dents"- "sans les dents" :
05 - Zone de transition "avec les dents - sans les dents". Obj. Plan x10.
Les dents marginales (et celles de la nervure) s'espacent de plus en plus jusqu'à disparaitre :
06 - Zone de transition "avec les dents - sans les dents". Obj. Plan x10.
Les cellules alaires sont grossièrement rectangulaires. Leur longueur varie de 40 à 80 µm et leur largeur de 18 à 23 µm.
07 - Base de la feuille. Obj. Plan x10.
Les dents marginales
Les cellules dentaires ont une longueur de 30 à 50 µm et une largeur de 17 à 20 µm. Les dents elles-mêmes (partie "saillante" de la cellule dentaire) ont une longueur de 7 à 19 µm.
La longueur des cellules du limbe varie de 30 à 50 µm. Leur largeur varie de 11 à 16 µm. La membrane pecto-cellulosique des cellules limbiques a une épaisseur de 1 à 1,5 µm. Dans cette zone, Les plasmodesmes sont peu marqués et peu nombreux (0 à 2 par cellule).
08 - Dents marginales et cellules du limbe à l'union du 1/3 distal et du 1/3 moyen de la feuille. Obj. Plan Nikon x40
Les dents portées par la nervure
On constate sur la photo suivante que les dents de la nervure sont alignées sur 5 colonnes qui suivent l'axe de la feuille :
09 - Dents de la nervure. Obj. Plan Nikon x40.
Les plasmodesmes
Dans la zone moyenne de la feuille, les cellules du limbe s'allongent et prennent une forme plus rectangulaire. La paroi pecto-cellulosique s'épaissit et le nombre de plasmodesmes par cellule augmente. Les dents marginales ont disparu.
10 - Cellules du limbe, au niveau du tiers moyen. Obj. Plan Nikon x40.
Dans le tiers proximal de la feuille, les cellules ont une longueur variant de 70 à 120 µm et une largeur qui varie de 12 à 15 µm.
11 - Cellules du limbe dans le tiers basal de la feuille. Obj. Plan Nikon x40.
A ce niveau, la membrane pecto-cellulosique a une épaisseur de 2,5 µm. Au niveau des plasmodesmes, son épaisseur diminue à 0,5 µm.
12 - Membrane pecto-cellulosique et plasmodesmes, détail. Obj. Plan Nikon x40.
Merci André d'avoir identifié cette espèce ;)
-
Non seulement les dents marginales ont une disposition assez originale, mais encore la nervure (face dorsale de la feuille) présente elle aussi des dents nombreuses et bien développées. On pourra remarquer que contrairement à la photo n° 02, la nervure se poursuit jusqu'à l'apex de la feuille.
05 - Nervure dentée, face dorsale de la feuille. Obj Plan x10.
Mais on n'en a pas fini avec les dents...On remarque sur les deux photos suivantes que non seulement la
nervure (face dorsale de la feuille) porte des dents mais que le limbe en porte aussi, regulièrement réparties sur des lignes (virtuelles) orientées de bas en haut et de dedans en dehors :
06 - Limbe denté, face dorsale de la feuille. Obj Plan x10.
07 - Limbe denté, face dorsale de la feuille. Obj Plan x10.
Sur la photo suivante, on voit que la nervure s'arrète un peu (quelques cellules) avant l'extrémité apicale de la feuille :
08 - Détail de la partie apicale de la feuille. Obj. Nikon Plan x40.
Les cellules du limbe sont polygonales. Elles ont une 'largeur' de 15 à 20 µm et une 'longueur' de 20 à 35 µm (mesures faites sur cette photo prise au niveau du tiers moyen de la feuille).
Les cellules de la nervure (mesures faites sur cette photo prise au niveau du tiers moyen de la feuille) sont
rectangulaires. Elles ont une largeur de 15 à 20 µm et une longueur de 24 à 33 µm.
09 - Détail de la partie moyenne de la feuille. Obj. Nikon Plan x40.
Les cellules basales du limbe sont grossièrement rectangulaires. Leur largeur varie ici de 15 à 28 µm et leur
longueur de 30 à 60 µm.
10 - Détail de la partie basale de la feuille. Obj. Nikon Plan x40.
Les feuilles ont une décurence faible (ici, d'un peu plus d'un demi millimètre). Cette feuille, à sa base, a une
largeur de 510 µm. Elle ne présente pas d'oreillettes. La nervure rreprésente le tiers de la largeur de la feuille à sa base.
11 - Décurrence de la feuille. Obj. Plan x10.
-
Bonjour à tous,
Mnium hornum Hedw est une mousse acrocarpe que j'ai trouvé dans un sous-bois près de chez moi (Cortrat, Loiret).
01 - Mnium hornum Hedw.
Les feuilles sont longues, 5 à 9 mm pour les plus grandes, ovales. Elles présentent une nervure bien définie qui disparaît un peu avant l'apex de la feuille.
La feuille de la photo suivante fait un peu moins de 5 mm de long et un millimètre de large.
02 - Feuille de Mnium hornum Hedw; Obj. Plan x4.
Les feuilles ont une marge histologiquement différenciée, formée d'une seule couche de cellules très allongées, à membrane très épaisse (4 à 5 µm d'épaisseur).
Sur la photo suivante, cette dent marginale a une longueur de 148 µm et une largeur de 22 µm à l'union du tiers externe et du tiers moyen.
03 - Détail de la marge et des dents. Obj Nikon Plan x40.
Mnium hornum Hedw, le requin des bryophytes :
Les dents marginales sont regroupées par paires faisant (à vue d'oeil!) un angle de 120° entre elles et avec le limbe. Sur cette photo, les paires de dents sont espacées de 200 à 220 µm.
04 - Dents marginales appariées en vue épiscopique. Obj Plan x10.
-
Bonjour à tous,
Dans un échantillon de Polytrichum formosum Hedw, j'ai trouvé pas mal de capsules sèches. Quelques photos prises avec un éclairage épiscopique m'ont permis de détailler l'ouverture de l'opercule de la capsule.
Cette première photo montre la partie distale de la coiffe encore sur la capsule :
01 - Extrémité distale de la coiffe d'une capsule de Polytric, éclairage épiscopique, Obj. x4.
Voici maintenant la capsule, sans sa coiffe, le péristome encore fermé par son opercule :
02 - L'opercule est encore soudé aux dents du péristome, éclairage épiscopique, Obj. x4.
L'opercule commence à se détacher des dents qui le portent et s'enfonce dans la capsule :
03 - L'opercule commence à se détacher du péristome, éclairage épiscopique, Obj. x4.
Sur la photo suivante, l'opercule est détaché et enfoncé aux deux tiers dans la capsule. On peut voir une sorte de perle sur les dents (en haut et presqu'au centre).
04 - L'opercule presqu'entièrement détaché du péristome, éclairage épiscopique, Obj. x4.
La perle pourrait-elle être une spore ou bien n'a-t-elle rien a voir avec la capsule? Par curiosité, je l'ai détaillée avec un Obj. x20, toujours en épiscopie. Moi, ça ne m'a rien appris, mais peut-être que pour quelqu'un, André peut-être, ;) cela sera plus parlant :
05 - éclairage épiscopique. Obj. Plan x20.
Voici enfin la capsule complètement désoperculée, et un peu brisée malheureusement :
06 - Capsule désoperculée, éclairage épiscopique. Obj. Plan x4.
J'aime bien cette photo car elle permet de voir un peu dans la capsule. Je constate que l'on retrouve ça et là des petites 'perles' qui finalement seraient peut-être bien des spores???
-
Bonjour à tous,
Voici mon microscope :
01/02 : Acheté chez 'Brunel Microscopy' et détourné de sa fonction première, ce dispositif de vision 'à deux' me
permet de voir/faire le point (01) ET de photographier (02).
03 : Platine 'Kaiser' à mouvements croisés. Je l'avais achetée il y a bien des années quand j'ai commencé à
m'intérresser aux anaglyphes.
04 : une simple plaque d'acier zingué achetée dans une grande surface de bricolage pour fixer la platine à
mouvements croisés sur la 'colonne'.
05 : La 'colonne', un pied de tabouret acheté dans la même grande surface de bricolage.
06 : Petit bricolage maison pour l'éclairage épiscopique et diascopique.
07 : Le support de l'ensemble; directement inspiré par l'installation de Jean.
Mes objectifs :
Les objectifs d'origine :
01 : x 10 / 0.25
02 : x 40 / 0.65
Un bon jeu d'objectifs PLANS achetés d'occasion chez Brunel (une très bonne affaire, ils annonçaient 4 obj. pour 68 £ et j'ai reçu ces 5 Obj. (qui correspondent à ce jeu d'obj. encore disponible pour un peu moins de 128 £). Dans le détail :
04 : PLAN x 4 / 0.1 - 160 / -
05 : PLAN x 10 / 0.25 - 160 / -
06 : PLAN x 20 / 0.40 - 160 / 0.17
07 : PLAN x 40 / 0.65 - 160 / 0.17
08 : PLAN x 100 / 1.25 oil - 160 / 0.17
Du même fournisseur une autre affaire (25.53 £ !) :
03 : NIKON PLAN x 40 / 0.65 - 160 / 0.17
Le dispositif de 'visualisation/prise de vues' n'est pas idéal. Les oculaires sont vissés au système et ne sont ni interchangeables ni standard. Leur champ est petit. MAIS ce système coûte 4 fois moins cher que le 'vrai'
dispositif.... et mon budget est TRES limité!
Et voici le tube 'binoculaire' dans son coffret :
-
-
Bonsoir à tous,
Bonsoir André,
mais pour apprécier la longueur de celle -ci sur la tige,il faudrait une vue de l'insertion des feuilles avant le prélèvement !Et hop!
15 - Insertion des feuilles.
A noter, les feuilles portées par ce rameau se sont flétries le temps de la série de prises de vues. C'est la seule des 4 mousses que je vous ai présenté qui se soit montrée aussi fragile.
-
-
Bonjour à tous,
Bonjour André,
A présent il serait intéressant de considérer la décurrence des feuillesIgnorant que je suis (que j'étais!) de ce qu'est la décurrence des feuilles, Mr Larousse m'indique : "Organe décurrent, qui se prolonge sur son point d'insertion, feuille décurrente."
C'est donc bien la zone du point d'insertion de la feuille sur le rameau que tu veux que j'examine??? :unsure:
Bien amicalement,
Bertrand
-
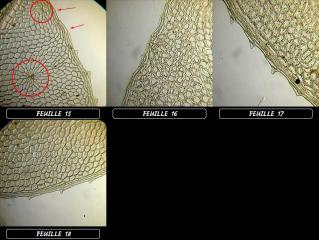
13 - Feuilles 15 à 19; Obj. PLAN x10.
- Les feuilles possédant une denture normalement développée ne montraient aucune trace d'agression.
- Les feuilles qui présentaient une anomalie de leur denture ( dents développées irrégulièrement ou absentes) présentaient TOUTES des traces d'agression plus ou moins bien cicatrisée.
- Certaines feuilles présentaient des traces d'agression plus ou moins cicatrisées (feuilles 01 et 04, photo 11) et ne présentaient pas (ou presque) de "malformation" de leur denture.
Il semblerait que lorsque la feuille subit une agression avant ou pendant le développement des dents, ce dernier en soit affecté, partiellement ou totalement (feuille 05, photo 11) inhibé.
Pardon d'avoir été un peu long mais j'ai trouvé amusant qu'une mousse qui avait été mordue ait des problèmes...de dents!!! :D


























































































Stauroneis phenicenteron Ehrenberg 1843
dans Diatomées (Collections)
Posté(e) · Modifié par Bertrand
Bonsoir à tous,
Stauroneis phenicenteron Ehrenberg 1843 est une diatomée dont la longueur varie, sur cette lame prétée par André Advocat, de 123 à 182 µm, et la largeur de 26 à 34 µm.
On compte 13 stries, radiantes, en 10 µm.
Les vignettes dans les photos montrent un morceau de la photo à l'échelle 1.
Les photos ont été faites en couleur et ramenées en niveaux de gris par MicroCartouche. L'utilisation du filtre orange (gélatine LEE FILTER, ORANGE N° 105) permet une amélioration du contraste uen fois la photo ramenée en niveaux de gris.
01 - Obj. x 40 Nikon Plan.
02 - Obj. x 100 Plan.
03 - Obj. x 40 Nikon Plan. La vignette sur cette photo est tirée d'un autre cliché issu de la même lame.