-
Compteur de contenus
2 227 -
Inscription
-
Dernière visite
Tout ce qui a été posté par Dominique Voisin
-
CSLE Cymbella silesiaca Bleisch in Rabenhorst Synonyme : Encyonema silesiaca (ESLE) Références: Krammer & Lange-Bertalot 1986 p.304 f.117: 1 - 24 Famille: Naviculacées Caractéristiques: longueur: 15 - 46 µm largeur: 6,5 - 14,2 µm 10,5 - 15 stries dorsales / 10 µm au centre Ecologie: Espèce présente en eaux oligotrophes à eutrophes.
-
CRAC Craticula accomoda (Hustedt) Mann Synonyme : Navicula accomoda (NACO) Références: Krammer & Lange-Bertalot 1986 p.128 f.45: 13 - 20 Famille: Naviculacées Caractéristiques: longueur: 17 - 25 µm largeur: 4,5 - 8 µm 17 - 25 stries / 10 µm au centre Ecologie: Souvent voire très souvent dans les biotopes à fortes teneurs en matières organiques.
-
CPST Cyclotella pseudostelligera Hustedt Synonymie : Cyclotella stelligera var. pseudostelligera (CSPG) Références : 1939 Krammer & Lange-Bertalot 1991 p.51 f.49 : 5 - 7 Famille : Centrophycidées Caractéristiques : Diamètre : 4 - 10 (12?) µm 18 - 22 stries radiantes /10 µm Stries interrompues entre le centre et la périphérie. Présente, au centre, une étoile plus ou moins nette. Stries fines en périphérie avec présence de processus labiaux Ecologie : Espèce planctonique ubiquiste.
-
CMED Cyclotella meduanae Germain Synonymie : Références : 1981 (Flore) p.36 f.8 : 28 Famille : Centrophycidées Caractéristiques : Diamètre : 5- 7 µm Hauteur : 2 - 5 µm Ecologie : Espèce planctonique.
-
CINV Cyclostephanos invisitatus (Hohn & Hellerman) Theriot, Stoermer & Hakansson Synonymies : Stephanodiscus invisitatus (STIN) Stephanodiscus hantszchii var. striator (SHST) Stephanodiscus incognitus (SINC) Références : Krammer & Lange-Bertalot 1991 p.63 f.67 : 3 – 4 Famille : Centrophycidées Caractéristiques : Diamètre : 6,4 - 14 µm. Rayons élargis en côtes en périphérie. Stries fines convergentes vers le centre. Ecologie : Vraisemblablement ubiquiste. Espèce planctonique
-
CATO Cyclotella atomus Hustedt Synonymie : Références : Krammer & Lange-Bertalot 1991 p.53 f. 51 : 19 - 21 Famille : Centrophycidées Caractéristiques : Diamètre : 3,5 - 7 µm 16 - 20 stries radiantes /10µm Stries inégales en périphérie. Présence d'un point (processus renforcé) dans la partie centrale de la valve Ecologie : Espèce ubiquiste.
-
AVEN Amphora veneta Kützing Références: Krammer &Lange-Bertalot 1986 p.348 f.151: 7 - 17 Famille: Naviculacées Caractéristiques: longueur: 5 - 60 µm largeur: 7 - 18 µm Ecologie: Espèce des eaux eutrophes.
-
AUGA Aulacoseira granulata (Ehrenberg) Simonsen var. angustissima (O.Müller) Simonsen Synonymie : Melosira granulata var. angustissima (MGAN) Références : Krammer & Lange-Bertalot 1991 p.23 f.18 : 13 Famille : Centrophycidées Caractéristiques : Diamètre : 4 -30 µm Hauteur : 5 - 24 µm Rapport Hauteur/Diamètre important, jusqu'à 10 µm. Petites aréoles, cylindre parfois incurvé avec piquants Ecologie : En eaux eutrophes.
-
AUDI Aulacoseira distans (Ehrenberg) Simonsen Synonymie : Melosira distans (MDIS) Références : Krammer & Lange-Bertalot 1991 p.32 f.29 : 1 - 23 Famille : Centrophycidées Caractéristiques : Diamètre : 4 -20 µm Hauteur : 3,5 - 8,5 µm Petites aréoles, cylindre avec petites épines. Rapport Hauteur/Diamètre inférieur à 1 µm. Ecologie : En eaux acides
-
ASAT Achnanthes subatomoides (Hustedt) Lange-Bertalot et Archibald Références: Krammer & Lange-Bertalot 1991 p.24 f.14: 1 - 10 Famille: Monoraphidées Caractéristiques: longueur: 6 - 15 µm largeur: 3,5 - 6,5 µm 28 - 40 stries / 10 µm Ecologie: Espèce indicatrice des eaux oligosaprobes.
-
AMMO Amphora montana Krasske Références: Krammer & Lange-Bertalot 1986 p.349 f.151: 18 - 27 Famille: Naviculacées Caractéristiques: longueur: 9 - 25 µm largeur: 7 - 10 µm 27 - 36 stries / 10 µm au centre Ecologie: Espèce ubiquiste.
-
ALAU Achnanthes lauenburgiana Hustedt Références: Krammer & Lange-Bertalot 1991 p.26 f.14: 27 - 34 Famille: Monoraphidées Caractéristiques: longueur: 4,5 - 17 µm largeur: 3 - 6 µm 24 - 28 stries / 10 µm Ecologie: Espèce ubiquiste.
-
ACON Achnanthes conspicua A. Mayer Références: Krammer & Lange-Bertalot 1991 p.28 f.16: 22 -33 Famille: Monoraphidées Caractéristiques: longueur: 7 - 16 (20) µm largeur: 4 - 6 (7,5) µm 11 - 16 stries / 10 µm Ecologie: Espèce ubiquiste mais peu fréquente dans les eaux alcalines.
-
ACLE Achnanthes clevei Grunow var. clevei Synonyme : Achnanthidium clevei (ACCL) Taxon apparié : Achnanthes clevei var. rostrata (ACRO) Références: Krammer & Lange-Bertalot 1991 p.35 f.21: 10 - 17 Famille: Monoraphidées Caractéristiques: longueur: 8 - 32 µm largeur: 4,5 - 10 µm 16 - 27 stries / 10 µm Ecologie: Généralement en eaux stagnantes ou en cours d'eau lents.
-
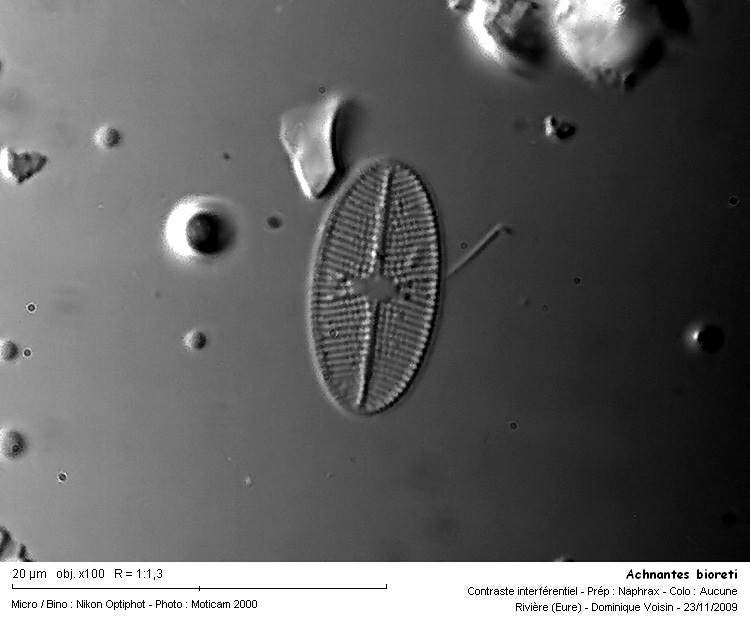
ABIO Achnanthes bioreti Germain Références: Krammer & Lange-Bertalot 1991 p.19 f.12: 1 - 19 Famille: Monoraphidées Caractéristiques : longueur: 10 - 30 µm largeur: 5 - 10 µm 22 - 28 (32) stries / 10 µm Ecologie: Vraisemblablement ubiquiste. Généralement en zones froides et tempérées.
-
AAMB Aulacoseira ambigua (Grunow) Simonsen Synonymie : Melosira ambigua (MAMB) Références : Krammer & Lange-Bertalot 1991 p.25 f.21 : 1 -16 Famille : Centrophycidées Caractéristiques : Diamètre : 4- 17 µm Hauteur : 5 - 13 µm Petites aréoles, cylindre sans piquant Ecologie : Espèce ubiquiste et souvent avec Aulacoseira granulata dans les eaux eutrophes.
-
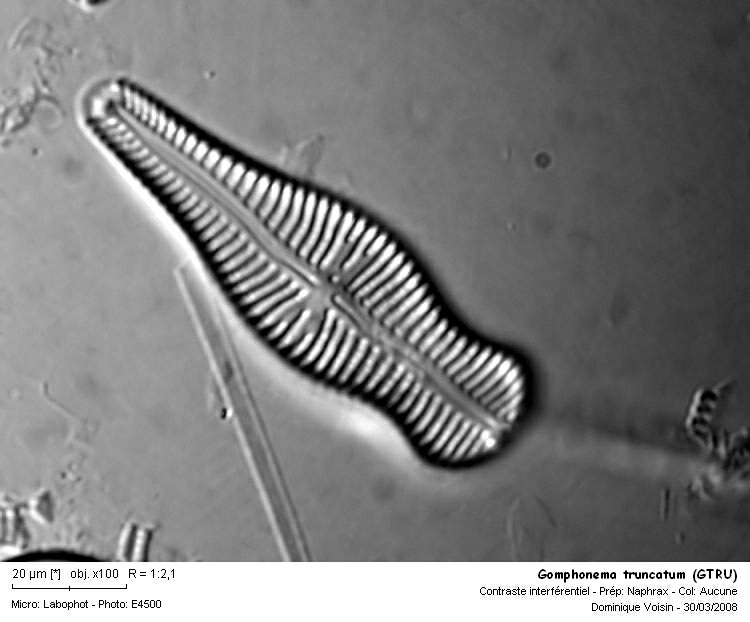
GTRU Gomphonema truncatum Ehrenberg Références: Krammer & Lange-Bertalot 1986 p.369 f.159: 11 - 18 Famille: Naviculacées Caractéristiques: longueur: 13 -75 µm largeur: 7 - 17 µm 9 - 12 stries / 10 µm Ecologie: Espèce ubiquiste. Elements de détermination: Valves hétéropolaires le plus souvent en massue, valve à tête très arrondie, stries avec une seule rangée d'alvéoles
-
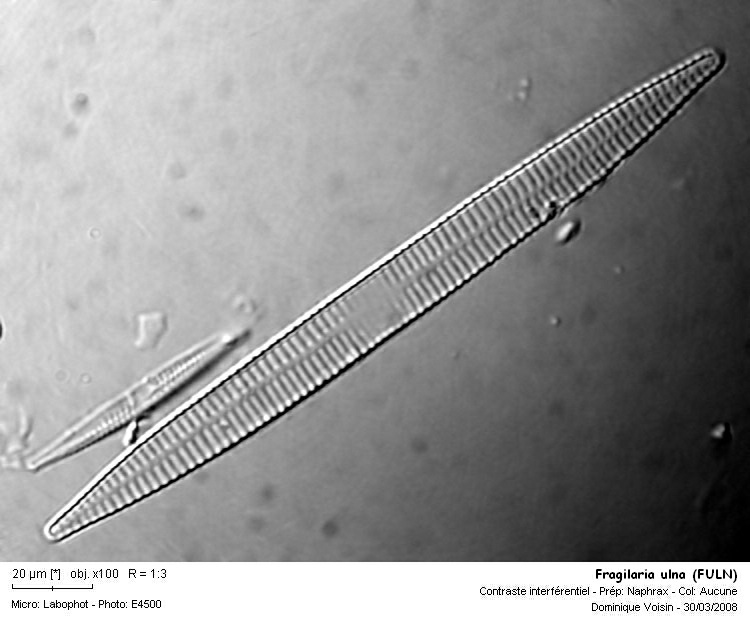
FULN Fragilaria ulna (Nitzsch.) Lange-Bertalot var. ulna Références: Krammer & Lange-Bertalot 1991 p.143 f.122: 1 - 8 ; f.124: 1 - 2 Famille: Araphidées Caractéristiques: longueur: 27 - 600 µm largeur: 2 - 9 µm 7 - 15 stries / 10 µm Ecologie: espèce ubiquiste, présente en masse par endroits. Eléments de détermination: Araphidées, formes longues, pseudoraphé bien visible, aire centrale marquée
-
FCVA Fragilaria capucina Desmazieres var. vaucheriae (Kützing) Lange-Bertalot Références: Krammer & Lange-Bertalot 1991 p.124 f.108: 10 - 15 Famille: Araphidées Caractéristiques: longueur: 25 - 80 µm largeur: 4 - 5 µm 9 - 14 stries / 10 µm Ecologie: Amplitude écologique apparemment étendue. Eléments de détermination : Araphidée, forme courte, pseudoraphé bien visible, aire centrale unilatérale
-

Matériel pour identification diatomées
Dominique Voisin a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonsoir Stephane, Bon si tu as des contacts avec le CEMAGREF de Bordeaux et Michel Coste, je pense que tu cotoies le Must en matière d'IBD et nous n'avons sans doute pas grand choses à t'apprendre mais c'est plutôt à toi de nous en conter... Ceci étant dit, je suis près à être en contact avec toi de façon plus personnelle étant assez attiré vers les problématiques de l'IBD, les questions que tu poses me semblent assez pointues pour que les réponses passent tout simplement par nos propres expèrimentations il y a par exemple certainement des incidences liées à la présence / absences de ripisylve mais c'est bien pour cela que la notion de "station" est définie dans l'IBD comme étant de 10 fois la largeur du lit étudié afin de limiter les phénomènes d'ombrage sur une partie du cours d'eau, cela mériterait une petite étude de prélèvement sur des substrats proches mais avec des conditions d'éclairement différents.... à ma connaissance il n'y a aujourd'hui pas de réponse à cette question et l'étudier serait sans doute une avancée dans la connaissance des paramètres qui font varier l'IBD. concernant la détermination il est évident que la flore de Germain est une base interessante mais enormément de taxon ont changé de noms... dans la révision de l'IBD de 2006 on estime que l'evolution de la systématique a conduit au renouvellement de 40% des dénominations de taxons retenus en 2000 !!! donc par rapport à un ouvrage de 1981 !!! Le Süsswasserflora von Mitteleuropa de Krammer et Lange-Bertalot est certainement plus précis mais le prix des 4 tomes sur les Bacillariophycaee est vraiment prohibitif. Personnellement, bien que possedant ces ouvrages, je replonge dans les publications du CEMAGREF pour affiner les dénominations et j'attend avec impatience de nouvelles pour tenir compte des évolutions taxonomiques. procure toi si tu ne l'as déjà le CDRom Tax'IBD pour l'identification rapide, il comporte en plus une feuille de calcul Excel pour le calcul de l'IBD le Guide de l'utilisateur est aussi une base dont je me sert souvent tant pour la détermination que pour la mise en oeuvre de l'IBD, tu peux le trouver sur le site du CEMAGREF http://cemadoc.cemagref.fr/exl-doc/pub/200...PUB00008265.pdf Attention ça fait 60 Mo pour le x100 je ne vois pas ce qui serait mieux à part le microscope electronique pour la détermination au niveau de l'espece !!! au dela, la qualité intrinseque de la lumière pose les limites du grossissement... au plaisir de te lire Dominique -

Matériel pour identification diatomées
Dominique Voisin a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Stephane, Là tu touches à mon dada... j'ai certainement plein d'infos qui pourrait t'interesser on verra ça plus tard.... Un des problème de l'IBD c'est qu'il faut être en capacité de reconnaitre les 209 taxons référencés et même plus pour les taxons apairés au niveau du genre, il y a rarement de problème en revanche au niveau de l'espece et des variétés là ça se corse, la distinction se fait quelque fois sur d'infimes détails.... la différence d'autoécologie des différents taxons peut être telle qu'on réfléchis aujourd'hui à l'ouverture de l'IBD à plus de 400 taxons afin de réduire les marges d'erreur d'appréciation. Tous ceci pour dire qu'une extrème qualité d'identification est impérative pour avoir des résultats significatifs et réelement corellés à une des sept classes de qualité de l'eau étudiée ce qui implique d'une part une documentation sèrieuse et d'autre part un matèriel performant. le calcul de l'IBD se faisant sur la lecture d'au moins 200 frustules, il faut passer quelques heures à observer et identifier pour effectuer le comptage, le coté ergonomique du microscope doit donc être particulièrement pris en compte, le binoculaire est quasiment indispensable. Il est inutile de soigner particulièrement sa gamme d'objectif sauf concernant le x100 qui doit être le plus qualitatif possible. Tous les comptages doivent être faits au x100. Si le budget le permet, le contraste de phase est souvent très pratique (toujours au x100) pour différencier deux taxons proches, le mieux étant bien sur le contraste interférentiel, mais là on ne joue plus dans la même cour.... Le lien donné par Michel montre un matèriel tout à fait correct pour cette utilisation mais bien sur il y en a bien d'autres... Pour le Naphrax, il semble qu'il n'y ait plus que Brunel en Angleterre qui en fournisse, ils vendent par correspondance sans problème Au plaisir de te lire Dominique -

recherche microscope
Dominique Voisin a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Sébastien, Bonne année aussi à vous... 2008 commence par de sacrés projets on dirait !!! Je ne sais pas à quel grossissement vous avez besoin d'explorer vos frottis, mais je parirais bien sur une recherche de bactérie et donc au x100 de bonne qualité à priori, ce qui ne vous met pas en position très simple, peu de budget et des besoins importants.... Il me semble qu'un microscope simple monoculaire à mirroir du type PCB avec une toUcam devrait faire l'affaire, mais ce n'est que mon avis. allez faire un tour sur le site http://www.microscopies.com/ dans un premier temps ça devrait vous éclairer un peu Voyons ce qu'en pensent mes petits camarades.... Cordialement Dominique -

liquide immersion pour le sf10
Dominique Voisin a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Ludo, le diiodomethane a un indice de refraction d'1,74, je suppose donc que tu cherches un milieu du même genre d'indice...? Mais que l'on soit bien d'accord sur les termes : Qu'est ce que tu appelles un liquide d'immersion ???? c'est bien pour un objectif à immersion n'est ce pas ?? Je ne sais pas personnellement ce que c'est que du SF10... merci d'éclairer ma lanterne à moi.... Qu'est ce que c'est que cet objectif qui est calculé pour une immersion à liquide haut indice ???? En principe le liquide à immersion est marqué sur les objectifs.... W, oil, gly..... qu'est ce qui est marqué sur le tien Cordialement Dominique -
Bonjour Visiteur, L'idée semble en effet interessante, mais que d'investissements pour un tel résultat !!! Déjà il serait utile de savoir quel grossissement serait nécéssaire, en fait quel champ devrait être numérisé... puis tenter de calculer quel couple objectif / taille de capteur serait utilisable... pas si simple tout ça !!! ça mérite reflexion, mais ça me parait compliqué Cordialement Dominique
-

Coupe transversale de feuille de TYPHA
Dominique Voisin a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour visiteur, Je me suis autorisé une petite retouche de tes images... Je n'y connais pas grand chose non plus, mais je vais jetter un oeil dans mes bouquin. Cordialement Dominique