-
Compteur de contenus
592 -
Inscription
-
Dernière visite
Messages posté(e)s par Robert Rivière
-
-
Salut Francois-Pierre,
question LED blanche je suis devenue incollable :D vue le temps que j’ai mis a comprendre le site en Allemand pour commander tous cela. Heureusement que j’ai trouvé grâce au forum quelques âmes charitables pour venir a mon secours de compréhension :D
Je confirme, l’éclairage Luxeon 3w led blanche est indispensable avec une Webcam coté résultat.
Donc, si tu as besoin d'un coup de main cela sera avec un grand plaisir!
Mais bon, on s'éloigne du sujet sur la gélatine glycérinée et a ce moment la, autant en parler avec un sujet plus aproprié!
Amicalement,
Robert
-
Bonsoir a tous,
Ayant du matériel d’aquariophilie, je me disais : « pourquoi ne pas l’utiliser pour cultiver mes algues vertes type pediastrum etc »
Je pense que c’est tout a fait possible, par contre, quelqu’un ici aurait-il une info concernant le milieu de culture. Je cherche pour par exemple les pediastrum (16 ou 64 bits ! Hein Patrick ! ;) ) s’ils leur est nécessaire une eau plutôt oxygénée ou pas, soleil ou pas etc etc
Ainsi que la zone de prélèvement : sont-ils plutôt en surface ou au fond ? Car a chaque fois que je suis tombé sur un pediastrum ce fut par pure chance.
Amicalement,
Robert
-
Et pour finir, voici les conseils de nos amis Marcel, Dominique alias gyrosigma :) et Christian alias Chris!
Extrait du site de Marcel: CHAMPIGNONS_PASSION et de ses fiches techniques:
http://users.skynet.be/Champignons_passion/main.htm
1/ Coloration Safranine-Vert intense:
* Coloration à la safranine O, en solution alcoolique à 1%, durant 2 minutes
* Rinçage à l'alcool isopropylique (2x)
* Coloration au vert-intense (fast-green), en solution alcoolique, durant 10
secondes
* Rinçage à l'alcool isopropylique (2x ou plus) -> pour diminuer une éventuelle
surcoloration du vert-intense.
2/ Double coloration : Vert d’iode + carmin aluné
Un grand classique !
Etapes successives :
* colorer au carmin aluné durant une heure minimum (nous préférons aller jusqu’à 2 heures)
* rinçage rapide à l’eau ordinaire
* colorer au vert d’iode durant 10 à 15 secondes
* rinçage rapide à l’eau ordinaire
* en cas de surcoloration du vert d’iode, différencier à l’acide chlorhydrique à 5 % (il permet de mieux contrôler la régression qu’une solution plus concentrée) et laver à l’eau ammoniaquée à 1 %. Ce processus est valable également pour le vert malachite, le vert de méthyle et le vert solide.
Les éléments ligneux sont remarquablement colorés en vert, et le reste est rouge carmin, avec un excellent contraste et une préparation spectaculaire.
3/ Double coloration : Rouge de ruthénium + bleu de méthylène aluné
Elle fournit également des préparations exceptionnellement colorées.
Etapes successives :
* colorer au bleu de méthylène aluné durant 10 minutes
* rinçage rapide à l’eau ordinaire
* colorer au Rouge de ruthénium durant 10 minutes
* rinçage rapide à l’eau ordinaire
Les éléments lignifiés sont colorés en bleu, le sclérenchyme est violet, le liège est vert et le parenchyme affiche des variations de rose.
------------------------------------------------------------------------
Si avec tous ça on n'y arrive pas ;)
Bien amicalement a tous,
Robert
-
Et pour presque finir ;) un protocole de l'UFR des Sciences de la Vie de JUSSIEU:
http://www.snv.jussieu.fr/vie/documents/tp...ation1.htm#colo
Coloration carmin - vert d'iode : protocole
1. Réaliser des coupes transversales dans l'échantillon
2. Placer les coupes 10 à 20 minutes dans l'hypochlorite
3. Lavage abondant à l'eau
4. Lavage rapide dans l'acide acétique dilué
5. Coloration dans le carmin-vert d'iode, ou bien coloration dans un bain de carmin suivi d'un bain de vert d'iode (voir les conseils)
6. lavage à l'eau puis observation
Matériel:
* L'échantillon à étudier (tige, feuille, racine, etc.)
* Acide acétique dilué (1 volume d'acide dilué dans 1 volume d'eau)
* Hypochlorite de sodium (eau de Javel sans additif) (diluée à 5-10 degrés chlorométriques si besoin - l'eau de Javel pure vendue en bouteilles - 12°- peut être utilisée)
* Carmin-vert d'iode , ou Carmin et Vert d'iode
-
Bonjour a tous,
voici un extrait concernant la double coloration Carmi aluné - Vert d'iode:
Coloration.
Les détails de l'objet à l'état frais sont insuffisants. Cela est dû au manque de transparence et à l'indice de réfraction qui est à peu près le même pour les différents milieux. Il faut donc colorer pour suppléer aux différences d'indices par les différences de coloration.
La faible réfringence des microorganiques et les grossissements considérables nécessaires à leur observation exigent avant tout l'examen des artifices de préparations.
Les colorations jouent un très grand rôle dans la microscopie. quelques essais permettront, suivant leur nature, de se rendre compte de la durée de la coloration.
coloration Carmi aluné - Vert d'iode:
* Exécution. Coloration de la matière végétale.
1. Carmin aluné: 20 minutes ou plus.
2. Laver.
3. Laisser dans le verre de montre quelques gouttes d'eau. Ajouter très peu de solution de vert d'iode. Laisser quelques minutes.
4. Laver.
Extrait pris sur le site: http://www.perret-optic.ch de PERRET OPTICIENS
-
Bonsoir Marcel, bonsoir François-Pierre,
si j'ai bien compris ce que tu dis ici Marcel, on peux remplacer l'utilisation de la GG avec par exemple de l'alcool polyvinylique lactophénolé? Et si oui, est ce que cela apporte un "plus" en terme de préparation semi définitive? Pas besoin d'une déshydratation? C'est la même utilisation que la GG au final?
Pour le problème des bulles dans la GG il y a l’astuce de Micromars2001 voir:
http://forum.MikrOscOpia.com/index.php?sho...st=0entry7793
Bien amicalement,
Robert
-
Bonsoir a tous,
Voici une petite synthèse de ce j’ai trouvé concernant les principales colorations en histologie végétale :
1/ Carmin aluné - Vert d’iode
Dans le LOCQUIN-LANGERON il est dit :
« Colorer pendant une heure au moins au carmin aluné de grenacher. Laver rapidement a l’eau. Colorer pendant quelques secondes dans un verre de montre renfermant quelques centimètres cubes d’eau à laquelle on a rajouté un peu de vert d’iode. Puis monter au baume. »
2/ Bleu de méthylène – rouge de ruthénium
« Cette méthode donne, à notre avis, des résultats encore plus beaux. Colorer pendant 5 à 10 minutes dans le bleu de méthylène aluné et laver à l’eau.
Colorer pendant 5 à 10 minutes dans la solution à 0.1% de rouge de ryhènium. »
Résumé des réactions des principaux colorants :
Bleu de méthylène aluné : bois et suber.
Carmin aluné : membranes non lignifiées.
Safranine : bois et suber.
Rouge de Ruthénium : composés pectiques.
Vert d’iode : bois et suber.
Vert de Méthyle : bois et suber.
Principaux colorants :
Vert de Méthyle : basique, colorant nucléaire, de tissu lignifié,
Vert d’Iode : basique, colorant nucléaire, de tissu lignifié,
Rouge de Ruthénium : oxychlorure de ruthénium ammoniaqué, colorant des pectines.
Safranine : safranine O acide, safranine T basique
Carmin : acide
Bleu de méthylène : basique.
Extrait du Manuel de Microscopie de M. LOCQUIN et M. LANGERON édition MASSON
Bien amicalement a tous,
Robert
-
Tout a fait Chris,
j'ai volontairement fais l’inverse de manière a voir par moi-même.
Par contre j’ai aussi résonné plus simplement en commencent par le colorant qui est le plus colorant, disons le plus concentré.
Mais je vais étudier mon Manuel de Microscopie de LOCQUIN LANGERON car il y a une très bonne partie du livre qui parle justement des colorations et de la manière d’on elles agissent. Je vais essayer de faire un synthèse des principales doubles colorations que l’on utilise en histologie végétale (je les ai toutes en principe re merci Marcel :) ) et pourquoi pas exposer ici mes résultats.
Amicalement,
Robert
-
Bonsoir Michel,
il me semble que c'est Chris au sujet de mon pélargonium car je parlais justement de l'ordre de mes colorations.
voir:
http://forum.MikrOscOpia.com/index.php?showtopic=1853&hl=
Amicalement,
Robert
-
Salut a tous salut Dominique,
Fallait-il encore que je sache qu'elle était sur la vue connective :)Par pitiés !!! pas de demande de détermination sur des vues connectives !!! c'est trop dur !!!alors quand ça vous arrive, un petit coup sur la lamelle pour faire bouger le tout et on attend que la diatomée se trouve sur le vue valvairDans la résine cela marche aussi? :D
Merci pour ton aide Dominique et tu as une fois de plus tapé dans le mille!
Amicalement,
Robert
-
-
-
-
Salut Patrick,
ça y est! Tu l'as ton 132 Bits :D
Amicalement,
Robert
-
Bonjour a tous et salut André,
par contre pour les pores que tu indiques ,je me demande si ce n'est pas un artefact??Je pense aussi, mais attendons d'autres réponses et d'autres photos pour voir.
Bien amicalement,
Robert
-
-
Bonsoir a tous,
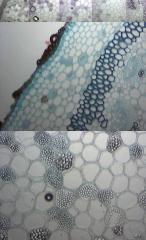
André, c'est une coupe que j'ai fait sur la tige de floraison de mon PELARGONIUM :D
Marcel, bingo c'est bien de l'amidon.
De haut en bas X4, X4, X10, et X40 Coloration au liquide de Lugol aprés passage Dakin,
fixateur AFA, et montage en glycérine gélatinée.
Je suis super content d'avoir apris a reconnaitre l'amidon, merci encore Marcel.
Bien amicalement,
Robert
-
Bonsoir a tous,
Merci Marcel, je vais tester ça! Ca devrait aller j'ai du liquide de Lugol.
Dominique tu devrais reconnaître, c'est le fameux disons notre fameux Geranium qui est en réalité un Pélargonium (ça va faire plaisir a André ;) )
Bonne soirée,
Robert
-
Re re Olivier,
concernant ces billes elles me font penser tout simplement a des billes de verre.
Amicalement,
Robert
-
-
J'en connais deux qui en ont plein les pediastrum hein Patrick? :D
-
V'la autre chose! Les algues peuvent avoir des verrues? :)
amicalement,
Robert
-
Salut a tous, salut Patrick,
Effectivement, si on doit acheter tous les bouquins intéressants qui existent, il nous faudrait gagner au loto. Pour ma part j’ai reçu le Guide des diatomées de Maurice LOIR et le Manuel de Microscopie de LOCQUIN et LANGERON.
Je crois aussi qu’il ne faut pas être pressé et se constituer sa propre bibliothèque petit à petit.
Le problème que j’ais, c’est que tout m’intéresse et a part les diatomées ou j’ai un gros faible, tout le reste est tout aussi passionnant. Les mousses par exemple, jamais je ne m’y suis intéressé et je dois dire que j’aime beaucoup les mousses. Cela doit être ma prédilection pour les mousses Belges et la Chimay en particulier :) (un petit clin d’œil a Marcel en passant ;) )
Concernant les algues a part le Bourrelly est ce qu’il y a d’autres livres aidant a l’identification ?
Amicalement,
Robert
P.S. Merci Patrick pour ton petit mail :) on reprend la compétition alors ! Hein ? ;)
-
Salut a tous ;)
Dis donc Patrick du commence fort et sur les chapeaux de roues! En tout cas chapeau pour tes superbes images!
Amicalement,
Robert



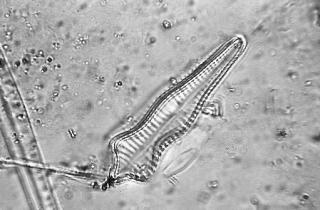
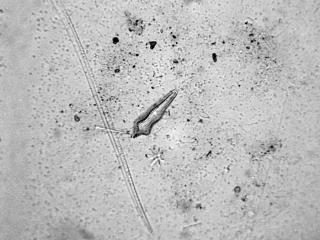

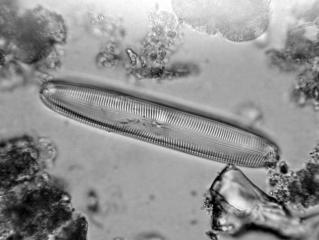
Surirella gemma
dans Diatomées (Collections)
Posté(e)
Salut Jean-Marc, salut Dominique,
autre possibilité: Téléphoner a l'EDF, changer le compteur pour une centrale electrique et passer au microscope electronique :P :D
Amicalement,
Robert