-
Compteur de contenus
2 142 -
Inscription
Messages posté(e)s par Christian Aubert
-
-
Bonjour à vous deux,
Pour une coïncidence c’en est une :)
Je ne savais pas du tout que les tardigrades pouvaient pondre dans les mues.
Sortent ils en même temps que la mue , ou y sont ils pondus après???Voici ce que j’ai trouvé :
...
La ponte elle aussi revêt deux aspects :
Les œufs peuvent êtres pondus isolément ou par petits amas lorsqu’ils sont protégés d’une ornementation qui les protège des prédateurs ou bien peuvent être pondus dans la mue de la femelle qui a quitté sa vielle cuticule, si les œufs sont lisses et sans ornementation. On peut alors trouver de 1 à 30 œufs dans une mue.
Certaines espèces ont également tendance à abandonner leurs œufs à l’intérieurs d’objets creux comme des coquilles vides, …
...
Extrait de : Les tardigrades, http://membres.lycos.fr/julbcp/htlm/tard.htm
Amitiés et bravo pour vos observations respectives !
Edit: Sur la photo de Michel et sur l'oeuf à droite, il me semble distinguer déjà le "squelette" typique de la partie antérieure ...
(vous me corrigerez pour "squelette" je n'ai plus les termes scientifiques en mémoire et je ne sais pas si on appel cela aussi trophy ... !)
-
Bonjour à tous,
Excusez moi mais je me sens obligé de réagir suite à votre débat :
(genre : Quand on aime on ne compte pas ses sous, on n’a de limite que celles que l’on s’impose ... Elles dépendent de l’intérêt que l’on a pour la chose, etc, etc ...)
Je suis assez choqué car je trouve ces phrases faites à l'emporte-pièces.
1500 à 2000$ par exemple c'est juste ce qu'il me faudrait (je ne les ai pas encore) pour me payer mes prochains frais de dentiste (et au détriment de ma famille), c'est qu'un début et vraiment pas du luxe si je veux m'alimenter normalement ... :(
Alors oui, on peut économiser pour une passion, mais les obligations et les tuiles existent !
Malheureusement ... car comme vous, j'ai bien des rêves à réaliser en matériel micro-photo (et d'autres d'ailleurs).
Au passage, pour les voyages en Inde, je me sens aussi concerné, j'y ai passé deux ans de ma vie (en deux fois).
Mon premier voyage m'a couté 700 francs suisses (je vous laisse faire la conversion en euros ...)
Comme quoi, tout ceci est bien relatif !
Mais si cela permet de se connaitre un bout de plus alors "why not" comme diraient nos amis anglais.
Amicalement
ps: en Suisse il n'y a aucune couverture sociale pour la médecine dentaire.
(en fait c'est pas considéré par les assurances comme de la médecine à part entière ... trouvez l'erreur ...)
Les pauvres, car il y en a, n'ont qu'à manger de la soupe ou de la fondue les rares jours de fêtes ...
Ceci n'est qu'un exemple et pas le pire en comparaison de cas bien plus lourd, soit dit en passant de plus en plus nombreux ici et ailleurs en Europe.
Pas forcement besoin de faire des raids automobile afriquains pour aider son prochain ...
-
Tu avais bien raison Dominique,
ça change tout !
La lumière blanche restante (en bas la photo) provient malheureusement de la couleur de la paillette.
J'ai bien essayé de la peindre en noir mais je ne voulais pas en mettre plein la fourmi :lol:
J'en tiendrai compte pour les prochaines.
J'ai acheté aussi du carton gris et vert pour voir ...
En tout cas merci encore.
Amitiés
-
Merci Dominique pour ton conseil de pro, il me semblait bien qu'un truc clochait ...
C'est toujours bienvenu lorsque l'on débute dans une expérience :)
Au passage après demande auprès de spécialistes, mes premières photos ne correspondent pas à L.brunneus ...
Comme quoi les clés sont bien pratiques mais faut-il encore savoir s'en servir !
(la détermination des fourmis est très complexe, surtout le genre Lasius ...)
Restons en pour l'instant à Lasius sp. (je pense avoir l'aide nécessaire pour aller plus loin avec celle-ci).
Amitiés
-
Bonjour Pierre, tous,
Merci pour ton message :)
J'ai essayé le calque mais pas avec mes fibres (sur flash ou Led).
C'est pas mal aussi mais je trouve que l'altuglas donne de meilleurs résultats pour peu qu'on aie une source assez puissante.
L'avantage aussi c'est qu'on peut éloigner ou incliner les diffuseurs comme on le souhaite (ou peut aussi les utiliser comme réflecteurs !)
Ici j'ai utilisé du 2.5mm d'épaisseur, je n'ai pas trouvé plus mince mais ça doit exister.
Allez un petit recadrage (env. 1:1) de la dernière pour montrer qu'avec un objectif faible on peut voir des trucs sympa (ou étrange selon les gouts) ...
Amitiés
-
-
-
Salut André, et tous,
Non il n’y avait pas de brouillard :D quoi que le temps ici est affreux …
En fait mon problème c’est de diffuser la lumière pour éviter les reflets et j’ai utilisé un bête mouchoir en papier dans ce but.
Je pense que l’effet escompté est trop prononcé.
Il me semble aussi qu’Helicon renforce le côté brouillardeux de l’image … (j’ai oublié de signaler son utilisation)
Aujourd’hui j’ai bricolé des diffuseurs avec du plexiglas blanc opaque (genre altuglas).
On verra si j’arrive à mieux (je test tout ça ce soir ou demain).
Amitiés
-
Bonjour à tous,
Suite à mes questions posées ici http://forum.MikrOscOpia.com/index.php?showtopic=6165
j’ai trouvé à peu près tout ce que j’avais besoin pour démarrer mes essais (merci encore).
Pour euthanasier j’utilise du dissolvant pour vernis à ongle (sans acétone) dont le composant principal est l’acétate d’éthyle, bien connu des entomologues.
Un petit bout de coton imbibé de solvant est disposé dans un bocal en verre puis l’insecte y est déposé.
Ce protocole est très rapide, l’insecte s’endort puis meurt très rapidement en gardant sa souplesse.
Ensuite il ne faut pas attendre trop longtemps avant le montage car les membres durcissent et il devient impossible de les mettre en place sans dégâts … (à moins de ramollir l’ensemble).
Voici donc quelques images de mes premiers essais.
Il y en aura certainement d’autres au fur et à mesure des mes tentatives (comme les montages sous lamelles par exemple).
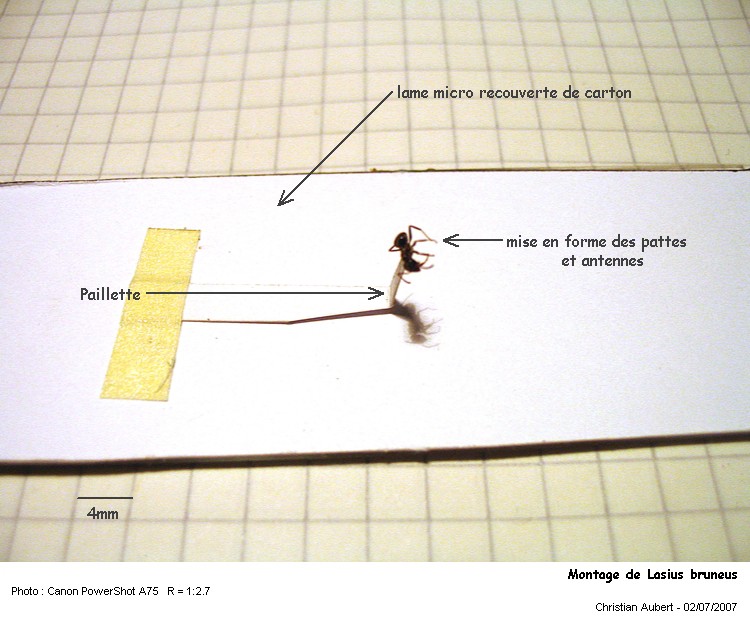
Lasius brunneus est une petite fourmi de nos régions tempérées.
(j'ai utilisé la clé du forum Acideformik pour sa détermination : http://photos.fourmis.free.fr/clef.php )
Sa tête et son thorax sont brun-roux, son gastre est brun-noir, les ouvrières mesurent env. 2.5 - 4 mm de long.
Mon spécimen provient d’une colonie vivant au pied d’un buisson dans de la terre un peu sablonneuse.
(sur les photos j'ai indiqué L.bruneus, il faudrait y lire L.brunneus ... désolé)
Collage de la fourmi sur une paillette.
Mise en forme sous la bino à l’aide de pinceau fin et d’aiguilles emmanchées.
(c’est le plus difficile !)
Une vue au 2.5x
Eclairage réalisé par deux fibres optiques (150w) avec diffuseurs bricolés (mouchoir en papier)
Je dois encore travailler l’éclairage, les fourmis sont foncées et les reflets parasitent très vite les détails …
La même recadrée
Remarquez que tous ses poils sont dirigés vers l'avant ... on a réellement l'impression qu'elle s'est coiffée :D
Il faut faire très attention aux poussières et ranger au plus vite à l'abri après observation !
Amitiés
-
Bonjour Claude,
J'avais complètement oublié que ce domaine est ton dada !
Je te contacterai par MP si cela ne te dérange pas ...
Amitiés
-
Bonjour Daniel, tous,
Merci de ton aide.
J’en suis arrivé à peu près aux même conclusions hier soir en faisant plusieurs recherches sur les forums d’entomologie.
Tu confirmes donc tout cela.
Visiblement je ne peux pas échapper à un travail de remise en place des pattes et des antennes de ma fourmi.
Il y aurait aussi un autre protocole : Pour l’euthanasie la congélation (comme je l’avais fait)
La fixation dans de l’AGA (alcool glycériné acétique) puis la mise en place et le séchage.
(Ou encore la mise en place directement après la décongélation et un séchage contrôlé)
Pour la suite, c.à.d les montages destinés à la microscopie, j’ai réuni pas mal de doc (dont l'excellent article de jean ;) )
De toute façon, c’est surtout l’expérience qui va me manquer !
Enfin comme tu dis, c'est un vrai travail de fourmi …
J’espère avoir le temps de le réaliser cet été.
Amitiés
-
Bonjour Dominique et Jean,
Merci pour vos réponses.
J’avais essayé (il y a déjà un certain temps) l’alcool sur un insecte, mais à 70°.
L'insecte s'était rétracté.
Il faudrait que je refasse un essai avec une fourmi et du 95° mais j’ai quand même quelques doutes car celles-ci sont très résistantes … !!!
(elles ont donc le temps de se rétracter en mourant).
Un autre problème, l'alcool fort, 95° et plus, décolore et rend cassant les sujets traités !
J’avais lu une fois (je ne sais plus où, Séguy ou autres ?) que l’on pouvait euthanasier avec un tampon d’ammoniaque ou d’éther dans un récipient …
Avez vous déjà essayé cette méthode ?
(je vous rappel que mon but n'est pas de tester tout les produits qui me tombent sous la main et de sacrifier inutilement de nombreuses fourmis :( )
Vous vous demanderez peut-être pourquoi je ne me satisferais pas d’une vue macro de fourmi vivante ?
En fait plusieurs projets sont liés à ce spécimen fixé *
Un de ceux-ci serait une animation à 360° autour de l’insecte.
* Attention : Fixé dans le sens euthanasié en extension
J'ai des formules pour de vrais fixateurs ...
Amitiés :)
Et pour la route :
-
Bonsoir à tous,
Je dois préparer un ou deux spécimens de fourmis (en principe Lasius niger) pour différentes études.
(Je n'ai quasiment aucune expérience avec ce milieu en microscopie )
La première étape (importante) serait de fixer un spécimen complet en extension afin d’en tirer quelques prises de vues générales + détails (macro et super-macro).
J’ai essayé le grand froid (congélation) mais l’insecte a le temps de se rétracter (en fait j’aime pas du tout faire ça…)
Comme je ne tiens absolument pas à sacrifier de nombreuses bestioles je vous demande de l’aide :
Auriez vous un protocole rapide, qui garderait l’insecte (entier) en extension ?
Est-ce possible ?
La suite serait un traitement de différentes parties (passage à la soude) et un montage comme lu dans les articles de Jean .
http://www.microscopies.com/DOSSIERS/Magaz...ep-insectes.htm
Merci d’avance
-
Bonjour,
A propos de la tranchette (ou du mésotome) :
Je fais plutôt partie de ceux qui ont été déçu par ce système ...
Sauf pour les coupes longitudinales de tiges végétales (quoi que … )
Avec les végétaux, les coupes à main levée sont tout aussi bonnes voir meilleures, il suffit d’utiliser la technique dite "JHA" (cf Joyeux hachis d’André) et de sélectionner les plus fines !
Voir aussi ici : Les coupes à main levée http://forum.MikrOscOpia.com/index.php?showtopic=4355
De toute façon, avec ces méthodes, il ne faut pas s'attendre à avoir une coupe de 4mm de diamètre exploitable sur toute sa surface !!!
Le but ici est d'observer que les parties assez minces et intéressantes.
En revanche pour les tissus mous (champignons par exemple) la tranchette aura certainement plus d’avantages.
Pour ma part, dans cette situation (mais non champignonesque), je suis les conseils d'un article de Marcel Lecomte (Champignon Passion) en enrobant l’échantillon dans du PEG et coupe soit à main levée soit au Ranvier.
Mais le meilleur moyen pour se faire une idée, c'est d'essayer et peut-être insister ?!
En tout cas merci d'avance de nous présenter vos résultats :)
Amitiés à tous
-
Bonsoir à vous,
Excusez-moi de dévier un peu, mais puisque l’on parle de différents media à haut indice de réfraction :
Je possède du benjoin (du Siam) brut (et d’autres résines comme de la Sandaraque par exemple).
Je les utilise soit pour mes vernis soit comme parfum (en les brûlant) .
Le benjoin, appelé aussi Storax ou Styrax (!) est tiré d’un arbre de la famille des Styracacées.
Mais on appel aussi Styrax (ou Baume du Pérou), la résine du Liquidambar, arbre de la famille des Hamamelidacées.
Alors ma question :
En microscopie, de quel Styrax s’agit-il ?
Du benjoin ou du liquidambar (ou encore d'une formule secrète) ?
Pour infos, le Styrax synthétique => styrène => polystyrène :rolleyes:
Merci de m’éclairer
Amicalement
PS pour Jean :
Je pense que tu peux sans autres diluer ton Zrax au xylène.
Pour ma part j’avais reçu du Naphrax (Brunel) sous forme quasi solide, je l’ai dilué mais il m’a fallu être très patient (plusieurs jours voir semaines).
Je l’ai remué tous les premiers jours, puis malaxé, puis franchement dilué.
On peut accélérer la dissolution en chauffant très légèrement (hors flammes bien sûr).
Ensuite il faut le laisser reposer un certain temps afin que les bulles remontent.
Finalement j’ai obtenu un medium de bonne consistance :)
-
Bonjour à tous,
La Prêle (fam. des Equisétacées) nous fait rappeler une période très lointaine :
Les prêles sont apparues au Dévonien (-408 à -355millions d'années) avec une diversité très importante au Carbonifère.
Imaginez qu'à cette époque, ce végétal pouvait atteindre plus de 10 mètres de hauteur …
Nous avons tous vu cela sur de magnifiques planches ou dessins, à l’école ou encore au musée, mais admettez que certaines espèces sont vraiment solides et traversent le temps d’une manière époustouflante !
Il y aurait nombre de choses à dire sur la prêle, particulièrement dans les utilisations que l’homme en a fait ou en fait encore.
Classiquement, on groupe les prêles avec les fougères, dans la division des Ptéridophytes.
(bien qu’en classification phylogénétique il y aie de nouveaux affinements)
Quelques noms communs : Prêle des champs, Prêle commune, Queue de cheval, Queue de rat, Queue de renard.
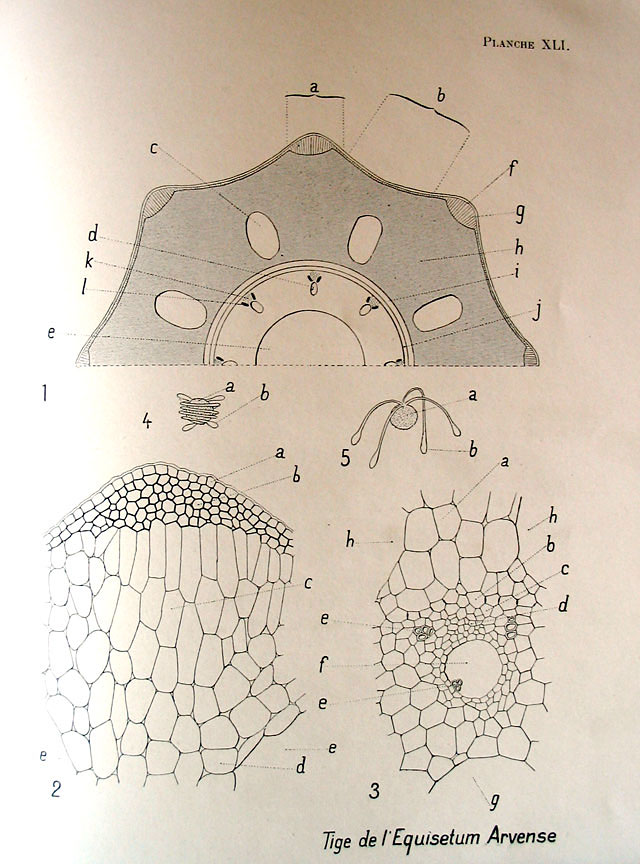
Sur la planche ci-dessous, vous voyez:
A gauche, une tige (axe) chlorophyllienne et stérile
A droite un axe fertile. Cet axe et ses spores (5) ont été présenté par André ici :
http://forum.MikrOscOpia.com/index.php?showtopic=2243
Pour ma part, c’est l’axe chlorophyllien que j’ai coupé (cf note sur la planche).
1 :
J’aimerais vous faire profiter du travail de nos ancêtres et leurs magnifiques dessins d’observations.
Ici une planche tirée de : Atlas de botanique microscopique, Coupin, Jodin et Dauphiné (éd. Vigot 1908)
J’utiliserai les mêmes termes et renvois pour la suite.
2 :
Une première vue d’ensemble, ici sans aucun traitement (coupe, et montage au chloral lactophénol)
Les cavités de la tige sont des critères déterminants (prêle des champs, des marais, etc …)
Ici on observe 14 lacunes valléculaires et carénales, une lacune centrale de taille moyenne.
3 :
Après un protocole complet de montage, coloration Safranine et Vert intense, Baume du Canada.
(Malgré un long bain, mon Dakin utilisé pour la destruction cellulaire est très fatigué, donc vous verrez par la suite beaucoup de "restes" !)
La coloration rouge (safranine) ressort peu sur cette vue.
4 :
Collenchyme et parenchyme palissadique (chlorophyllien)
A : Sans trop de destruction cellulaire (la tige a quand même passé quelques heures dans l'alcool !)
on observe bien la partie chlorophyllienne
B : Après coloration
(la safranine colore en rouge le collenchyme, le parenchyme est partiellement vidé de son contenu (cf Dakin usé !) )
Le collenchyme joue son rôle de renforcement des carènes (nervures) de la tige.
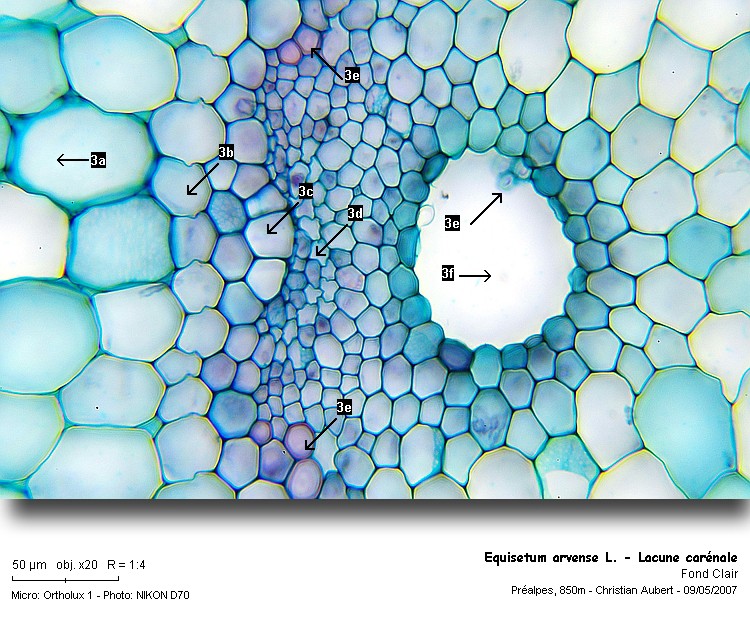
5 :
Une des 14 lacunes carénales
6 :
Vue annotée (se référer à la planche de Coupin en début d’article, fig.3)
-
Bonjour à tous,
En complément du sujet d’André ici :
http://forum.MikrOscOpia.com/index.php?showtopic=2499
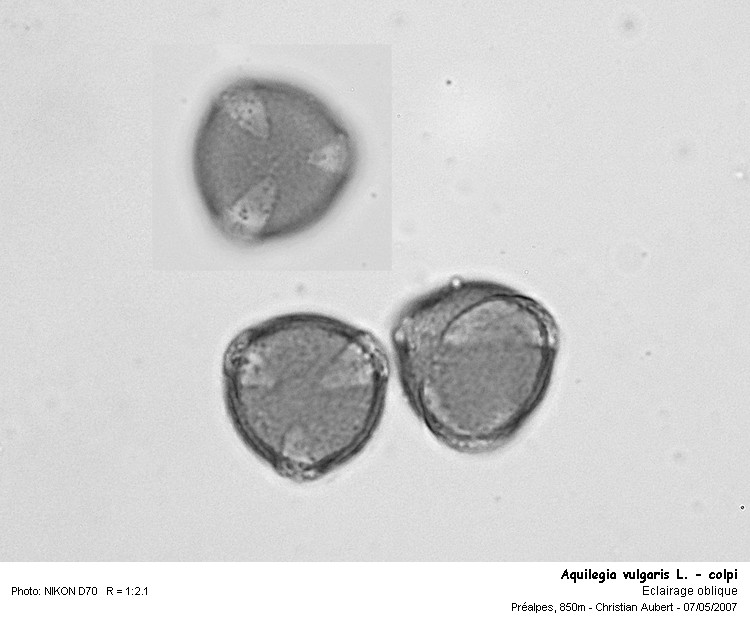
voici une Ancolie vulgaire (renonculacées) de couleur mauve-rose (claire)
Les Ancolies ont tendance à s'hybrider facilement, celle-ci est aussi une variété sauvage.
Assez proche de ce spécimen (à une vingtaine de mètres) se trouvait un autre groupe d’Ancolie, bleu-violet comme celles d’André.
Noms vernaculaires :
Gant de bergère ou gant de Notre Dame , aiglantine, clochette, cornette, etc....
(les pétales se terminent, vers l'arrière, par un éperon parfois crochu rappelant un doigt de gant)
Une vue depuis dessous (les petits APN sont très utiles pour cela !!!)
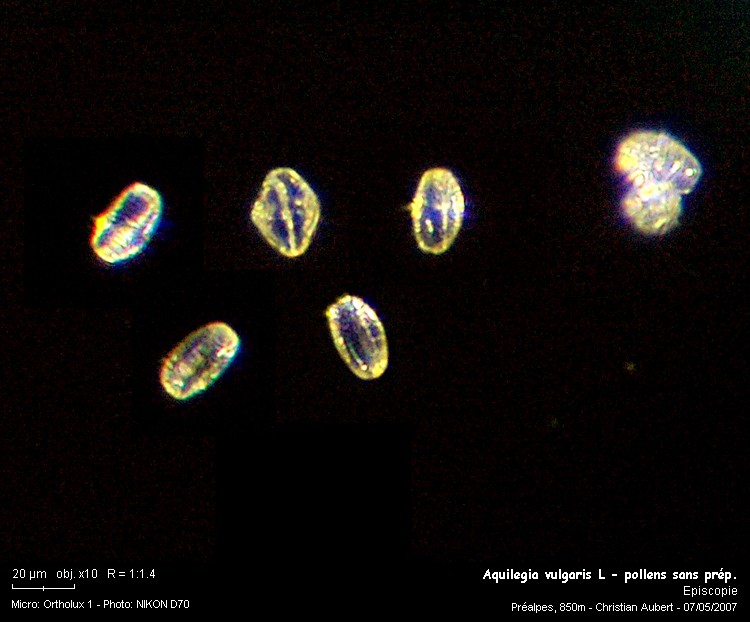
1 :
Une première photo pour avoir une mesure à l’état naturel.
Les grains mesure environ 27 x 16 microns.
2 :
Après préparation : Montage et coloration, glycérine gélatinée + Fuscine basique
Deux grains avec focalisation sur les bords.
Nous observons que les grains sont tricolpés.
Diamètre = env. 22 microns
3 :
Mise en évidence des colpi
4 :
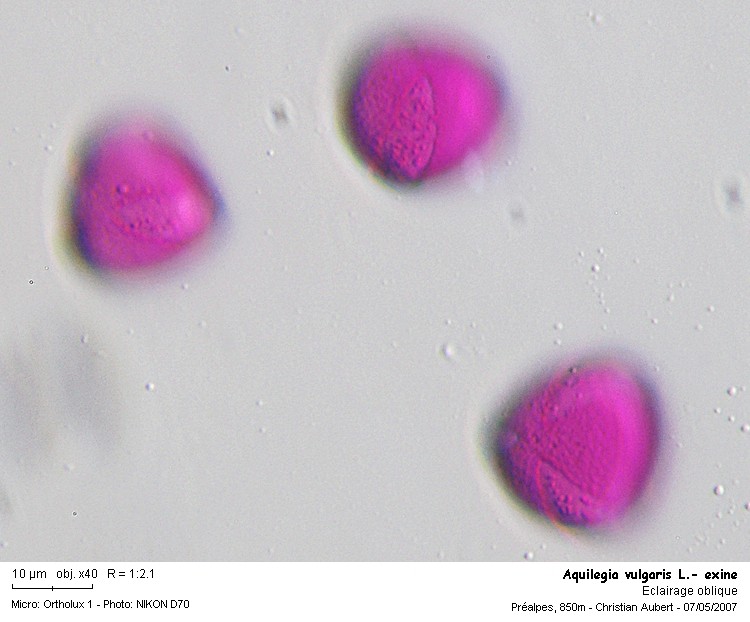
Focalisation à la surface de l’éxine.
Celle-ci est finement granuleuse (avec des granulations plus prononcées sur les colpi)
-
Bonsoir Gérard,
Dominique et tous,
C’est vrai que vu de cette manière c’est assez surréaliste :lol:
C’est d’ailleurs la vue de notre société du tout ou rien …
Toutes ces "nouvelles" énergies peuvent être couplées, et là l’efficacité peut commencer.
Amitiés
-
Bonjour à tous,
Salut Dominique,
Alors tu sais ce qu’il te reste à faire, rouler aux diatomées et concurrencer les huiles Mc-Do like … :P
Plus sérieusement, deux liens que j’ai trouvé intéressant :
http://www.spectrosciences.com/article.php3?id_article=26
http://www.techno-science.net/?onglet=glos...definition=3412
Et particulièrement ceci :
Pour atteindre un rendement optimal les algues ont besoin de C02 en grande quantité dans les bassins ou les bioréacteurs. Ces derniers doivent donc être couplés à des centrales thermiques classiques productrices d’électricité (centrales au charbon par exemple) et qui rejettent du CO2 avec une teneur moyenne de 13 %. Le CO2 est mis à barboter dans les bassins et est assimilé par les algues. Il s’agit donc d’une technologie permettant de recycler le CO2 (bio-séquestration). C’est en ce sens qu’elle constitue une avancée dans le domaine environnemental, même si le CO2 produit par les centrales sera malgré tout libéré dans l’atmosphère lors de la combustion du biocarburant obtenu dans les bus ou les voitures.
Amitiés
-
Bonjour à tous,
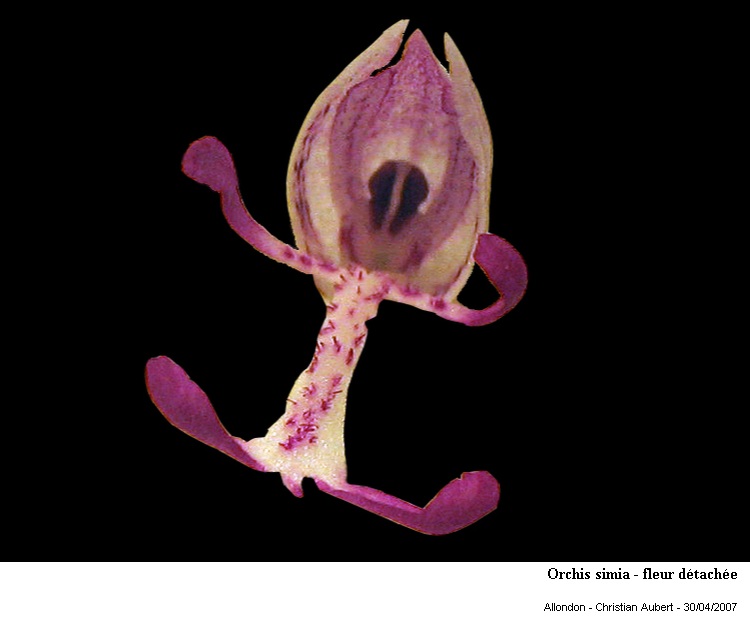
Orchis simia (ou orchis singe) est une jolie petite orchidée (Orchidacées) des prairies sèches.
Elle ressemble à Orchis militaris mais s'en distingue par les deux lobes du lobe médian du labelle qui sont aussi étroits que les lobes latéraux.
D'autre part la floraison commence par le haut de l'inflorescence alors qu'elle débute par le bas chez Orchis militaris.
Mon spécimen mesure une quinzaine de cm de haut.
Lorsque l'on voit la fleur de face, elle ressemble vraiment à un petit singe (ou un bonhomme) d'où son nom.
Pour cette étude je me suis inspiré du travail d'André ici :
http://forum.MikrOscOpia.com/index.php?showtopic=463
J'ai prélevé délicatement une seule fleur.
Drôle de petit bonhomme !
photo 3
Passons à la dissection (sous la loupe bino) :
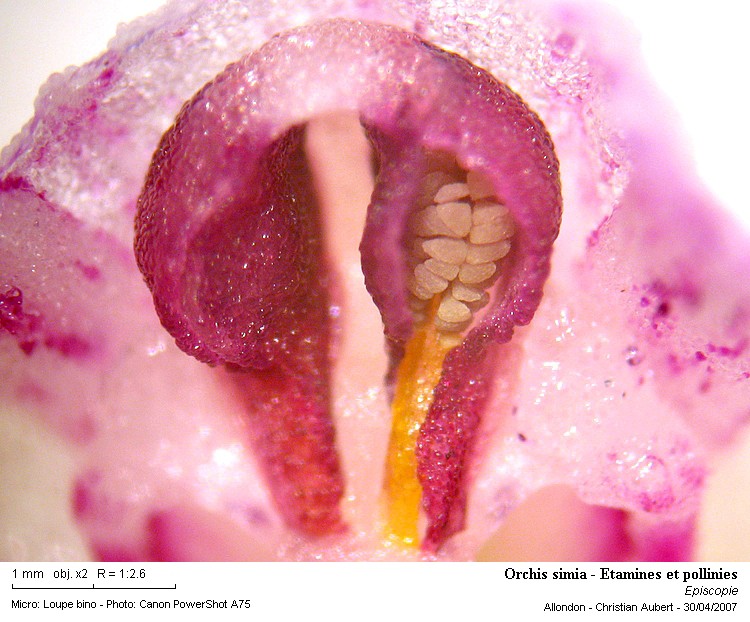
Ici j'ai coupé le casque de la fleur pour accéder aux pollinies.
Ensuite une simple touche avec une aiguille déchire immédiatement l'anthère et dévoile ici une (des deux) pollinie.
Il faut ensuite retirer très précautionneusement la pollinie, celle-ci est minuscule !
Photo 4
Important, de la mousse (bave) s'est développée entre les deux pièces (haut de la photo)
Ces dernières sont en réalité bien séparées !
(je m'en suis rendu compte trop tard pour l'enlever)
l'échelle est approximative
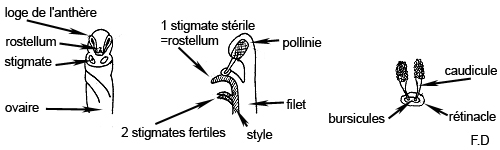
Morphologie des organes sexuels (orchidées)
http://perso.orange.fr/flore.montagne/orchidees.htm (lien très intéressant !)
Planche 5
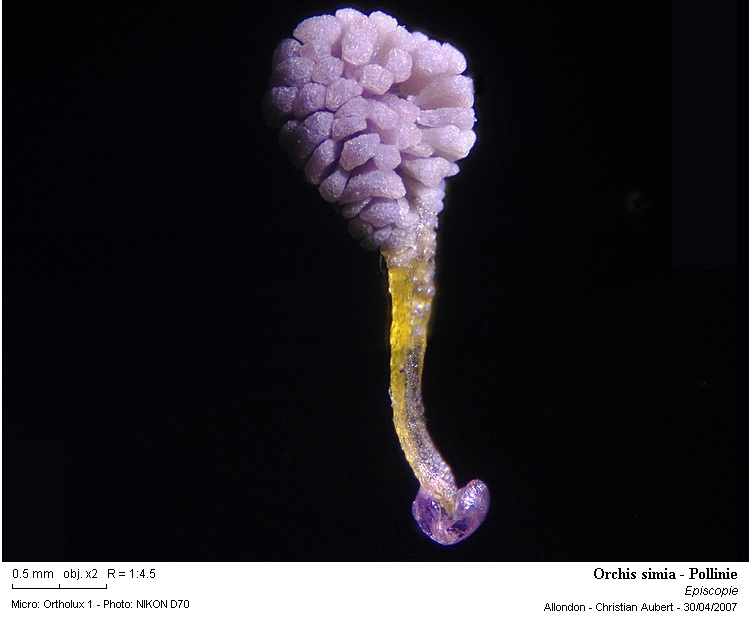
Voici maintenant une pollinie entière au microscope, objectif faible.
(photo Helicon et mosaïque de deux images)
La base de la pollinie est très gluante, le but étant de se coller aux insectes pour le transport du pollen (de la pollinie).
Photo 6
(l'échelle est approximative)
Pour la suite, voici mon protocole :
Pose de la pollinie sur une lame, bain d'alcool 70° et dilacération légère de la pollinie dans celui-ci.
Bain de liquide glycériné
Montage à la GG + fuscine basique en écrasant un peu la préparation.
Une première photo.
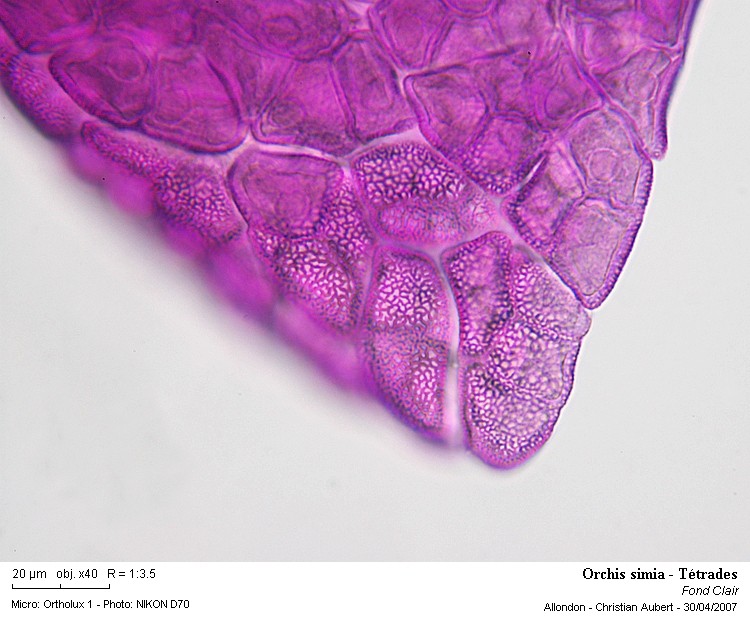
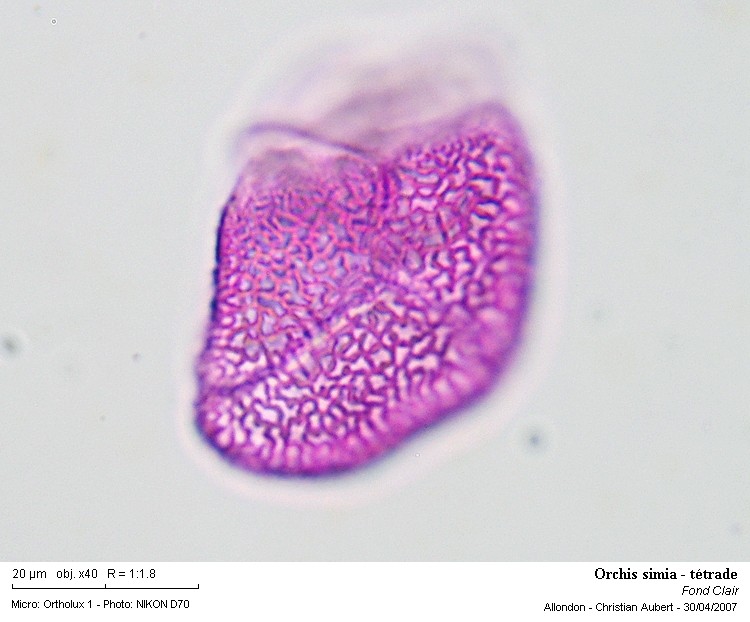
Il s'agit ici d'un bord d'un des "petits sacs" de la pollinie (lobules) que l'on pouvait observer sur la photo 6
Les tétrades sont bien visibles.
Celles-ci sont fortement réticulées !
Photo 7
Photo 8
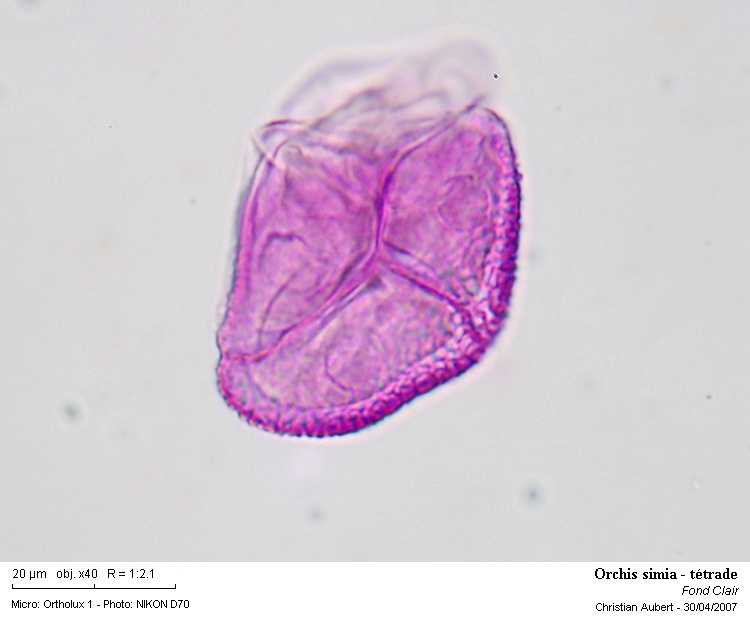
Une tétrade isolée
On peut observer quelque chose qui ressemble à des noyaux ?
Photo 9
Une focalisation sur l'éxine
J'espère n'avoir pas trop fait d'erreur dans l'utilisation des termes, André me corrigera si nécessaire !
Amitiés à tous
Lexique :
Tétrade
Le pollen est libéré à l' de tétrades quand, une fois formés, les grains de pollen sont disposés en quatre paquets correspondant à la disposition tétraédrique des quatre méiospores.
L'anthère
est la partie terminale de l'étamine, organe mâle de la fleur, qui produit et renferme le pollen.
-
Re bonjour,
Comme j’aime bien expérimenter et que je voulais me faire une idée précise,
je viens de réaliser le test suivant :
Coupe d’une tige de tulipe
Protocole complet (dest. cellulaire, coloration, rinçage alcool 75°)
Passage à l’alcool isopropylique
-Bain d’essence de Bergamotte
-Bain d’essence de Girofle
Montage au (vrai) Baume du Canada
(parallèlement, j’ai monté 2 lames de manière "traditionnelle" au xylène )
Première constatation : Il n’y a aucun flou dans le baume, donc j’imagine que ma préparation est complètement déshydratée et que mon essence de girofle se mélange bien au baume … ?!
Maintenant il faudra voir ce que cela donne dans le temps … surtout avec mes colorants (safranine et vert intense)
Je vous posterai des photos plus tard.
Amitiés
-
Bonjour à tous,
Merci Yvan et Nicolas pour vos messages.
Je suis finalement assez déçu …
Je pensais avoir trouvé une bonne méthode pour éviter les produits qui puent (et sont dangereux) :huh:
Donc, ce que je retiens de vos messages :
Les substituts (comme l’Histoclear) fonctionnent bien lors d’inclusion dans la paraffine mais pas comme un passage intermédiaire (fin de déshydratation) entre l’alcool et le (vrai) Baume du Canada … ?!
et l'odeur est désagréable.
Amitiés
-
Bonsoir à tous,
Merci Jean-Marie d’avoir recentré le sujet.
Alors si vous avez des infos pratiques à communiquer, je serai le plus heureux des modérateurs (sans masque à gaz) !
Amitiés
-
Salut **,
100% d’accord avec toi sur les sources parfois (souvent) douteuses du web !
Tu m’avais parlé de l’acétone comme substitut du xylène, c’est certainement ok, mais moi mon problème c’est que je ne supporte plus ces odeurs de solvants !!!
(je travaille beaucoup (de trop) avec des vernis)
Donc si je peux trouver un moyen de moins m’en prendre plein la tronche chez moi, je préfère
Ce que j'aurais aimé avoir comme infos ici, c'est une expérience pratique de ces alternatives.
(et si possible sur le long terme puisqu'il s'agit de préparations permanentes)
Amitiés à toi























Montage entomologique
dans - Préparations microscopiques
Posté(e) · Modifié par Christian Aubert
Bonjour à tous,
Pour déterminer les formicidés, surtout lorsque l’on arrive à l’espèce, la présence, l’emplacement des poils hérissés et leur nombre sont indispensables
(encore des poils sur le forum ... c'est récurrent :D )
Ici j’ai réalisé quelques essais avec ma loupe stéréo d’entrée de gamme (Novex AP5) et un petit APN (Canon A75).
Je ne suis pas trop mécontent du résultat vu le matériel utilisé.
Ce spécimen (fourmis des bois) est en cours de validation, donc "cf" pour "probablement"
Amitiés à tous
(Helicon Focus 5 images)