-
Compteur de contenus
2 142 -
Inscription
Messages posté(e)s par Christian Aubert
-
-
Bonjour à tous,
Salut J-M,
Les systèmes de mise sous vide sont à utiliser dans des cas bien particuliers (inclusion par exemple), couramment on en a pas besoin.
Comme tu le disais, un trempage dans le liquide glycériné (1/3 eau-1/3 alcool-1/3 glycérine) avant montage dans la GG est suffisant la plupart du temps.
Personnellement, dans ce bain, et pour plus d'efficacité, je tapote doucement mes coupes avec un pinceau fin (bien mouillé de ce liquide) pour faire éclater les bulles plus rapidement.
Mais dans les cas difficiles :
En utilisant une plaque chauffante (comme celle de ton article par exemple) on peut encore supprimer les dernières bulles emprisonnées dans la préparation avec l’aspivenin et son embout (ou autres systèmes) directement sur la lame, ce qui est assez pratique.
Je n'ai pas encore réalisé de test après la pose du couvre-objet, ceci pourrait être intéressant...
Amicalement
Chris
-
Bonjour Florent et Michel,
Donc question à JMC et toute personne ayant déjà utilisé sa technique : n'as-tu jamais ce genre de problème avec les préparations réalisées de la sorte ?J’utilise aussi l’alcool faible avant montage, ceci avec succès.
(j’utilise aussi une autre méthode, je fais tremper ma coupe dans un mélange eau-alcool-glycérine avant montage à la GG, cela donne de bons résultats.)
On trouve d’ailleurs ce genres de conseils dans passablement d’ouvrages sur l’histologie végétale.
Pour les techniques de mise sous vide, je suis en train de plancher sur différents systèmes.
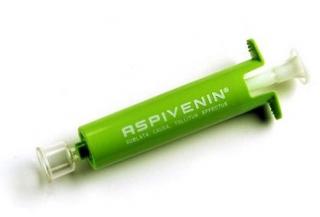
Le premier est le plus simple pour moi car je possédais déjà l’appareil qui est un Aspivenin
(au passage très efficace pour les piqûres de guêpe)
Je n’ai pas encore eu le temps de réaliser des photos mais il suffit d’ajouter un tuyaux entre la seringue et l’embout, de manière à ne pas casser la lame en appuyant trop fortement l’embout autour de la préparation (directement sur la lame).
http://www.aspivenin.com/french/main.html , environ 18 euros
Une autre solution : une petit récipient à vide facilement bricolable s’il le faut.
www.pierron.fr env. 19 euros
Et enfin une cloche à vide (avec pompe manuelle intégrée) que je prévois d’acheter bientôt car elle peut rendre d’innombrable autres services
www.pierron.fr env. 69 euros
Amitiés à tous
Chris
-
Bonjour à tous,
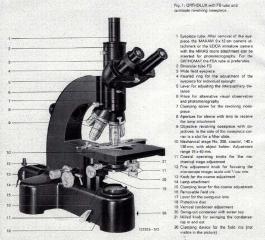
Voici une présentation sommaire de ce magnifique microscope des années "60" : L’Ortholux I ou encore Ortholux "Noir".
Tout d’abord un lien pour ceux qui recherchent un mode d’emploi et de la documentation pour l’Ortholux 1 :
http://www.science-info.org/micro/docs/leitz/
(lien donné par Trichloréthylène ici : http://forum.MikrOscOpia.com/index.php?showtopic=2726 )
Une première photo pour situer l’époque, admirez la coupe …de cheveux :lol:
(je trouve cette photo fantastique, les années 60 sont ma petite enfance !)
La configuration de base (trino), fond clair
(désolé pour la non traduction de la légende, c’est toujours possible plus tard …)
Avec ce microscope j’ai eu la chance d’obtenir un support (d’origine) qui permet d’ajouter d’autres sources de lumière.
Il s’agit d’une boîte de dérivation composée de deux miroirs, un semi-transparent et un miroir conventionnel.
Lorsque la tirette est levée, deux sources différentes peuvent être utilisées en même temps, dans le cas contraire seul l’éclairage de base est utilisé.
En principe ce support accueil une boîte à lumière puissante (100w ou plus) mais cet emplacement est très pratique pour l’utilisation d’un flash (éclairage de Köhler non vérifié !)
Système Ortholux
Condenseur Heine
Lors d’un achat de microscope inversé, j’ai eu la chance d’obtenir en bonus cet ensemble contraste de phase Leitz, (système de Heine).
Un bien beau cadeau !
Le système selon Heine diffère du système "Phaco-Zernike" (anneaux amovibles) par la possibilité de passer de façon continue du fond clair - contraste de phase - fond noir (+ toutes positions intermédiaires)
Ici le condenseur, et posé à côté, sa calotte pour immersion.
Cet ensemble comprend aussi :
-Une loupe de mise au point Wild (ou lunette de centrage)
et des objectifs Leitz : (de gauche à droite)
-Pv Fl Oel 70/1.15 h (170-0.17)
-Pv Apo Oel 90/1.15 h
-Pv Apo Oel 90/1.15 n
-Pv Apo Oel L63/0.70 n (170/0.11-0.23)
-Pv Apo Oel L40/0.70 n (170/0.11-0.23)
Pv = contraste de phase Heine (caractères en rouge sur les objectifs)
n : objectifs à anneau de phase à absorption normale (75%)
h : objectifs à anneaux de phase à absorption renforcée (hight, 88%) pour voir des objets microscopiques dont l’indice de réfraction est très proche de celui du milieu d’observation.
-h : idem mais en contraste de phase négatif.
Les objectifs "Phaco" sont compatibles avec le condenseur de Heine car on peut régler progressivement l’anneau avec le miroir annulaire du condenseur.
(comme je possède maintenant une lunette de centrage, j’ai pu vérifier ceci précisément)
En revanche, les objectifs "Pv" ne sont absolument pas adaptés aux anneaux de mon condenseur phase (Phaco) à tourelle ...
Voir aussi :
Mode d'emploi du Heine, Français (numérisé par mes soins - taille 1Mo)
http://www.microscopie.ch/microscopie/equi...mploi_heine.php
et pour une doc plus complète mais en anglais :
http://www.science-info.org/micro/docs/leitz/LeitzHeine.pdf
Vous pouvez obtenir d'autres informations directement sur mes pages personnelles :
-
Bonjour à tous,
Comme nous sommes en période de fructification et de dissémination végétale, je vous propose une petite étude anatomique de graines de Ricin Carmencita (Ricinus communis « Carmencita » )
Le ricin fait partie des Euphorbiacées, c’est une vivace herbacée à souche ligneuse, originaire d’Afrique tropicale (elle est vivace sous les tropiques et cultivée comme annuelle chez nous).
Sa hauteur atteint 1m 50 à 3 m en une année. (jusqu'à 10 m dans son pays d'origine)
Les graines (et les feuilles) contiennent des substances très toxiques dont la ricine, la cyanine et de l'acide cyanhydrique, mais on en extrait une huile purgative non toxique qui était autrefois utilisé aussi comme huile de combustion.
(Si vous voulez réaliser des coupes, on en trouve facilement chez les grainiers ou dans les jardineries)
2.
Ci dessous quelques clés de réflexion pour les graines en général …
Elaboration, déshydratation :
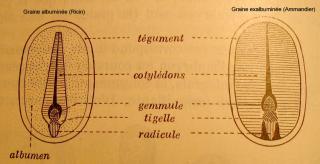
La maturation de la graine correspond à une période d’élaboration très intense de réserve dans l’albumen et/ou dans les cotylédons
A maturité, il existe des graines albuminées (ricin, …) et des graines exalbuminées (haricot, amandier …)
Cette période s’achève par une déshydratation active du protoplasme : <span style='color:blue'>Les vacuoles disparaissent et les protéines se rassemblent en grains d’aleurone</span>.
La teneur en eau des tissus chutent en moyenne de 90% à 10%. La déshydratation s’accompagne d’un très fort ralentissement de l’activité physiologique, la graine entre en vie ralentie.
Résistance et longévité :
La graine à maturité présente une capacité de résistance exceptionnelle aux environnements défavorables
Sa longévité est d’autant plus grande que la déshydratation est forte et les téguments (écorce de la graine) sont imperméables.
Suivant les espèces elle va de quelques semaines à dix - vingt ans (la majorité), elle atteint parfois plusieurs siècles (nélombo) !
Evolution :
Le mode de développement de la graine est à rapprocher d’un type de reproduction par viviparité (nous !), en effet, d’une part , la nutrition du nouvel individu est assurée à l’intérieur même de l’organisme maternel et d’autres part, les matériaux nutritifs ne sont accumulés que si la fécondation a effectivement eu lieu.
Ce mécanisme constitue un progrès net sur l’oviparité qui se caractérise par une élaboration de réserves précédant la fécondation (c.à.d avec le risque de perte des substances élaborées si un gamète mâle n’atteint pas l’oosphère).
Les graines constituent une forme de dissémination et de colonisation sans équivalent.
Extraits et synthèse de : Biologie végétale (2) J-C Roland et F.Roland et de Biologie Végétale, A.Guilliermond et G.Mangenot
3 :
Pour continuer, une vue macro d’une graine de Ricin avec plan de coupe.
Cette graine est très utilisée en histologie végétale pour démontrer la présence de grains d’aleurone, d’huile, et les différents moyens de les mettre en évidence.
Elle possède aussi des propriétés particulière.
Ces coupes transversales ont été réalisée à main levée (rasoir 2 faces concaves) il faut bien sûr en obtenir de très fines.
(J’ai enlevé le tégument avant la coupe, celui-ci est très dur et nous sera d’aucune utilité ici).
Inutile aussi d’essayer de faire un coupe complète à main levée, une petite partie est suffisante.
4 :
Contrairement aux coupes en général, il n’est pas indispensable (même déconseillé dans notre cas) d’humecter le rasoir et l’objet.
En effet le Ricin contient beaucoup d’huile.
Il faut pour observer ces coupes sans trop de déformations les monter dans la glycérine.
On peut aussi observer les coupes dans l’eau dont l’influence destructive ne se fait sentir que peu à peu, à mesure que ce liquide déplace l’huile qui imprègne le protoplasme des cellules mais il vaut mieux commencer par la gycérine.
Différentes méthodes de mise en évidence seront abordées ici.
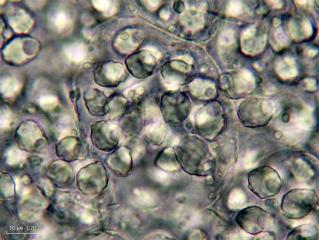
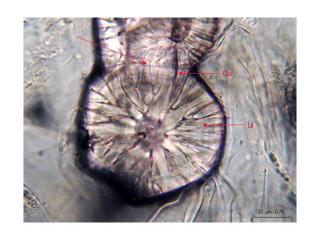
Ici une vue à l’objectif 40x, dans l’albumen, nous montre une cellule (on devine les parois) remplie de grains d’aleurone et de substance fondamentale huileuse.
Cette cellule mesure env. 66 x 47 um, les grains d’aleurone varient, 7-9 um x 10-13 um
5 :
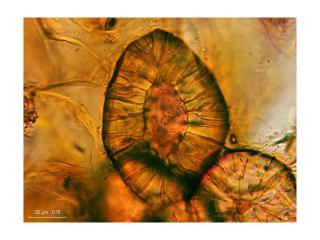
Toujours dans la glycérine et sans autres traitements, un grain isolé, à l’objectif 100x.
On remarquait déjà sur la photo précédente une texture particulière de l’enveloppe du grain (réticulé ?) mais ici c’est évident.
On peut aussi observer sur cette photo un corps sphérique dans le grain d’aleurone : Il s’agit d’un globoïde, nous y reviendrons plus loin.
Comme déjà abordé dans le 2ème post, primitivement, dans la première ébauche de la graine, ces cellules contiennent chacune une ou plusieurs grandes vacuoles fluides.
Quand survient la déshydratation, ces vacuoles sont partagées en éléments plus petits qui se fragmentent à leur tour en vacuoles plus petites encore et souvent filamenteuses, en même temps que s’accumulent à l’intérieur des substances protéiques élaboré par la cellule.
Ce double processus de déshydratation des vacuoles et de dépôts de protéides à l’intérieur se poursuit peu à peu et s’achève par leur solidification : Chaque cellule de l’albumen et de l’embryon d’une graine mûre contient ainsi plusieurs vacuoles déshydratées, offrant l’aspect de grains ovoïdes ou globuleux et appelées grains d’aleurone.
Sources : B.végétale, A.Guilliermond et G.Mangenot
6 :
Appliquons maintenant un autre protocole.
Ici j’ai mélangé dans un verre de montre 3 gouttes de glycérine et une goutte de Lugol 3%.
J’ai immergé ma coupe environ 5 minutes dans ce mélange (glycérine iodée)
L’enveloppe du grain d’aleurone devient plus transparente et laisse apercevoir des inclusions à contour polygonal, d’aspect cristallin.
On les nome cristalloïdes, ceux-ci sont formé comme la matière fondamentale de protéides (albumine entre autres).
Il ne s’agit pas de cristaux d’oxalate (mais certaines graines en contiennent), un test à la polarisation nous montre qu’il n’y a aucun phénomène lumineux sur ceux-ci.
Accolé à ces cristalloïdes on observe aussi un corps sphérique, c’est nos globoïdes.
Le grain d’aleurone de ricin peut en contenir un ou deux.
Ces inclusions sont constituées par un ester phosphorique d’un polyalcool cyclique, l’inositol, les restes d’acides étant combinés à du magnésium et à du calcium.
Ce corps complexe, réalisé synthétiquement sous le nom de phytine, est d’un emploi courrant en thérapeutique.
Objectif 40x
7 :
Une vue au 100x, toujours dans la glycérine iodée.
Inclusion de globoïdes et de cristalloïdes dans deux grains d’aleurone.
8 :
Ces cristalloïdes montrent généralement une forme de losange (souvent avec pointe tronquée) , suivant leur position on peut aussi en observer de forme triangulaire (planche, h.g.)
Obj.100x, glycérine iodée.
9 :
Quelques propriétés du Ricin.
Alcool :
Si on fait pénétrer de l’alcool absolu sous la lamelle, la préparation s’éclaircit, les cristalloïdes apparaissent plus nettement.
Après un temps plus ou moins long, les gouttes d’huile disparaissent peu à peu.
En effet, à l’encontre de la plupart des autres huiles, <span style='color:blue'>l’huile de Ricin est soluble dans l’alcool</span>.
Eau et acide acétique :
Sur cette vue, après une coloration au vert de méthyle acétique (aqueux, 1%) + rinçage + montage au liquide glycériné, on voit apparaître des gouttes d’huile s’échappant de la coupe.
On différencie facilement les gouttes d’huile des bulles d’air car les phénomènes optiques sont inverses (les gouttes d’huiles réfractent plus fortement la lumière que l’eau, elles apparaissent en gris clair et sont entourées d’un bord sombre assez étroit).
Mon vert de méthyle est acétique il va y avoir une réaction sur ces coupes :
En effet, en présence d’acide acétique, les grains d’aleurone se gonflent, les cristalloïdes augmente aussi de volume (se déforment) et finissent par disparaître (pas dans ce cas car l’acide est pas assez concentré).
Les globoïdes deviennent aussi plus gros mais résiste à l’action de cet acide.
<span style='color:blue'>L’huile de Ricin présente encore cette exception : Elle se dissout dans l’acide acétique</span>.
Dans les autres cas, par contre, l’alcool absolu et l’acide acétique, par la raison qu’ils dissolvent peu ou point les huiles grasses et dissolvent au contraire les huiles essentielles, sont les meilleures réactifs pour constater la présence de ces dernières.
Le chloroforme et l’éther dissolvent les huiles grasses et les huiles essentiels.
Objectif 10x
10 :
Sur ce cliché on voit nettement la déformation des cristalloïdes en présence d’acide acétique.
Ceux-ci sont plus gros et méconnaissables en comparaison des photos précédentes.
Les globoïdes presentent moins de déformations.
Obj.40x, vert de méthyle acétique
11 et fin …
Une dernière vue au 20x, on remarque que certain cristalloïdes conservent encore quelques angles après le passage dans un acide acétique dilué.
Pour résumé ces différents traitements (il y en a d’autres, mais je ne les aborderai pas ici) on peut en retenir que l’histologie végétale doit se pratiquer d’une manière ordonnée si l’on veut comprendre ce que l’on voit à travers notre microscope.
Pour les nouveaux amateurs qui veulent appliquer des coupes et des protocoles, je ne peux que vous conseiller de chercher chez les bouquinistes (sur le net par exemple) d’anciens manuels de manipulations botaniques, on en trouve facilement à des prix raisonnables, ces ouvrages sont d’une richesse extraordinaire !
Et pour conclure : La nature et nos moyens techniques (d’amateur) nous proposent de merveilleuses choses à observer, continuons de les partager !
-
Bonjour à tous,
Il y a aussi une très bonne solution pour ceux qui possède une tournette (que l'on peut bricoler avec un moteur de jouet + variateur) :
Réaliser un anneau sur la lame avec du baume du Canada ou du vernis, ceci de l'épaisseur voulue.
On a l'avantage de pouvoir réaliser des puits de faibles profondeurs.
Il est aussi possible de faire la même chose sans tournette mais le haut des "parois du puit" est moins plat.
Amitiés à tous
Chris
-
Voici une petite étude que je voulais réaliser depuis longtemps car très facile à réaliser.
Vous avez tous mangé des poires mais savez vous ce qu’il en est de sa chair granuleuse … ?
Pour commencer, une situation de cette coupe transversale.
J’ai prélevé dans le parenchyme, plutôt vers l’extérieur du fruit.
Pour la petite histoire :
Les Grecs ont cultivé le Poirier (Pyrus) depuis un temps immémorial. C’est , on le suppose, l’agchnê des jardins d’Alcinoüs et de Laërte, dans l’Odysée, l’apion de Théophraste
(il était si répandu dans le Péloponnèse, dit Athénée, que la contrée avait pris le nom d’Apia).
P.Lieutaghi, Le livre des arbres, arbustes et arbrisseaux (très bon ouvrage !)
2 :
Voici donc les raisons des cette impression de chair granuleuse.
Dans toute la chair du fruit, on trouve des amas de cellules de ce type
(cela peut varier suivant l’espèce et l’emplacement de la coupe, la maturité du fruit)
Cet amas est de taille moyenne (env. 180 x 136 um), d’autres plus gros sont aussi visibles.
On les appelles parfois les noyaux de la poire.
Il s’agit en fait de cellules pierreuses et sont remarquable par l’épaisseur considérable de leur parois.
On est ici typiquement dans les tissus du Sclérenchyme (tissus de soutien, de scleros = dur).
Coupes à main levée (rasoir de barbier)
Coloration : Safranine O, solution aqueuse env. 0.5% (n’importe quel colorant de la lignine est ok)
Montage provisoire au liquide glycériné
obj. 20x
Eclairage (pour toutes) : Flash
3 :
4 :
Voici maintenant une grosse cellule isolée.
Son diamètre est d’environ 80 um
Les parois cellulaires sont imprégnées de lignine qui se dépose par couches successives, dans les micelles de cellulose.
Les cellules scléreuses meurent rapidement au cours de leur différenciation et leur contenu disparaît.
Le sclérenchyme est un tissus mort et incapable de croissance.
Remarquez aussi les nombreux et fins canalicules qui traversent la parois cellulaire.
Ces canalicules se ramifient à mesure que le lumen cellulaire se rétrécit, les canalicules se réunissent pour ne former finalement qu’un nombre relativement restreint qui débouche dans l’intérieur de la cellule.
Les extrémités externes des canalicules se correspondent toujours d’une cellule à l’autres (voir photo suivante).
5 :
Ca : Canalicule et correspondance avec la cellule voisine
Li : Strates de lignine (On les observes mieux sur la photo précédente)
Voir aussi les excellentes photos de sclérenchyme réalisées par André, ici :
http://forum.MikrOscOpia.com/index.php?showtopic=1809
6 :
Une autre vue au 40x et une coloration plus soutenue.
7 :
Le sclérenchyme réagit très souvent à la lumière polarisée.
En voici un exemple.
Alors ces merveilleuses poires, étonnant non ?
Amitiés à tous
Chris
-
Salut Florent,
Puisque le Contralck contient du Formaldéhyde, tu devrais l’utiliser en premier.
Il te servira de fixateur et de premier colorant.
Ensuite essaies un rouge comme deuxième colorant ?
As tu essayés de vider les cellules au Dakin ? (très efficace)
PS: Tes coupes sont de plus en plus claires, bravo !
Amitiés à tous
Christian
-
Re,
A part ça, connais-tu l'indice de réfraction de l'Agar ?
Je ne l'ai trouvé nul part, à mon avis il doit pas être terrible ...
Pour comparaison:
Gélatine glycérinée 1.47
Gomme arabique 1.512
Sirop d'Apathy 1.52
A+
Chris
-
Salut Florent, tous,
Je n’ai jamais vu (lu) l’agar utilisé pour des montages mais en revanche fréquemment en toute petite quantité pour ralentir les infusoires.
Comme tu le sais, c’est un excellent support pour les cultures de germes divers, dans le cas de montage durable, il faudrait peut-être y ajouter un antiseptique ?
Autrement dans les gélifiants, la gomme arabique est souvent employée (conservateur de Hoyer par exemple)
Amitiés
Christian
-
-
D'autant plus que la fourmi à "la peau dure" et les coupes ont tendance à se dissocier toutes seules une fois la paraffine enlevée.
Ne dois-tu pas coller ta coupe pour éviter cela :blink:
Amitiés
Chris
-
Salut Florent, tous,
Suite aux réponses précédentes je ne pourrai pas t’aider beaucoup plus concernant les coupes à la paraffine.
Mais regarde aussi chez Marcel (Champignon passion) qui à des articles très intéressant sur le sujet .
Il y a aussi bien sûr les bibles de Locquin, Langeron ou Séguy.
Puisque l’on parle du site de Marcel, as-tu essayé l’inclusion au PEG 4000 (PolyEthylène Glycol) ?
Ce produit se dissout dans l’eau.
Je m’y suis mis gentiment (j’ai encore beaucoup à tester) et commence à trouver cette méthode prometteuse (en histo. végétale)
En revanche je ne sais pas du tout ce que cela donne en histologie animale ?
Cela vaudrait la peine de se renseigner, est-ce que quelqu’un a expérimenté ?
Amitiés
Chris
PS: Bravo Walter pour ces exemples parlant !
-
-
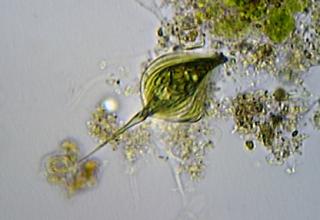
Bonjour à tous,
Un autre Phacus du Marais Poitevin
Phacus probablement tortus (ou torta selon la doc.)
Sa taille est de 79 x 30 microns (longueur total et largeur au plus grand)
ToUcam Pro2
Obj.40x
voir aussi ici :
http://protist.i.hosei.ac.jp/PDB/Images/Ma...acus/index.html
Amitiés à tous
Christian
-
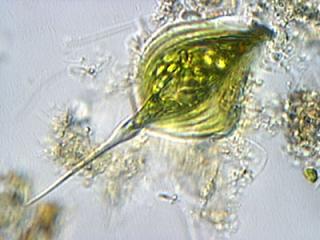
Une autre au 20x (ToUcam)
La taille de ce Phacus est d’environ 116 microns de long par 58 de haut
sur le forum voir aussi ici :
http://forum.MikrOscOpia.com/index.php?sho...=2556&hl=phacus
et là
http://forum.MikrOscOpia.com/index.php?sho...=1122&hl=phacus
Amitiés à tous
Christian
-
Bonjour à tous,
Toujours dans mon prélèvement du Marais Poitevin.
J’ai recensé un nombre élevé d’euglènes de différentes espèces.
Ici Phacus, probablement longicauda
voir aussi ici : http://protist.i.hosei.ac.jp/PDB/Images/Ma...acus/index.html
ToUcam pro2, mosaïque 2 images
obj.40x
-
-
Salut les Dominiques,
En regardant ton beau spécimen j'ai pensé aussi à A.sculptus
(selon ma doc : P.Lefebure et aussi ici http://www.microthele.it/micro/immagini/kemp/91.jpg )
la page d'acceueil du même site (100 diatomées, à visiter pour ses belles photos) : http://www.microthele.it/micro/immagini/kemp/kemp.htm
Amitiés
Chris
-
Bonsoir à tous,
Suite de ma récolte dans le Marais Poitevin (au filet à plancton)
Ici je pense à Selenastrum gracile, une algue faisant partie des Euchlorophycées (ou Chlorophycées suivant les sources).
voir aussi ici : http://protist.i.hosei.ac.jp/PDB/Images/Ch...ta/Selenastrum/
ToUcam pro 2
obj. 40x
Amitiés
Chris
-
En surfant pour trouver quelques infos supplémentaires je suis tombé sur une photo au microscope électronique (1) donnée pour A. heliopelta *
On se rend bien compte des difficultés photographique que l’on peut rencontrer avec nos moyens habituels (profondeur de champ) !
* Sur cette photo on observe 10 secteurs : Dans ma doc. et sur d’autres sites, A. heliopelta comporte 8 secteurs et une ornementation aux angles ext. des secteurs (cf planche, photo 2 et 3)
Cette ornementation est bien visible sur mon 2ème poste (les 4 images polarisées).
Sources :
1 : http://www.ucmp.berkeley.edu/historyoflife...3/mystery3.html
2 : http://rbg-web2.rbge.org.uk/DIATOM/facsimilies/E11_1.HTM
3 : Atlas des diatomées, P.Lefébure, 1947
-
Bonjour François,
Superbe cette antenne !
Te rappelles tu du protocole de montage et du média utilisé ?
On a assez peu d'insectes sur le forum, j'apprécie d'autant plus.
Amitiés
Christian
-
-
-













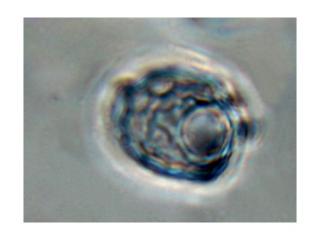
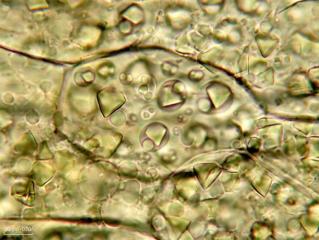



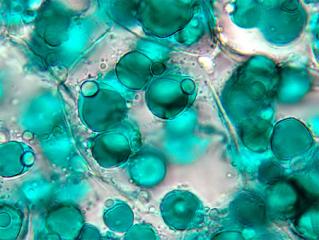


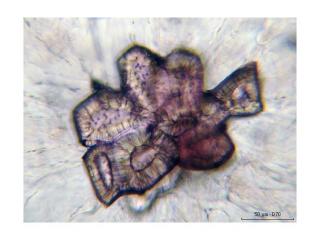




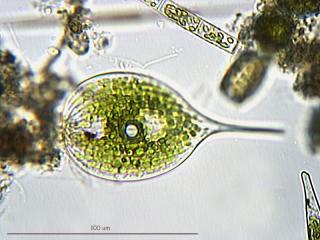
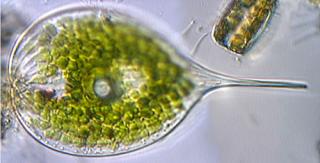






Grimmia decipiens (Schultz)Lindb
dans Bryophytes
Posté(e) · Modifié par chris
Bonjour les hacheurs fous !
Toujours superbes ces déterminations guidées, je me régale …
(la dernière Bertrand, c’est un morceau d’ongle :lol: )
Non, pour être plus sérieux j'attend avec impatience la suite.
Bravo vous deux !
Chris