-
Compteur de contenus
2 142 -
Inscription
Messages posté(e)s par Christian Aubert
-
-
Bibliographie : Flores - Arbres et arbustes - Etymologie
(consultez aussi sur le forum "Pollens et Spores")
Dictionnaire étymologique de botanique
Comprendre facilement tous les noms scientifiques
François Couplan
Delachaux et Niestlé, 2000
Reconnaitre facilement les plantes
Par l'odorat, le goût, le toucher
François Couplan
Delachaux et Niestlé, 2004
Flore complète portative de la France, Suisse et Belgique
Pour trouver facilement les noms des plantes sans mots techniques
Gaston Bonnier - Georges de Layens
éd.Bélin, 1986
Flore forestière Française
Guide écologique illustré
1. Plaine et collines
J.C Rameau, D.Mansion, G.Dumé
Institut pour le développement forestier, 1989
Flore forestière Française
Guide écologique illustré
2. Montagnes
J.C Rameau, D.Mansion, G.Dumé
Institut pour le développement forestier, 1993
Arbres et arbustes aux quatre saisons
270 espèces d'arbres et arbustes
Jean-Denis Godet
éd. Delachaux et Niestlé, 1991-2004
Le livre des arbres, arbustes et arbrisseaux
Pierre Lieutaghi
éd. Actes Sud, 2004
Arbres d'Europe occidentale
Alan Mitchell - John Wilkinson
éd. Arthaud, 1991
Histoire d'arbres
Des sciences aux contes
Philippe Domont - Edith Montelle
éd. Delachaux et Niestlé, Office National desForêts, 2003
-
Bibliographie : Histologie végétale et manipulations
(en construction, les commentaires suivront ...)
Atlas de la structure des plantes
Guide de l'anatomie microscopique des plantes vasculaires en 285 photos
Anna Speranza et Gian Lorenzo Calzoni
éd.Belin, 2005
Manuel technique d'anatomie végétale
Guide pour l'étude de la botanique microscopique
E. Strasburger
Paris, lib. F.Savy, 1896
Manuel de technique botanique
Histologie et microbie végétales
(Préface de M.Gaston Bonnier)
P.Dop et A.Gautié
Paris, F.R. de Rudeval, 1909
Manipulation de botanique
Guide pour les travaux d'histologie végétale et l'étude des familles végétales
Paul Girod
Paris, lib. J-B Baillière et fils, 1895
Numérisation partielle de l'ouvrage : Mikros
Les plantes étudiées au microscope
Jules Girard
Paris, lib.Hachette et Cie, 1877
Numérisation de l'ouvrage : Gallica
Précis de microscopie
Dr. M.Langeron
Col. de précis médicaux
Masson et Cie, Paris 1921
-
Bibliographie : Biologie végétale
(en construction, les commentaires suivront ...)
Biologie végétale (collection Atlas, 6ème édition)
1.Organisation des plantes sans fleurs
Jean-Claude Roland, éd.Dunod (2004)
Biologie végétale (collection Atlas, 8ème édition)
2.Organisation des plantes à fleurs
Jean-Claude Roland et Françoise Roland, éd.Dunod (2003)
Biologie végétale (collection Atlas)
Associations et interaction chez les plantes
Emile Duhoux et Michel Nicole, éd.Dunod (2004)
Biologie végétale
(cours, 2ème édition)
Jean-Calude Laberche, éd.Dunod (2004)
Biologie végétale
Guy Auderset
éd. Florimintanes, Genève 1987
La botanique redécouverte
Aline Raynal-Roques
éd.Belin, 1994
Biologie végétal
A.Guilliermond et G.Mangenot
(Col. du P.C.P)
Masson et Cie, Paris 1941
-
Bonjour à tous,
Prélevé d’un jus d’huître, javellisé et rincé
voici un petit test intermédiaire avant finalisation du protocole (acide chlorhydrique, rinçage et montage au Naphrax)
J’ai énormément de sable et de déchets (minuscules) dans ce prélèvement, la suite ne sera pas simple …
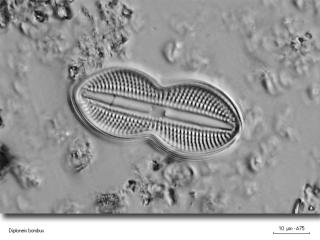
Je pense à Diploneis bombus au vu de ces caractéristiques :
Taille : 50 x 22 um
14um au plus fort de l’étranglement
Le nodule central est carré
J’ai compté 10 côtes transversales en 10um
L’aspect perlé est le résultat du croisement de côtes longitudinales (Diploneis possède deux plastes en plaques)
PdV :
Canon A75 et Luxeon
Obj. Leitz NPL x40, léger COL
Transformation en N&B + un chouia de NeatImage
Voir aussi : http://forum.MikrOscOpia.com/index.php?showtopic=1820
Amitiés
-
Salut Olivier,
Pauvre bestiole ! :rolleyes:
Voir ici http://forum.MikrOscOpia.com/index.php?showtopic=3204
-
Bonjour à tous,
Une petite nouvelle pour Synedra
Spécimen vivant, Marais de l'Etournel (01)
Selon M. Loir : S.capitata est moins courante que S.ulna (voir ici : http://forum.MikrOscOpia.com/index.php?showtopic=372 )
Selon H.Germain :
-Stries n'excédant pas 12 en 10 um
-Pseudoraphé très étroit
-Les ponctuations sont très difficiles à résoudre
-Les extrémités sont nettement capitées
Sur cette photo, deux individus de 345 et 314 microns de longueur, leur largeur est d’environ 10 microns.
Obj. x10
Une autre
Obj. x20
Une der. avec extrémité zoomée
Obj. x40
Amitiés à tous
-
Bonjour à tous,
Toujours du même prélèvement (début novembre) et conservé sur mon balcon jusqu’à ce jour (flacon ouvert et en demi-lumière).
Malgré le gel, la vie algale continue son bonhomme de chemin …
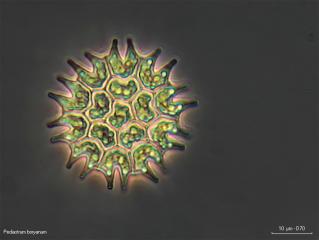
Cette fois je pense à P.boryanum var. longicorne, Reinsch 1867 (var. à confirmer …)
synonyme P. glanduliferum, A.W.Bennett
Sources : The F.A.F.B.I by John & Whitton & Brook
Cénobe à 16 cellules
Cornes assez allongées et sans aiguillons, extrémités plutôt arrondies.
Pas de méats intercellulaires
Diamètre = env. 38 um
Une première observation en contraste de phase
Image recadrée à 55%
Obj. Phaco x40
NeatImage
Et une autre avec COL
NeatImage
-
Bonjour à tous,
En profitant d’une commande (luxeon 5w) chez TotalStyles
j’ai profité de commander ce petit gadget fort pratique: http://www.totalstyles.fr/informatique-c-7...23b460a8b97fe2a
A la base prévu pour tenir au chaud une tasse de thé ou de café, cette petite plaque chauffante fonctionne à merveille pour fondre la gélatine glycérinée ou le PEG 4000 en petite quantité (enrobage avant coupes).
J’ai pas trouvé l’inverse avec pelletier pour refroidir la bière … :lol:
La température monte au centre de la plaque à environ 60° (à vide) en quelques minutes (45° env. sur sa périphérie).
Sa taille réduite, son très faible poids (80g) permet de la ranger partout et l’emporter facilement.
La plaque est fournie avec un câble USB côté PC et une fiche diam. 3.5mm côté appareil.
Il est donc possible de brancher l’appareil sur une alim de votre choix en modifiant le câble.
Son prix est de 13 € ttc, à comparer dans les magasins informatiques (peut-être moins cher ?)
La plaque chauffe plus au centre.
En ouvrant l’appareil, on découvre que les dimensions du corps de chauffe correspondent parfaitement à la taille de nos lames.
Conclusion : A conseiller sans modération !
Voir aussi (articles du site) :
Etuve et chauffe gélatine de Jean Legrand : http://www.microscopies.com/DOSSIERS/Magaz...Hotte/Etuve.htm
Chauffe gélatine de Jean-Marie Cavanihac : http://www.microscopies.com/DOSSIERS/Magaz...fe-GG/gelat.htm
Amitiés
-
Bonjour à tous,
Une idée comme ça …
Pourquoi ne pas nous présenter mutuellement notre coin labo … ?
A défaut de se rencontrer, on pourrait se connaître un bout de plus et c’est toujours amusant de voir comment chacun s’organise ;)
Alors je me lance (pour être franc j’ai fait du ménage avant la photo, ce n'est pas toujours comme ça ...)
A gauche ma bino et la hotte de séchage de Jean (voir sur le site) puis un espace pour les préparations (et la paperasse malheureusement) .
Devant, là je frime, une vitrine avec mes colorants et réactifs et juste après une autre pour les optiques et les livres basiques.
Entre les deux vitrines, microtomes rasoirs et compagnie.
Sous l’imprimante (à droite) j’ai un scanner bien pratique pour les copies de bouquins.
Tout ceci se trouve dans l’angle de mon salon, j’ai tendance à déborder mais j'ai une épouse très tolérante :D
J’espère que vous participerez à ce petit jeu, aucun jugement là dedans c’est juste pour le plaisir !
Amitiés à tous
-
Bonjour à tous,
Bonjour Olivier,
Merci de nous tenir au courrant pour tes essais, comme prévu :)
Une petite question sur ce gel, est-il possible de réaliser des puits très minces ?
(Quelle était environ la profondeur des puits dans tes essais ?)
Merci d’avance
Amitiés
-
Bonjour à tous,
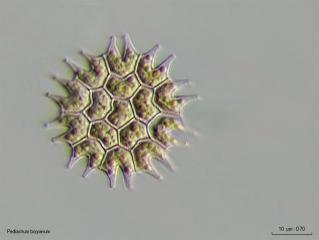
Prélevé au marais de l’Etournelle (algues sur cailloux immergés) voici un petit Pediastrum boryanum en contraste de phase.
Cénobe de 32 cellules, diamètre env. 65um
Pas de méats intercellulaires, cellules marginales à deux cornes, pas de cils apparents au bout des cornes, surface granuleuse des cellules.
-obj. Phaco x40
- recadré à 43 % de l’image originale
-NeatImage
Lien externe voir ici : http://protist.i.hosei.ac.jp/PDB/Images/Ch...anum/index.html
Amitiés à tous
-
-
Bonjour à tous,
Salut Alain,
Et bravo pour ton étude de tardigrade, j’adore aussi observer (mais j’en trouve rarement) ces petits nounours très particulier ;)
voir ici : http://forum.MikrOscOpia.com/index.php?sho...0&hl=tardigrade
Si mes souvenirs sont bons, les griffes sont très importantes pour la détermination.
Il me semble en distinguer 4 sur ta deuxième photos (vue détaillée d'une patte avant) ? Me trompe-je ?
Amitiés
Chris
-
Bonjour à tous,
Je reviens quelques instants sur cet ancien sujet :
Pour une bonne coloration du Carmin aluné, après le bain d’acide acétique à 1% ne pas rincé la coupe et colorer directement au Carmin (ou au Carmino vert de Mirande) puis continuer comme normalement.
Le Carmin aluné ne se conserve pas indéfiniment, il précipite et demande de temps en temps à être filtré.
Concernant l’incompatibilité du Carmin et de l’alcool, ceci est surtout vrai pour le Carmin boraté , en effet l’alcool à 90° précipite partiellement le Carmin boraté.
Amitiés à tous
-
Bonsoir Claude,
Pour répondre à ta question et selon mon Séguy (t1. 501) Mélange de Carnoy ou de Van Gehuchten
= acide acétique cristall(isable) 1 vol.
Ou acide acétique glacial.
selon le site de Marcel Lecomte : Dans le commerce, sa concentration varie de 84 à 98 % de son poids.
Amitiés
-
Bonjour Tarrinos,
Si tu cherches une méthode plus radicale il faudra te tourner vers les protocoles de fixation.
Je t’invite à chercher sur le site microscopies.com les articles traitant du sujet, par exemple un excellent article de Walter est ici (en deux parties) : http://www.microscopies.com/DOSSIERS/Magaz...LA-1/GALA-1.htm
Amitiés à tous
-
Re, Jean-Marie,
Nous sommes maintenant sûr que l'Eosine n'est pas un colorant vitale.
pour éviter de prolonger le doute, il faut se rappeler que l'éosine est vendue en grandes surfaces comme... désinfectant ce qui suppose une activité biocide non négligeable !!Ce qui est le cas aussi du Bleu de Méthylène pourtant utilisé en coloration vitale (très dilué bien sûr) !
Le bleu de méthylène est un antiseptique à faible action fongicide et bactéricide.
Il me semble que l'éosine des pharmacies est en solution alcoolique ?
Amitiés
-
SalutLoïc,
Selon mon Séguy (tome1, 483), je n’ai pas trouvé l’éosine dans les colorants vitaux.
Il parle de Bleu de méthylène, Rouge neutre, Vert Janus, Bleus de Nil et de Crésyl.
Le Rouge neutre étant le moins toxique de cette liste.
L’Eosine est classée dans les colorants protoplasmiques et s’emploie généralement combinée avec un colorant nucléaire.
Maintenant si quelqu’un à plus d’infos sur l’Eosine ? Les colorations vitales (végétale) et la cytologie sont des matières que j’ai encore peu abordé …
Une liste très intéressante de colorants avec leurs utilisation :
http://wwwpsvt.free.fr/svt/bio/colorants/c...s.htm#colorants
Selon ce site:
Les colorants non toxiques, susceptibles d'être des colorants vitaux sont tous des colorants basiques. Les colorants acides sont tous toxiques et pénètrent très mal (l'éosine est acide)
Les colorations vitales de tissus végétraux sont les mêmes que pour les tissus animaux.
Pour l’éosine il est dit :
Colorant acide qui colore les structures histologiques basiques (ex: protéines du cytoplasme)
technique courante en histologie (hématoxyline et éosine)
Pour le Rouge neutre :
à pH<5 le rouge neutre se fixe sur la membrane des vacuoles
à pH 7,5 le rouge neutre entre dans les vacuoles
Amitiés
-
Salut Loic,
Avec cette liste de colorants tu es parré pour toutes les observations amateurs courrantes.
Je rajouterais éventuellement de la Nigrosine pour l'observation des cilliés.
Pour le rouge neutre et le bleu de méthylène, les solutions aqueuses sont préférables (colorations vitales)
Amicalement
-
Re,
A propos du Calmette (Manuel technique de Microbiologie et de Sérologie) : 6 exemplaires en vente ici http://www.abebooks.fr/servlet/SearchResul...e&x=23&sortby=3
le moins cher à 28 euros !
A+
-
Bonjour Gérard,
Ta question est plus que justifiée !
Il s’agit en fait de déplacer, retourner, etc… de très petits objets sous la bino ou au micro.
Au micro, une aiguille emmanchée "standard" ressemble à un tronc d’arbre !
Voilà le pourquoi du comment.
Je sais qu'il est possible d'affiner considérablement les pointes (voir articles de Jean-Marie) mais je n'ai jamais essayé.
Amicalement
-
Re Michel et Claude,
Parfait l’idée des épingles d’entomologiste 0.1mm, je retiens !
Michel, "aiguilles" est le terme employé couramment dans les documentations du web sur l’acupuncture ...
Un détails peut-être pour les aiguilles d’acupuncture, elles me paraissent plus longue (40 et 25 mm pour les miennes).
On en trouve jusqu’à 150 mm en 0.3mm !
J’ai trouvé un site de vente en ligne de matériel médicale : http://www.materielmedical.fr/boutique/fic...34&tri=0&marq=0 (expl : 100p=11.90 euros)
Probablement plus cher que les épingles entomo. mais il faudrait comparer au micro et à l’usage leurs qualités respectives.
Est-ce qu'en même temps on aurait enfin trouvé notre étalon bon marché ?
Amitiés
-
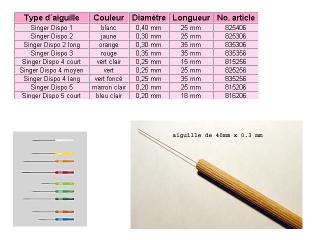
Bonjour à tous,
Il était question ici de micromanipulations (amateurs) : http://forum.MikrOscOpia.com/index.php?showtopic=306
J’ai obtenu récemment et gracieusement des aiguilles d’acupuncteur.
Comme ces aiguilles sont très fines et de bonne facture, j’ai pensé que cela pouvait être une bonne solution (parmi d’autres) pour manipuler de petits animalcules.
Il me semblait intéressant de relever cette possibilité car ces aiguilles sont faciles à obtenir.
Mes aiguilles sont en acier, d’un diamètre de 0.3 et de 0.25 mm
Il en existe aussi en 0.20 mm (et d'autres peut-être encore plus fines ?)
Ci-dessous un extrait de catalogue trouvé au hasard sur le net et une de mes aiguilles emmanchées.
On obtient pas la souplesse d’un poil de blaireau (ou cil de porc ?), fil de pêche, etc…, mais cela peut être aussi un avantage.
A creuser …
Amitiés
-
Bonjour à tous.
Une petite étude histologique (en cours) du bois de Pin, Pinus nigra (ssp. Laricio à confirmer)
Les coupes sont réalisées sur le prélèvement d’un jeune rameau (env.3 ans)
Pour faciliter les coupes et conserver mes échantillons, j’ai laissé macérer env. 3 semaines des sections de cette tige dans un mélange à parts égales de glycérine (98%) et d’alcool (env.70°).
Ici une situation de mes coupes transversales, d’autres coupes longitudinales viendront plus tard.
Pour voir des coupes d’aiguilles (du même arbre) :
http://forum.MikrOscOpia.com/index.php?showtopic=1133
Et pour le pollen (Pin des Landes) :
http://forum.MikrOscOpia.com/index.php?showtopic=2352
2 :
Vues d’ensemble de deux coupes transversales :
La première est une coupe suivie d’un simple rinçage à l’eau (pas de destruction de contenu cellulaire, pas de colorants)
Les p.d.v sont réalisées au soufflet (tirage env. 16 cm) + obj. agrandisseur NikKor 50mm, f :8 dans un verre de montre rempli d’eau et sur fond noir, éclairage épiscopique 2 led blanches.
Ces coupes ont un diamètre de 5 à 6 mm, il faut utiliser un rasoir solide pour les effectuer mais le passage au bain alcool-glycérine facilite ces coupes et diminue les risques de déchirements.
2b:
La deuxième à baigné dans le Dakin environ 20 minutes (destruction du contenu cellulaire)
puis bain d’a.acétique 1% et rinçage, pas de colorants.
3 :
Un recadrage et un agrandissement des photos précédentes.
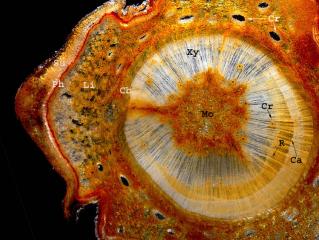
Coupe fixée mais non vidée :
Ici une petite légende des différents tissus qui me permettra de continuer plus profondément dans l’études de ces coupes.
L’écorce (ou liège) est partiellement présente sur ces photos,
ceci est du à la rétraction des coupes dans l’alcool et à la séparation de cette couche dans mes manipulations.
Su : Suber (ou liège)
Ph : Phelloderme
Li : Liber (ou phloème secondaire)
Cb : Cambium
Xy : Xylème secondaire
Mo : Moelle (ou parenchyme médullaire)
Ca : Cerne annuel
Cr : Canal résinifère
R : Rayon parenchymateux (ou r. médullaire)
Coupe (partiellement) vidée :
4 :
Un premier essais de coloration sur la coupe vidée au Dakin
Pour être plus sûr, j’ai finit de fixer cette coupe à l’AFA (alcool formolé acétique)
Ensuite : Bleu de méthylène aqueux 1% env. 5 minutes - régression à l’a. chlorhydrique 5% car il y avait surcoloration.
Puis, Safranine-O aqueuse 1% env. 3 minutes puis de nouveau régression a.chl., rinçages divers et montage au Chloral Lactophénol
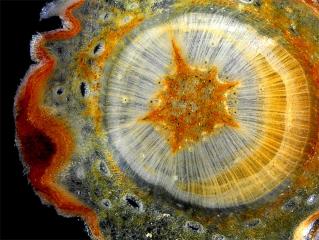
Ici une vue à l’obj.x10 du xylème secondaire (ou bois finit)
Le bois des Pins est homoxylé (c’est le bois des gymnospermes)
Homoxylé indique le caractère homogène de la composition histologique.
Le système longitudinal est en fait constitué presque exclusivement d’un seul type d’éléments conducteurs, les trachéides ou fibres-trachéides.
Le système transversale, de son côté, comprend des cellules parenchymateuses et des éléments de conduction appelés trachéides du rayon et organisés en rayon unisériés (l’épaisseur est constituée d’une seule couche de cellules).
Cr : Canal résinifère
R : Rayon parenchymateux (ou r. médullaire)
Cb : Cambium
Li : Liber (ou phloème secondaire)
-------
Ca : Cerne annuel
Be : Bois d’été
Bp : Bois de printemps
5 :
Je n’étais pas 100% satisfait des mes coupes et colorations aux forts grossissements.
Comme j’ai reçu dernièrement une ancienne lame de microtome mécanique, je me suis fabriqué un long manche en bois pour la fixer et l’avoir bien en main.
Cette lame mesure 12cm de long par 25mm de large. Le petit côté du triangle mesure 7mm.
Je peux vous assurer que les coupes deviennent comme par enchantement beaucoup plus faciles qu’avec un rasoir de barbier !
Comme protocole de traitement (après passage au Dakin et fixation à l’AFA) j’ai repris mon couple gagnant Safranin in cellosolve + Fast Green (alcoolique), déshydratation et montage au Baume du Canada.
6 :
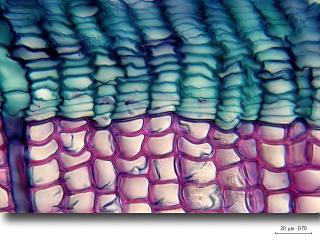
Ces nouvelles coupes sont beaucoup plus minces et régulières.
La double coloration est aussi plus nette, le montage au baume plus précis.
La Safranine colore en rouge les parties lignifiées, suberifiées, cutinées.
Le vert intense (Fast Green) colore en bleu-vert la cellulose, le cytoplasme.
Sur cette photo on remarque une partie plus dense dans le bois, il s’agit du bois d’été.
Comme ces coupes sont réalisées sur des jeunes rameaux, les différences entre bois d’été et bois de printemps (parois cellulaires plus minces) ne sont pas régulières sur toute la circonférence.
Tout à gauche du cliché, le cambium est bien mis en valeur par le Vert intense, les deux canaux résinifères aussi (sur la droite de la photo).
Obj.10x
7 :
Ici une vue à l’objetif x40 de cette transition bois d’été / bois de printemps
Le bois de printemps à des trachéides de grand diamètre assurant la conduction.
En été le bois a des trachéides de diamètre plus faible assurant essentiellement le soutien.
Chez les résineux, la transition entre le bois de printemps et celui d'été peut être :
progressive lorsque le bois d'été est mince, expl: le pin d'alep,
lente lorsque le bois d'été est épais, expl: le pin maritime,
brutale lorsque le bois d'été est très épais, expl: le mélèze.
8 :
Une vue du cambium, obj.x40
On observe des cellules parallélépipédiques à parois fines.
Le tissus cambial produit des jeunes cellules sur ces deux faces ; à sa face externe , elles se différencient en phloème, ces faces interne se différencient en xylème ou bois.
9 :
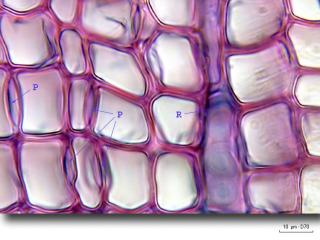
Dans le bois homoxylé des gymnospermes, les relations latérales entre les différents éléments verticaux (trachéides) se réalisent par des ponctuations d'un type particulier : On les nomme ponctuations aréolées
Sur ce cliché on observe des ponctuations aréolées en coupe transversale des trachéides "P" et on en devine vues de face, sous forme de disque, dans la coupe longitudinale du rayon médullaire "R"
On remarque aussi que ce rayon médullaire est bien constitué d’une seule couche de cellules.
J’espère pouvoir réaliser plus tard une bonne coupe longitudinale pour mettre en valeur ces ponctuations.
Obj.x40
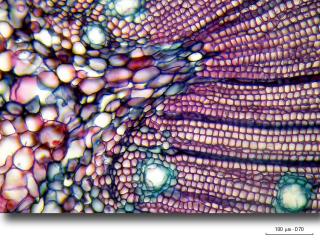
10 :
Au niveau du parenchyme médullaire (moelle) à l’objectif x10







































A lire avant de publier
dans [VEGETAUX]
Posté(e) · Modifié par Christian Aubert
Bonjour à tous,
Bonjour les botanistes !
Le forum dans sa nouvelle structure est un outil puissant s’il est bien utilisé.
Voici quelques recommandations importantes pour la base VEGETAUX
Titre : Nom Latin (Nom commun)- expl : Daphne mezereum (Bois Gentil)
Sous-titre : Mots clés importants - expl : tige, coupe transversale ou tige, collenchyme
Pourquoi ?
Les titres sont classés automatiquement par ordre alphabétique.
La suppression de l’article devant le nom d'une plante permet un classement alphabétique idéal.
Le nom latin en premier facilite les recherches scientifiques (sur le net et dans toutes les langues)
Donc évitez les titres du genre : La pomme de pin - Une belle promenade en forêt ;)
Si le titre du sujet ne peut pas commencer par le nom d’une plante particulière, par exemple une études sur différents genres de poils, commencez alors le titre sans article, cela devrait ressembler à : Poils et glandes végétales – étude morphologique
Pour le corps du sujet :
Autant que possible, surtout s’il s’agit d’une nouvelle plante dans la base, commencez par une description (même sommaire) de votre plante (+ une photo ou une planche).
Quelques lignes sur son habitat, son historique ou ses propriétés sont bienvenues.
S’il s’agit d’histologie, une photo (ou un dessin) de la situation de votre coupe est très utile pour le lecteur.
Ensuite n'oubliez pas de décrire précisément vos protocoles (coupes, colorations, etc …) ainsi que les détails de vos prises de vue si pas présent dans votre signature.
Indiquez aussi vos sources (liens Internet, documentations, etc ..), c’est utile pour tout le monde.
Les liens internes au forum (avec la base POLLENS par exemple) sont enrichissants et agréables.
Pour conclure, je rappelle aux nouveaux adhérents que les différentes bases de données (publiques) ne sont pas des forums de discussions. Pour entamer un dialogue il faut ouvrir un nouveau sujet dans [Forum principal / Débats] en indiquant le titre du sujet concerné.
Merci et bonnes publications !