-
Compteur de contenus
2 142 -
Inscription
Messages posté(e)s par Christian Aubert
-
-
Bonjour à tous,
J'ai enfin trouvé une différence évidente (pour la microscopie) entre méthanol et éthanol :
L'alcool méthylique est beaucoup moins hygroscopique que l'éthanol (selon Locquin et Langeron).
L'isopropanol (alcool isopropylique) est quant à lui non hygroscopique
(c'est d'ailleurs celui que j'utilise en lieu et place d'éthanol absolu, et avec succès)
Amicalement
ps pour la modération : est-ce que ce sujet ne devrait pas plutôt se trouver dans le forum principal ???
-
...
Bon, j'ai trouvé quand même un début de réponse ici (Yvan) :
http://forum.MikrOscOpia.com/index.php?s=&...ost&p=24376
Mais rien sur l'Histoclear particulièrement ...
-
Bonjour à tous,
Est-ce que quelqu’un ici utilise ou connaît l’Histoclear comme substitut du xylène dans les protocoles de montages au baume du Canada ?
Je n’ai rien trouvé sur le forum avec ce mot clé.
Si oui, pouvez vous me renseigner sur ses éventuels inconvénients ?
(éventuellement sa formule ???)
De ce que j’en ai lu, l’Histoclear est fabriqué à base d’huile de citron et ses vapeurs sont non toxiques (contrairement au xylène)
Son odeur est agréable (agrume)
Merci d’avance
-
Re Olivier encore …
Juste pour une appréciation de la quantité de thymol dans une préparation de GG :
Formule de Glycérine gélatinée selon H.Courteville (Séguy tome 1, 617)
Gélatine 8 g
Saccarose 27 g
Glycérine à 30° 25 g
Eau distillée 40 g
Thymol 0.02 g
On remarquera que la quantité de thymol est infime dans cette formule … !
A savoir aussi : L’HE de thym a une action éclaircissante.
Maintenant reste à savoir si la fuschine et le thymol ne sont pas incompatible ... (je n'ai rien trouvé à ce sujet)
Amitiés
-
Re Olivier,
Mon dernier message était proposé comme une question.
Donc ne le prends pas comme une solution éprouvée et testée !
Je n’ai jamais essayé cette approche, mais voici quelques idées :
Pour l’HE de thym, savoir que suivant la variété de thym, le taux de thymol peut fortement varier.
Regarde par exemple ce lien d’où j’ai tiré la chroma ci-dessous.
http://www.aroma-zone.com/ et cherche les diverses HE de thym.
On peut partir d’une formule à base de thymol pur et ajuster en fonction de son HE.
Savoir aussi que l’huile de thym a un indice de réfraction de 1.483 (selon Locquin et Langeron) et la glycérine 1.46 (on ne risque rien à ce niveau)
Il faudra simplement faire bien attention au mélange des phases.
Savoir aussi qu’une préparation GG sans conservateur (autre que l’alcool et la glycérine qui ont quand même une action antiseptique) se conserve plusieurs années si on travaille dans de bonnes conditions d’hygiène.
(ne pas toucher avec les doigts, ne pas cracher dessus, etc … :lol: )
Pour te dire, j’ai un pot de GG faite maison depuis 3 ans, sans aucun conservateur, qui ne présente aucune moisissure visible, idem pour mes préparations (de végétaux essentiellement).
Voilà voilà
Amitiés
-
Bonjour Jean-Marie, tous,
Suite à ton dernier message,
je me demandais si quelques gouttes d'huile essentielle de Thym (très concentré en thymol) dans la GG ne ferait pas l'affaire ???
(plus facile à se procurer que du thymol pur ou du phénol et moins dangereux)
Il faudrait bien sûr la diluer dans la phase alcoolique et/ou glycérine au préalable.
Voici une chromatographie pour une HE de Thymus vulgaris à thymol :
Monoterpénols : linalol (3.37%), terpinène-4-ol (0.90%)
Phénols terpéniques : thymol (45.58%), carvacrol (5.16%)
Monoterpènes : para-cymène (17.51%), gamma-terpinène (8.37%), myrcène (1.58%), alpha-terpinène (1.17%), alpha-thujène (1.27%), alpha-pinène (0.80%)
Sesquiterpène : béta-caryophyllène (3.79%)
En plus l'odeur est bien agréable, il manque que les cigales ;)
(pour la petite histoire, les Egyptiens utilisaient le thym pour embaumer leur mort ... pour dire que c'est un bon conservateur :D )
Amitiés
-
Salut Olivier,
Une méthode forte pratique pour colorer les pollens est de teinter directement la glycérine gélatinée (GG) dans la masse.
J'avais acheté chez Brunel * un mélange près à l'emploi (GG + Fuschine basique) mais il ne doit pas être difficile de le faire toi même.
Sans conservateur (phénol ou autres) ta préparation durera simplement moins longtemps.
Attention de ne pas surcolorer la GG !!! (la mienne est d'un rouge soutenu mais reste assez translucide dans son petit pot)
Je n'ai pas mes livres sous la main mais je peux peut-être te trouver une recette plus tard ...
(et André te donnera certainement la sienne !)
Amitiés
* Glycerine Jelly for Pollen: 15 mls
15 mls of Glycerin Jelly containing Basic Fuchsin which stains pollen during the mounting process.
Price: £1.91 (€2.81) (Excluding: VAT at 17.5%)
http://www.brunelmicroscopes.co.uk/acatalo..._Mountants.html
;) Croisement avec André !
-
Bonjour à tous,
Quelques précisions pour l’alcool absolu (éthylique) :
On ne peut obtenir de l'alcool absolu par simple distillation fractionnée, parce qu'un mélange contenant au moins 95,4 % d'alcool et 4,6 % d'eau devient un mélange azéotrope (c'est à dire : mélange à ébullition constante). Pour obtenir de l'alcool pur à 100 %, une faible quantité de benzène est ajoutée à l'alcool rectifié et le mélange est ensuite distillé. L'alcool absolu est obtenu en troisième fraction qui distille à 351,3 K (78,2°C).
Il existe également un processus de production d'alcool absolu par déshydratation au moyen de glycérine.
(cf Wikipédia)
Je pense qu'il est doit être très difficile voir impossible de prendre un alcool à 95° et espérer le rendre absolu par des moyens comme le sulfate de cuivre calciné ...
En tout cas mes essais n'ont pas été concluants du tout !
Il y aurait éventuellement (?) la soude caustique (pure) mais il en faut une grande quantité et c'est un produit très dangereux à manipuler (!!!)
Je n'ai toujours pas trouvé de tableaux comparatifs sur les avantages/inconvénients de ces divers alcool (éthylique, méthylique, etc ...) lors des préparations définitives en histologie ... (déshydratation)
Si jamais, je suis toujours preneur !
Une chose est sûre, le méthylique pue horriblement :lol:
A part ça, juste pour la petite histoire (Suisse => Absinthe Jurasienne) et puisque je m’intéresse aux huiles essentielles …
le problème du méthanol est lorsqu'il est dégradé par l'organisme apparait un radical formique (CH2) qui est un poison pour les terminaisons nerveuses ex: l'absinthe et Van Gogh et d'autres....Non, pas de méthanol dans l’Absinthe !
L’Absinthe est une macération de diverses plantes dans de l’éthanol suivit d’une seconde distillation.
C’est le thuyone contenu dans l’huile essentielle d’absinthe (la plante) qui est dangereux !
... et l'éthanol à haute dose !
Mais on en trouve dans nombre d’apéritifs qui eux n’ont jamais été inquiétés et beaucoup de légendes circulent sur la "fée verte" …
Amitiés à tous
-
Bonsoir Yvan,
Claude,
UN GRAND BRAVO à toi avec toute mon admiration pour ton travail et ton engagement pour une bonne cause.Idem !!!
Je suis bien-sûr toujours intéressé à cette participation.
Amicalement
-
Bonjour à tous,
Je te remercie Yvan pour la présentation de ton labo et de ton travail !
C'est pas tous les jours que quelqu'un prend le temps (et c'est beaucoup de temps) de nous expliquer en images les microtomes mécaniques, l'inclusion, c'est une chance pour nous !
Je suis allé voir tes articles sur Midscape, très intéressant.
Pour moi c'est un rève que j'aimerais bien réaliser un jour, j'ai même quelques idées de microtomes maison !
... mais pour l'instant je trouve que les coupes avec un simple Ranvier et sans inclusions sont déjà bien délicates pour moi ...
Si l'ocasion se présente, je suis aussi intéressé par tes lames, surtout végétales.
Continu tes présentations, c'est le pied !
Amitiés
-
Re,
Le problème n'est pas de trouver du baume du Canada mais du xylol ou xylène, du moins pour ceux qui n'ont pas d'accointances avec un laboratoire...Marcel Lecomte ou Brunel ! ;)
mais si tu utilises un baume synthetique en y ajoutant quelques gouttes de xylol ( sur la lame evidemment ) tu auras le meme résultat.A propos du Baume du Canada, je cite M.Lecomte :
il faut cependant savoir qu’avec le Baume du Canada, les petites bulles d’air disparaissent assez rapidement, car celui-ci est très avide d’ oxygèneEt effectivement, j'ai constaté une nette différence en comparaison des produits synthétiques, xylol ou pas.
Amitiés
-
Bonjour à tous,
Si vous avez eu l'ocasion d'utiliser du vrai Baume du Canada (Marcel L. par exemple) vous ne vous en passerez plus !
En effet, son très gros avantage sur les média genre Entellan est la disparition des éventuelles bulles d'air au séchage !!!
Très très agréable ;)
En revanche, le séchage est plus long, mais sommes-nous pressé ?
Amitiés
-
Bonjour Gérard,
Je suis plus conservateur de meubles anciens que de lames de collections et je ne te serai pas d’un grand secours.
Néanmoins nous utilisons souvent du bitume.
Ce que je peux te dire, c’est que le bitume de Judée une fois (trop)sec devient friable.
C’est pour ceci qu’en principe on lui ajoute une petite quantité d’huile de lin et de térébenthine.
Cette recette de lutage (d’aspect presque noir) est souvent citée dans les livres anciens de microscopie.
(reste encore à savoir si c'est bien du bitume qui lute ta lame ...)
Je pense le liquide qui a pénétré sous la lamelle et soulevé celle-ciQuel liquide (solvant) ?
Connais-tu la nature du média de montage (Baume du Canada, Styrax, etc …) ?
Et encore : Est-ce une lame ancienne ou récente ?
Amitiés
-
Salut Marc, tous,
Il existe des mini-pipettes très pratiques pour nos usages.
J'en avais commandé une fois un gros paquet et distribué sur le forum mais malheureusement je n'en possède plus beaucoup.
L'avantage de ces pipettes est leur transparence et le très petit diamètre du capillaire.
On les trouve chez les fournisseurs de laboratoires.
Sinon il y a aussi les aiguilles de seringue très fines, les fils à scoubidou (hé oui !), les gaines de fil éléctrique très fin, etc ...
(à connecter sur une pipette plus grosse)
Comme Pierre, je ne pense pas que les pipettes automatiques sont pratiques, trop encombrant et difficile de leur donner le bon angle sous l'objectif.
Amitiés
-
Bonjour Marc et J-M,
A propos des lames à puit ou micro-aquarium :
La méthode de Jean-Marie est celle que j’utilise largement (merci encore !)
Les joints de plomberie (ou autres matériaux opaques et épais) ont quand même un problème.
En effet lorsque les sujets se baladent trop près du joint, les ombres ou les aberrations portées par ce dernier sont assez dérangeantes … problème que l’on a pas avec une lame creuse ou encore avec la technique de la goutte suspendue.
Amitiés
-
Salut Claude,
Bravo pour cette belle prise de vue.
As tu essayé les fixateurs proposés par Walter (comme le GALA par exemple) ?
voir sur le site ici :
http://www.microscopies.com/DOSSIERS/Magaz...LA-1/GALA-1.htm
Amitiés
-
Bonjour à tous,
En faisant quelques recherches, me voici à nouveau sur ce sujet passionnant.
Une question était posée sur l’utilité de poser l’échantillon sur la LAMELLE (c.o)
Pour ma part, après comparaisons sur des coupes végétales, j’obtiens de bien meilleurs résultats avec cette méthode !
(avec une goutte de média sur lame et lamelle (sur l'objet) pour éviter les bulles)
Extrait de "Introduction à la microscopie par Frithjof A. S. Sterrenburg"
(A recommander à tout débutant !!!)
*************
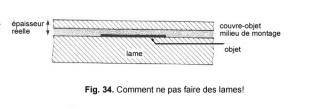
… Si vous placez l'échantillon sur la lame et que vous appliquez une lamelle couvre-objet recouverte de matériel de montage, vous obtenez la situation donnée à la Fig. 34. Même si le couvre-objet a la bonne épaisseur, vous avez introduit une épaisseur supplémentaire de matériel de montage, induisant une grande aberration sphérique. Placez toujours l'échantillon sous le couvre objet, jamais sur la lame! …
http://www.labomediqual.ch/microscope/intro.htm
*************
Amitiés
-
Celà sera la dernière que je vous présente
Ah ben non alors !
Il faut absolument nous faire profiter de tes résultats (d’une manière ou d’une autre) et je ne pense pas que tu "monopolises" le forum …
Si certain sont lassés, c'est leur problème :lol:
(à part ça je trouve que la polarisation sur la dernière n’amène pas grand chose, j'aime autant le fond clair qui est plus net)
Bonne continuation et bravo encore
Amitiés
-
Bonsoir à tous, Dominique,
Je ne loupe pas un seul de tes montages, c’est un magnifique travail !
(quand on connaît la difficulté de la chose et le temps consacré à l’apprentissage de cet art, j’en suis baba !)
D’une part c’est très esthétique, d’autre part, il est fort pratique d’avoir une collection sur une seule lame.
En tout cas tu peux me compter parmi tes admirateurs (et éventuel client au cas où ? K.Kamp pourra se rhabiller avec sa mauvaise humeur :lol: )
A l'occasion, explique-nous tes techniques !
Bravo encore et très bonne continuation
Amitiés
-
Salut Guillaume,
Les petites bêtes c'est bien mais je ne devrais pas négliger un peu de vie sociale.L'un empêche pas l'autre ...
Tu peux même cumuler les deux :P
Ah les citadins .....
Amitiés
-
Re,
qui seront mis à la disposition de la communauté via MarcelExcellente idée, tu ne pouvais pas mieux faire !
Amitiés :)
-
Bonsoir à tous,
Marcel,
Mais si, bien sûr que l'on a parlé de ton cercle, mais peut-être pas d'une manière très nette ...
Je dois quand même dire que sans toi passablement d'observations n'auraient jamais pu être réalisée ici !
Mais il y a des évolutions de la société que j'ai de la peine à suivre ...
Toute mon amitié
-
Bonjour à tous,
Jean-Louis,
Michel (Mpx) t’as donné une excellente réponse sur la conservation des échantillons.
Voici quelques clés supplémentaires pour la conservations et fixation des plantes avant études (puisque celles-ci ont l'air de t'intéresser).
Au passage, pour réaliser une bonne coupe et une bonne coloration, il est vraiment préférable de fixer les échantillons !
L’eau fraîche : Conserve pendant un temps assez court mais garde la plante dans un état vivant avec toutes ces caractéristiques !
Très utile avant une dissection.
La dessiccation : Conserve sur de très longues périodes (expl: les herbiers de nos ancêtres !)
Problème, il faut réhydrater convenablement * les échantillons, certains tissus ou plantes s’y prêtent mal.
C’est la méthode la plus simple pour les mousses, les lichens et les champignons qui supportent très bien la dessiccation mais aussi pour passablement de végétaux supérieurs.
*Plusieurs techniques (simples) existent.
L’ébouillantage : Eh oui, c’est aussi un moyen utilisé et peu donner de très bons résultats !
Le matériel frais et coupé est trempé dans de l’eau bouillante de 2 à 15 minutes (selon résistance du matériel et du contenu cellulaire, les bois, certaines racines et rhizomes demande un long ébouillantage).
Puis on conservera dans de l’alcool 70° env ou plus. (si les plantes contenaient beaucoup d’eau, changer l’alcool après une quinzaine de jours, éventuellement une seconde fois après un mois)
Avant un mois, les coupes sont difficiles à vider (présence d’amidon, de mucilage, de résines, etc …)
Voir alcool ci-dessous.
L’alcool (70°) : Très bien mais à une fâcheuse tendance à rendre dur et cassant les échantillons !
Avant de les utiliser, tremper dans un mélange (à part égale) alcool + glycérine, puis dans l’eau.
Alcool + Glycérine (part égales) : Ramolli les tissus durs (utile pour les coupes de bois)
La glycérine pose des problèmes avec les plantes contenant de l’amidon + certaines autres substances (difficile à vider après traitement) !
Pour différentes raisons, ce n’est pas un bon choix pour une longue conservation, en revanche pratique avant coupes d’objets durs.
L’AFA (alcool formolé acétique) : Il joue le rôle de conservateur mais aussi de fixateur (de masse).
Il faudra sortir les échantillons après un certain temps et les transvaser dans l’alcool 70°
A propos du Gala de Walter: Celui-ci contient de la glycérine, voir inconvénients ci-dessus
Mes sources : Thèse de Marie Madeleine Kraft (Etude critique des colorations en histologie végétale) , université de Lausanne, 1943 et Manipulations de botanique, P.Girod (cf. livre en ligne)
Amitiés
-
Re re bonsoir,
J’aimerais vous donner un avis très (trop peut-être) personnel.
Effectivement on parle de plusieurs choses à la fois, mais le sujet est Colorants et réactifs …mes interrogations.
Il est inévitable de slalomer un tant sois peu.
Personnellement, j’aime beaucoup le côté "chimique" de la microscopie, c’est un des aspects (parmi d’autres comme la mécanique de l'objet) qui m’ont beaucoup attiré (sans parler pas bien sûr des balades et de la photo).
Je ne pense pas que l’on puisse dire qu’il y a tel ou tel moyen d’aborder cette belle passion, nous sommes tous assez différents là-dessus et malgré tout nous nous rejoignons ici.
Si une petite trousse de scalpel + quelques réactifs et colorants de base font plaisir, c’est le but (de toute façon ils serviront)
Et les beaux outils et les beaux flacons donnent envie de les utiliser !
Amitiés




Histoclear comme substitut du xylène
dans - Préparations microscopiques
Posté(e)
Merci Alain pour ce lien.
Michel m’a passé aussi ceux-ci (HistoClear II)
http://nationaldiagnostics.com/index.php/c...42f94fef8df630a
http://nationaldiagnostics.com/product_inf...products_id/177
http://nationaldiagnostics.com/images/HS-202.pdf
J’ai re-potassé tous les bouquins en ma possession et finalement j’ai trouvé dans le Locquin et Langeron qu’un passage par l’essence de girofle, de bergamote * ou de cèdre (à ne pas confondre avec l’huile de) évite le passage au xylène !!!
J’ai les trois en ma possession donc je pourrai tester tout ça.
Comme quoi on va parfois chercher loin ce qu'on a sous les yeux … :D
Amitiés à tous
* Citrus bergamis (donc des limonènes comme pour l’histoclear)