-
Compteur de contenus
210 -
Inscription
-
Dernière visite
Messages posté(e)s par Marcel Lecomte
-
-
Message à tous les amis mycophiles et mycologues,
Après une longue période de travail assidu et épuisant, qui ne m'a laissé aucune place pour des loisirs, sinon très ponctuels, je vais mettre un point d'honneur à tenter de susciter à nouveau votre intérêt pour la microscopie appliquée à la mycologie, et d'apporter une réponse, dans la mesure de mes compétences, à toute question qui sera posée !
Claude LEJEUNE est malheureusement dans la même situation que moi sur le plan professionnel, et il est désolé de ne pas être présent plus souvent !
Je pense très sérieusement à une retraite anticipée qui me permettrait enfin de ne plus devoir juguler ma passion.....
Au plaisir de vous lire
M :)
-
Cher Christian,
Je ne ressens aucune idée de concurrence dans cette proposition, d'abord parce que notre petit "labo" de chimie fait partie d'une ASBL (association sans but lucratif), et que notre objectif n'est pas de gagner de l'argent, mais de répondre à une demande d'amateurs qui restait insastisfaite dans 99 % des cas ! En outre, je me sens très à l'aise vis à vis de quiconque et de toute remarque ou critique, puisque le travail que je réalise est entièrement bénévole.
Notre objectif est de mettre à disposition de chacun et à prix très abordable, des produits qu'un amateur ne peut se payer car ils sont en général conditionnés en quantités qu'on ne peut utiliser même en deux vies complètes.
En outre, jusqu'à présent, personne n'a réussi à me commander un produit que je n'ai pu trouver et fournir. Nous achetons parfois un produit brut qui nous coûte plusieurs dizaines ou centaines d'Euro, pour fournir 10 cc à une seule personne.
Personnellement, je ne vois aucun argument empêchant la publication de cette adresse (que j'aimerais d'ailleurs recevoir de Didier) ; je rappelle simplement qu'en dernir recours, c'est Michel qui a droit de décision absolue, en tant que maître modérateur....
Amitiés à tous
M :)
PS : après 6 mois de travail à priorité maximale, je retrouve .... enfin .... un peu de temps libre, et j'espère être plus présent sur notre forum, surtout pour les questions de mycologie.
-
Bonjour cher ami,
J'espère que tu vas bien !
Essayer de pratiquer une coloration régressive avec du HCl à 5 % !
C'est une technique utilisée en mycologie pour mettre en évidence les incrustations acido-résistantes des hyphes primordiales de la cuticule des russules (OUF !)
La difficulté va résider dans le temps d'application de l'acide qu'il faudra déterminer au départ par tâtonnement ..... bloquer la régression à l'eau !
Seconde possibilité :
placer les grains de pollen dans de l'eau albumineuse afin de les fixer sur la lame, ce qui permettrait de laver la préparation par la suite et d'éliminer le colorant ambiant ... et de régresser plus facilement ..... un inconvénient peut-être : la fuchsine va colorer les traces d'albumine de la préparation ....
-
Pardonne-moi, Robert, j'aurais dû te dire que le diluant du Merckoglas est le toluène ... je suis un peu surmené pour l'instant ....
Place donc les diatomées, comme le conseille notre Sherlock dans une goutte de toluène, et cet inconvénient mineur devrait disparaître !
Tiens-moi au courant de tes essais !
Amitiés
M ;)
-
Cher ami,
Vous avez en effet choisi une référence excellente avec l'article de J.M. CAVANIHAC.
Je me permets de vous faire part de mes idées et expérience personnelles, à titre informatif.
Ce que vous soulignez dans votre texte constitue justement le plus grand reproche à adresser à la GG : sa facilité à "faire des bulles", qui vient d'abord du fait qu'elle est trop chauffée !. Cela tient à quelques petits degrés !
Utiliser une plaque chauffante tiède (40° C maximum et même moins selon la composition) ou alors placer votre flacon à proximité de l'éclairage du microscope pour utiliser la chaleur générée .....
Mais dans le cas que vous évoquez, je pense que le problème vient surtout d'une préparation trop épaisse et de l'impossibilité du produit de conservation à combler les endroits remplis d'une grande quantité d'air !
S'il s'agit d'une coupe, le problème est simple à résoudre : il suffit de la baigner dans de la GG tiède, fondue, durant une heure ou deux, pour pratiquer une forme d'inclusion et puis la poser directement sur la lame porte-objet .... ou une goutte de GG sera en attente ... éponger le surplus éventuel !
Je dois vous dire que je lui préfère de loin le PVA coloré ou non, lactophénolé ou iodo-ioduré, qui s'utilise à froid et dont le solvant est l'eau : une préparation ratée est facilement rinçable et récupérable !
J'espère avoir répondu en partie à vos interrogations !
Bonne nuit
M :rolleyes:
-
Effectivement Michel ! merci de me le rappeler !
Un de ces tests s'appelle Test de BACH et on procède comme suit :
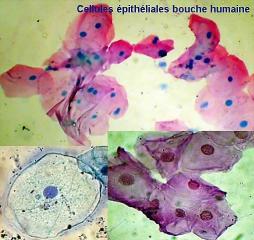
Prélèvement buccal
colorer au crésyl violet ou à la fuchsine de ziehl
cela met théoriquement en évidence le chromosome X qui se trouve dans les noyaux
Je n'ai pas encore pensé à le réaliser .... la porte est ouverte aux essais et aux futures photos.
Bonjour à tous
M :)
PS : Michel, je t'ai envoyé un courrier privé dernièrement qui reste sans réponse...ne serait-il pas arrivé à destination ?
-
-
-
Une astuce pour vérifier si on est présence d'amidon : utiliser la réaction amyloïde provoquée par l'iode (réactif de Melzer, Lugol .....) ... cela signifie que si on est en présence de grains d'amidon, ils vont devenir brun noirâtre !
Voici un exemple dans la pulpe de banane !
Dans le message suivant, je vous envoie la même photo sans la réaction !
-
Réponse à Robert d'abord !
Tu as voulu dire "Marcel" j'imagine .... pour le champignon de Paris, prélever une partie de lame (2-3 mm²) avec la bordure (important) ; placer d'abord dans une goutte d'eau et observer ! Tu ne verras peut-être pas de spores car certains de ces cultivars sont stériles, mais des basides et des cystides...
Ensuite, placer dans une goutte de rouge Congo ; rincer après 1 minute (en utilisant un bout de papier cuisine ; placer une goutte d'eau ; dissocier et observer; les composants seront très visibles !
Bonne nuit à tous
M :unsure:
PS : en annexe, une photo d'Albugo candida, la rouille blanche du navet, qui est un mildiou....
Pour Christian !
Si tu englobes Rouilles - Charbons - Oïdiums et Mildious, (tous des champignons microscopiques parasites des plantes), tu peux en trouver sur toutes les plantes et tu as du travail pour les 100 ans qui viennent ... Les Rouilles ont des cycles de vie très complexes avec des changements d'hôtes et des formes différentes où interviennent jusqu'à 5 sortes de spores : spermaties, écidiospores, urédospores, téleutospores et basidiospores. Nombre de stades pour certaines espèces ne sont pas encore connus .....
Voici un texte de mon ami Arthur VANDERWEYEN, spécialiste belge des Rouilles, qui te donne une idée :
""""...
Certaines rouilles, que l’on dit autoxènes, effectuent leur cycle complet sur la même espèce. C’est le cas de la rouille blanche, Puccinia albescens, sur la moscatelline, Adoxa moschatellina.
Mais de très nombreuses rouilles, dites hétéroxènes, s’attaquent successivement à deux plantes.
Quelques exemples :
La rouille noire des graminées, Puccinia graminis, se présente, aux stades 0 et I, sur l’épine-vinette, Berberis vulgaris, et aux stades II, III et IV sur le froment.
La rouille grillagée du poirier, Gymnosporangium sabinae, est en O et I sur le poirier et en III et IV sur divers genévriers, sur lesquels elle produit, au printemps, de remarquables protubérances orange. Chez cette espèce, le stade II (urédospores) fait défaut. Le cycle est donc normalement incomplet.
La rouille du peuplier, Melampsora populnea, est, en 0 et I, sur le pin sylvestre et, en II, III, IV, sur le peuplier.
La rouille du rosier, Phragmidium mucronatum, autoxène, possède de ramarquables téleutospores pédicellées à 6 ou 7 cellules.
Chez la rouille du géranium, Puccinia pelargonii-zonalis, on ne connaît que les stades II à IV, les écidies étant soit inexistantes, soit éventuellement présentes sur des plantes avec lesquelles on n’a pas établi de relation. ...""""
-
-
-
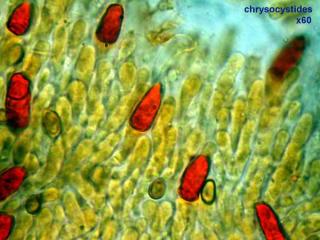
Certains genres de champignons et notamment les Strophaires, possèdent sur la face des lames des cystides contenant des vacuoles énormes dont le contenu devient jaune d'or en présence d'ammoniaque, ce qui justifie leur nom de "chrysocystides". Ici, elles sont colorées en rouge par le rouge Congo ammoniacal.
-
Chers amis,
Disposant de quelques jours de congé, je vous adresse quelques photos tirées de ma collection de préparations définitives !
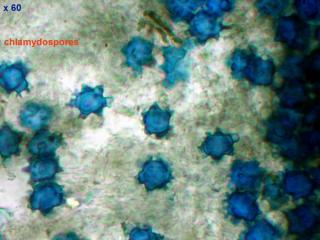
Voici ce qu'on appelle des chlamydospores, qui sont des éléments de reproduction non sexués.
On les trouve notamment chez certains champignons (du genre Nyctalis) parasites d'autres champignons (du genre Russula par exemple).
Bonne nuit
M ;)
-
Un message particulier de Saint-Sylvestre à tous mes amis mycologues ou mycophiles, à qui je souhaite une bonne année 2005.
Avec mon ami et co-modérateur Claude LEJEUNE, nous tenterons plus que jamais de vous communiquer notre passion.
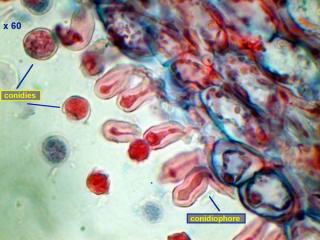
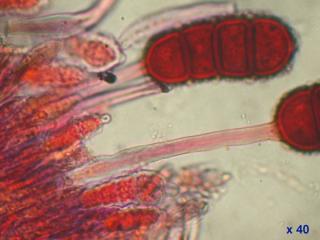
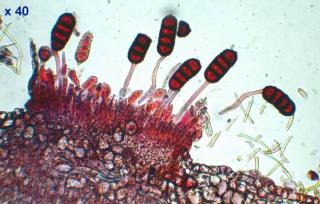
Voici en annexe une image des macrocystides de Strobilurus tenacellus : elles se trouvent sur l'arête des lames ! Cette image a été réalisée en lumière COL x60.
Bonne nuit à toutes et tous ... et attention si vous prenez la route !
Amitiés
M ;)
-
Bonjour Christian,
Pour les préparations montées à la GG, pas beaucoup de problèmes ! le risque d'accident est de l'ordre de 5 à 10 %, moins avec de la patience et de la minutie .... prendre la précaution auparavant de placer la préparation sur une plaque chaffante ou dans de l'eau à 45-50° C !
Si ta coupe est bien collée sur la lame PO, il est assez facile de déshydrater (bains successifs en commençant avec de l'alcool à 60° : ne pas plonger immédiatement dans du 95° !) pour monter ensuite au baume du Canada ou autre conservateur dont le solvant est le xylène ou le toluène.
Si tu ne souhaites pas déshydrater, le Hoyer est excellent, ou le PVA lactophénolé (attention, ce dernier ne supporte pas le rouge Congo, qui devient tout noir : normal c'est un indicateur des milieux acides et il y a de l'acide lactique concentré !).
Pour tout ce qui est "tissus mous, non rigides", et c'est le cas en mycologie, j'utilise du PVA IKI coloré dans la masse au rouge Congo, au bleu d'aniline ou à la phloxine B, ce qui colore directement les pièces par diffusion et accentue le contraste.
Pour tout ce qui est rigide, non déformable par la déshydratation, j'utilise le BCanada, l'Histolaque et le Néo-Entellan.
Bonne journée
M :o)
-
Bonjour les amis !
Pour l'AFA (Alcool Formolé Acétique), aucun problème de polymérisation .... ne quand même pas le ranger au frigo .... mais il tient sans soucis entre 5 et 40° C.
Pour le formol, qui polymérise facilement en trioxyméthylène, l'idéal est de le garder dans un emballage en polystyrène expansé (comme ceux utilisés par les grossistes pour livrer les flacons de la plupart des produits).
Si le problème se présente malgré toutes les précautions, tu peux le résoudre théoriquement en plaçant ton flacon, avec le bouchon fermé, à côté d'un radiateur non électrique (ou dessus ....), en ne dépassant pas 60-70°. En effet, le trioxyméthylène se redécompose en aldéhyde formique sous l'action de la chaleur.
Si ton formol est trop vieux, il sera difficile de le récupérer !
Sachez aussi que le problème se présente beaucoup plus souvent avec le formol commercial (qui contient des impuretés dont notamment du méthanol) qu'avec celui de laboratoire, qui est en principe très pur.
Bon réveillon de Saint-Sylvestre à tout le monde, avec mes meilleurs voeux de bonne année 2005 et le plaisir anticipé de vous retrouver par le biais de mon écran.
.
-
J'ai corrigé une grossière erreur de frappe et je mentionne en outre le glycérol, avec un n de 1,71 (préconisé au départ par le fournisseur pour les microscopes à fluorescence), mais que j'utilise avec beaucoup de succès en microscopie normale ! Je vais tenter de préparer durant ce congé de la glycérine iodomercurique qui a un indice de réfraction de 1,8
Mon cher Olivier,
Tu oublies le PVA (Alcool Polyvinylique) colorable de toutes les manières, lactophénolé ou non, le Conservateur de Hoyer, l'Histolaque, le Néo-Entellan (sans doute pareil à Entellan) ..... et un produit que je viens de découvrir (nouveau pour moi) : le Merckoglas, qui est un milieu de conservation ne nécessitant plus de lame couvre-objet (recommandé sur les frottis quand on utilise le complexe colorant appelé Cytocolor).
Bonsoir au forum
M :rolleyes:
-
Mon cher Olivier,
Tu oublies le PVA (Alcool Polyvinylique) colorable de toutes les manières, lactophénolé ou non, le Conservateur de Hoyer, l'Histolaque, le Néo-Entellan (sans doute pareil à Entellan) ..... et un produit que je viens de découvrir (nouveau pour moi) : le Merckoglas, qui est un milieu de conservation ne nécessitant plus de lame couvre-objet (recommandé sur les frottis en quand on utilise le complexe colorant appelé Cytocolor).
Bonsoir au forum
M :rolleyes:
-
Des préparations définitives ?
Le grand classique depuis toujours est l'inclusion à la paraffine et la conservation au Baume du Canada !
MAIS cela implique des manipulations très longues, fastidieuses et dangereuses à force de répétition (utilisation du xylène).
Aussi, depuis plus de 2 ans, j'expérimente (avec l'aide et les conseils d'autres mycologues) des techniques moins lourdes ou nocives, applicables dans un 1er temps aux tissus fragiles des champignons qui ne supportent pas les déshydratations successives .... je me suis donc tourné vers des produits dont la majorité ont l'eau comme solvant .....c'est ainsi que j'utilise selon les cas le conservateur de Hoyer, le PVA (Alcool Polyvinylique), le PEG (PolyEthylèneGlycol) ; de même que la GG (Glycérine Gélatinée), l' histolaque, le Néo-Entellan, le glycérol, .... en ayant recours le moins possible à l'inclusion des pièces (travail long et fastidieux), mais par contre, en soignant bien la fixation, la finesse des coupes, le collage et la coloration.
Tout cela est en constante évolution, et les idées pratiques de chacun sont les bienvenues !
Amitiés
M :)
PS : je ne serai pas plus long sur le sujet, afin de ne pas encombrer le forum !
Si vous souhaitez en connaître plus à propos de ma vision personnelle et de mes expérimentations, je vous convie à visiter mon site, où j'ai réalisé une série de fiches techniques qui ont la réputations de n'être pas trop mal réalisées.
-
Pourquoi des préparations définitives ?
1/ l'objectif didactique : se constituer une collection de préparations bien typées est extrêmement intéressant si on se sent une vocation de conférencier ou d'enseignant, et qu'on a envie de communiquer sa passion à d'autres ...
Je suis désolé de vous parler de moi pour illustrer la chose !
Notre cercle de mycologie a la chance de disposer d'un laboratoire universitaire pour nos réunions et nous disposons de 30 microscopes, et d'un projecteur multimédias ... j'ai donné cette année une série de cours d'initiation pratique à la microscopie (plus spécialement adaptée à l'étude des champignons) qui a fait salle comble (à mon grand étonnement car peu de personnes disposaient d'un microscope personnel) et la présentation d'images et de préparations de référence disponibles à volonté a été d'une haute utilité ... Ma satisfaction a été immense de constater que par la suite, 6 personnes m'ont demandé de les aider pour acheter un microscope personnel, et qu'une suite a été demandée pour 2005 !
2/ la satisfaction personnelle :
On réalise parfois ou souvent, selon le niveau d'habileté, des préparations très bonnes qu'on souhaiterait conserver .... c'est possible (en respectant certaines règles des modus operandi) et très enrichissant, car on se constitue petit à petit une banque de données consultable a volonté, et une sorte d'indice personnel de progression technique.
A suivre ....
-
Jean-Marc a tout bon dans sa réponse : le salycilate de soude est utilisé comme bactéricide et anti-oxydant ! On peut aussi utiliser du thymol (pas plus facile de s'en procurer) ou du phénol (encore bien plus toxique) et qui a la néfaste propriété de décolorer les coupes assez vite, ce qui n'est pas intéressant pour des préparations définitives.
Ma dernière solution mère d'albumine glycérinée (préparée selon la formule mentionnée sur mon site) est au frigo depuis un an, sans altération aucune .....
Michel a très bien justifié la nécessité du collage, donc pas de commentaires en plus !
Pour ceux qui sont vraiment intéressés, vous me faites signe et je vous envoie quelques grammes par courrier (cela se vend par kilo chez mon fournisseur)
Ne perdons pas de vue que toutes ces manipulations sont destinées à des préparations définitives, visant une conservation la plus longue possible !
Alors, cela vaut la peine de ne pas "bricoler" sous peine de voir sa préparation envahie par les moisissures et les bactéries .... ou se décolorer complètement après 6 semaines !
S'il s'agit de préparations extemporanées et ponctuelles, ne vous lancez pas dans des complications pareilles, puisqu'il n'y aura pas de suite !
"Et rose, elle a vécu ce que vivent les roses, l'espace d'un matin !" (Ronsart)
Amitiés
M :o)
-
Bravo Chris !
Remarquable travail et protocole exemplaire .... une question : qu'appelles-tu Dakin ?
Bonne nuit
M :)
-
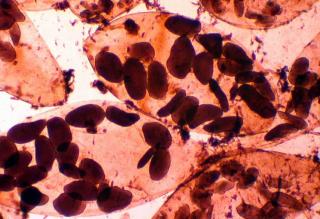
Voici ce que l'on peut observer lorsqu'on soumet des spores de lactaires (ou de russules) au réactif de Melzer (réactif iodo-ioduré).
La réaction amyloïde est très évidente (coloration des sucres complexes qui composent les crêtes ornementales des spores en violet noirâtre).
Ici, chez Lactarius evosmus !
Ces spores sont toujours de l'ordre de 6-8 x 4-6 µm, ce qui nécessite l'emploi permanent de l'objectif x 100 à immersion !



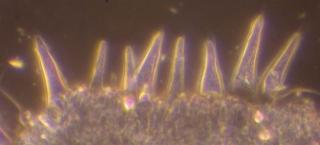
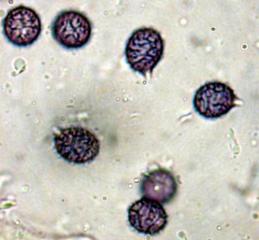
Rouilles
dans Mycologie microscopique
Posté(e)
Mes amis,
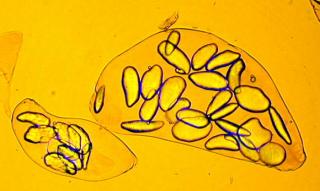
Afin de pouvoir exploiter mes modestes connaissances botaniques générées il y a longtemps par une spécialisation en Coléoptères CURCULIONIDAE (où chaque espèce est en principe inféodée à une plante bien précise....), je me suis mis à étudier les UREDINALES (Rouilles) qui sont des champignons Basidiomycètes particulièrEment intéressants sur le pLan microscopique.
Voici, comme première approche, une image d'une téleutospore de la rouille du framboisier, qui va illustrer à merveille cette déclaration.