-
Compteur de contenus
210 -
Inscription
-
Dernière visite
Messages posté(e)s par Marcel Lecomte
-
-
-
Chers amis,
Je me permets une petite intervention à ce sujet !
Mon intention n'est pas de contrarier Holmes, mais il faut savoir que le Baume du Canada, s'il durcit effectivement assez vite en périphérie de la lame couvre-objet, ne durcit pas dans la masse ; j'ai des préparations réalisées en 1967 au B.Canada dont le centre est toujours fluide....
Pourquoi un lutage qui n'est cependant pas indispensable ?
Simplement parce que les préparations définitives utilisées à des fins didactiques nécessitent d'être souvent nettoyées à l'alcool lorsqu'on les utilise avec de l'huile d'immersion et ce lutage permet de réaliser ce nettoyage vigoureusement et sans crainte de déplacer le couvre-objet : c'est donc surtout une raison de facilité !
Mais chacun oriente ses préparations selon ses désirs personnels !
Amitiés à tous et bon dimanche
M :)
-
Merci André pour cette proposition ! Je cherche surtout du pollen de Pin mais j'accepte tout pollen de Conifères !
Merci Claude pour ce montage et ton humour .... tu penses à mes spores de Piperatini ?????
Amitiés
M :o)
-
Cher André,
Voici une autre photo qui montre le détail d'un grain !
Grosse difficulté de préparation si on ne connaît pas l'astuce ! En effet, les poches qui entourent le grain sont remplies d'air au départ afin de permettre sa dissémination par le vent ; mais en microscopie, une bulle d'air est toujours catastrophique, et elles vont rester noires si on ne les traite pas !
Voici comment je procède pour arriver à ce résultat :
1/ réalisation d'un frottis à l'eau albuminée
2) mouiller avec une goutte de lactophénol
3/ chauffer à la flamme jusqu'à la 1ère bulle
4/ colorer au bleu coton
5/ rincer
6/ monter au Conservateur de Hoyer ou au PVA glycériné iodé
Cette technique m'a été enseignée par un microscopiste de génie, autodidacte, âgé aujourd'hui de 73 ans et habitant la région de TOURS : mon ami Paul LEROY, que certains connaissent peut-être !
La chaleur évacue la bulle d'air et permet au lactophénol de pénétrer dans les air-bags, les rendant transparents..... cela n'est compliqué qu'en apparence, un peu fastidieux, mais s'oublie vite quand on voit le résultat !
Bonne nuit
M :)
-
-
-
Chers amis,
Voici une espèce assez rare (trouvée ici en milieu sablonneux maritime) qui présente des spores remarquables.
Dimensions : 25-27 x 16-17 µm
coloration au rouge Congo SDS
préparation définitive au Conservateur de Hoyer.
On trouve sa cousine, Geopora sumneriana (de plus grande taille) sous cèdres au printemps.
Bonne soirée à tous
M :)
-
Voici maintenant un Ascomycète de forme plus classique, à allure de pezize !
Discina perlata n'a pas de nom vernaculaire !
Voici la spore de Discina perlata !
objectif planachromatique x100 immersion ; coloration au rouge de ruthénium aluné
Bonjour marcelLa spore du Discina est pour le moins originale,et doit être énorme parmi ses congénères.Le nom d'espèce" perlata" vient sans doute des inclusions arrondies?
Pour la coloration,choisis-tu le produit en fonction de l'espèce ou fais-tu des essais avec différents colorants ?
André Advocat
Cher André,
Je suis navré de te répondre aussi tard, mais je rentre d'une semaine de congrès dans ton beau pays, pour l'étude justement des Ascomycètes et des Pyrénomycètes.
Avec un peu d'habitude effectivement, on utilise un colorant plutôt que l'autre !Pour les Basidiomycètes (champignons à lames), j'applique d'abord le rouge Congo SDS sur du matériel frais ou du rouge Congo ammoniacal sur des exsiccata...
Pour les Ascomycètes, je commence en général par le bleu coton lactophénol, le bleu de crésyl ou l'encre Waterman ; mais je sais également que le rouge de ruthénium réserve souvent des surprises !
A titre expérimental, j'essaie en mycologie un tas de colorants (voir ma liste et aussi mes carnets de note sur mon site) qui au départ sont réservés à l'histologie animale ou végétale.
J'en profite pour saluer très amicalement Christian C. et Claude L.
Amitiés à tous
M :)
-
Chers amis,
Afin de changer un peu de sujet, je quitte maintenant les champignons à hyménophore lamellé (Basidiomycètes) pour aborder les Ascomycètes : ici, les spores se trouvent dans des asques et non plus sur des basides.
Voici une espèce à spores très grandes et à asques bisporiques, ce qui est assez rare : Ptychoverpa bohemica, appelée aussi verpe de Bohême !
Voici maintenant la spore, où on voit très bien la double paroi (endospore et exospore) - objectif planapochromatique x40 et coloration au bleu de méthylène aluné
-
Suite à la remarque de Claude et la confirmation par Michel, voici donc une représentation macroscopique de Lactarius luridus, dont j'ai montré les spores dans cette rubrique. C'est un lactaire de la section des Uvidi, sous-section des Uvidini, à lait blanc devenant violet à l'air par oxydation.
Bonne nuit à tous !
-
-
Cher tous, et André Aphylla en particulier !
Voici une plante qui ne pousse peut-être pas dans ta région, mais qui est susceptible de t'intéresser .... Les spores sont assez banales, mais la fleur est superbe !
Il s'agit de la Parisette à 4 feuilles, une Liliacée (Paris quadrifolia Linné)
Bonne nuit
M :)
Le pollen arrive dans le message suivant !
-
-
Chacun connaît l'aspect gastronomique des truffes qui sont des champignons hypogés (qui vivent dans le sol) ... Il en existe cependant nombre d'espèces et il est très facile de les reconnaître au microscope, car toutes les spores sont différentes ! La falsification ne résiste pas à l'examen microscopique !
En outre, ces spores sont superbes !
Voici celles de Tuber maculatum Vittadini, truffe non comestible à saveur désagréable (dimensions : 28-40 x 20-35 mµ) objectif à immersion x100
Bonne nuit à toutes et tous
Marcel :-)
-
Chers amis,
L'envie grandissante me vient de vous intéresser à la mycologie microscopique !
Aussi, voici un sujet que vous pouvez rechercher assez facilement sur les champignons dont le chapeau présente des lames à la face inférieure : ceux qu'on appelle les Basidiomycètes !
Il suffit de prélever un minuscule fragment de lame, de le colorer au rouge Congo SDS (s'il s'agit de matériel frais) ou de rouge Congo ammoniacal (pour des exsiccata) et d'effectuer une légère dissociation (tapoter la lame couvre-objet avec une gomme) afin de fragmenter la pièce !
Avec un grossissement de x40, on observe très bien les basides, qui sont surmontées de petites "cornes" appelées stérigmates, qui portent les spores. Ces excroissances sont très souvent au nombre de 4.
Alors, bonne observation !
Amitiés
Marcel :-)
Voici un petit exemple (x100 immersion) de ce que vous devez chercher (ici baside de lactaire)
-
Voici le champignon en question ! (scan réalisé par F.DRAYE)
Pour voir les Asques et les Spores cliquez ICI
-
ne précision !
Je viens de me rendre compte, après examen minutieux, que l'image envoyée dans le message suite 3 (dernière) n'est pas de moi et que je me suis attribué la paternité d'une photo qui revient à quelqu'un d'autre !
Cette image m'avait été envoyée comme vignette pour illustrer le site du forum et je me demande si elle n'est pas de Michel !
Je l'ai gardée parmi les milliers d'images dont je dispose et j'ai oublié d'en noter l'auteur.
Je lui présente mes excuses et lui demande de se manifester s'il reconnaît SA photo .... si ce n'est pas le cas, elle restera anonyme malheureusement !
La voici à nouveau...
Amitiés à tous
Marcel :(
<span style='font-size:14pt;line-height:100%'>Décidément,je suis bien maladroit ce soir ... la voici !surmenage ????</span>
-
Une précision !
Je viens de me rendre compte, après examen minutieux, que l'image envoyée dans le message suite 3 (dernière) n'est pas de moi et que je me suis attribué la paternité d'une photo qui revient à quelqu'un d'autre !
Cette image m'avait été envoyée comme vignette pour illustrer le site du forum et je me demande si elle n'est pas de Michel !
Je l'ai gardée parmi les milliers d'images dont je dispose et j'ai oublié d'en noter l'auteur.
Je lui présente mes excuses et lui demande de se manifester s'il reconnaît SA photo .... si ce n'est pas le cas, elle restera anonyme malheureusement !
La voici à nouveau...
Amitiés à tous
-
Cher Christian,
Juste une précision à propos de ton dernier message, afin de ne pas semer la confusion dans l'esprit des autres participants : Marcel LECOMTE, Lactarius, c'est moi ! Je n'ai pas d'homonyme sur ce forum .... et nous serons très contents, Claude LEJEUNE ET moi-même, de tenter de vous aider en mycologie !
Amitiés
M :o)
-
Bonjour mon ami Christian,
Je suis très content de te voir à l'oeuvre !
Voici :
Vous pouvez découvrir et aller consulter mon site à l'adresse suivante :
Au plaisir de nouvelles découvertes à propos des grains de pollen en ta compagnie et celle d'Aphylla notamment, qui semble infatiguable ....
Amitiés
Marcel :)
-
Bonjour à tous les palinophiles et à mon ami Christian en particulier !
Pas grand chose à ajouter à ta remarquable démonstration mon cher Christian, sinon quelques petites précisions !
Je te remercie d'abord de rappeler les fiches microscopiques de mon site qui sont susceptibles d'apporter un petit complément d'information aux personnes qui débutent.
Vous pouvez aussi y trouver les fiches techniques de tous les produits et colorants mentionnés.
En ce qui concerne la Fuchsine de Ziehl basique phéniquée, c'est l'exemple même d'une coloration régressive ! On colore et ensuite, on lui applique de l'acide chlorhydrique à 2 ou 1 % ! surveiller la régression et la bloquer avec une goutte d'eau.
Cette technique est utilisée couramment en mycologie par les Russulologues qui mettent en évidence la présence d'incrustations acido-résistantes sur les hyphes primordiales de la cuticule de certaines Russules... ouf !
Pour les préparations définitives ou semi-définitives, je vous conseille vivement d'utiliser les lames couvre-objet rondes : le conservateur s'étale avec une facilité merveilleuse ! Les essayer, cela veut dire "les adopter" ; on se demande ensuite comment on a pu travailler avec des lames carrées !
Toutes ces opérations (fixation, dégraissages, coloration, dégression, rinçages...) constituent autant de situations qui entraînent à chaque fois la perte de grains de pollen qui s'échappent de la préparation .... je connais le même problème pour l'étude des spores en mycologie !
La solution est simple et il suffit de réaliser un frottis à l'eau albuminée de Meyer : c'est facile et radical !
Je me permets, à ce sujet, de vous conseiller de jeter un coup d'oeil sur ma fiche microscopique intitulée "Le collage des coupes"
Tout cela peut être taxé de perfectionnisme peut-être, mais les résultats en valent la peine !
Je me permets aussi de vous signaler l'existence d'un autre conservateur : le conservateur de HOYER, qui a cet énorme avantage d'être applicable à froid !
Voici en annexe une photo de pollen de rose trémière, colorée au vert de méthyle et à la safranine et traités au conservateur de H.
Amitiés à toutes et tous
Marcel ;)
Suite images (je n'arrive as à attacher plusieurs images à la fois !)
Suite 2
Suite 3 (dernière)
-
Bonsoir Christian, Bruno et les autres !
Avez-vous déjà utilisé la safranine en solution hydro-alcoolique 50-50 ? Superbe colorant rouge pour les grains de pollen .... avec les deux autres cités par Christian, cela constitue un trio d'incontournables ....
Bonne nuit
Marcel :o)
-
Bonsoir à Christian, à Valéry et Mycète,
Je m'empresse de répondre à cet appel à l'aide, que je place dans la rubrique adéquate !
Non, Christian, c'était l'ouverture de la pêche à la mouche en Belgique, ..... et je participais à une journée d'étude des Hébélomes !
Voici un extrait de ma fiche technique relative à la potasse (hydroxyde de potassium - KOH) :
".....La concentration la plus utilisée en microscopie est, en fait, non pas de 10 % mais de 5 %. La solution à 5 % convient bien pour la plupart des observations. A 10 %, on utilise la potasse pour l’étude des champignons très durs, tels que les polypores et les croûtes, qui peuvent résister très longtemps à la dissociation dans la potasse à 5 %. Plus concentrée, la solution à 10 % exerce une action beaucoup plus rapide. Mais elle présente, d’un autre côté, le désavantage d’être très agressive et de dissoudre certains éléments, tels que l’ornementation des spores de certains Ascomycètes. Il ne faut donc l’utiliser que pour les Polypores, les Corticiés et les Clavaires, quoiqu’elle puisse être intéressante lors de l’observation des champignons gélatineux (Auricularia, Tremella), parce que la potasse concentrée liquéfie les mucilages, ce qui est d’un grand secours lors de la dissociation....."
Voici un modus operandi qui va t'aider :
1/ préparer une solution aqueuse (eau distillée) de KOH à 20 %
2/ prélever un fragment de A. mesenterica et le poser sur une lame porte-objet
3/ poser une grosse goutte de KOH à 20 %
4/ laisser séjourner de 2 à 5 minutes
5/ poser une lame porte-objet sur la préparation et presser très fortement pour bien dissocier
6/ si la dissociation est difficile, replacer une goutte de KOH et recommencer après quelques minutes
7/ quand la dissociation est suffisante, séparer les lames, et on dispose de deux préparations
7bis/ poser les lames couvre-objet
8/ colorer au rouge congo SDS ou ammoniacal et observer
9/ les éléments seront colorés en rouge : hyphes, cystides et basides cloisonnées, ..... puisque nous sommes ici dans la Classe des PHRAGMOBASIDIOMYCETES.
Dans l'Ordre des AURICULARIALES, les basides sont cloisonnées transversalement ; chez les TREMELLALES, elles sont cloisonnées longitudinalement.
Alors, Mycète, bon travail et merci de me communiquer le résultat de tes essais (photo numérique peut-être ? )
Amitiés à tous
Marcel :o)
-



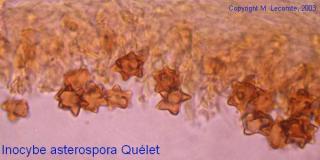
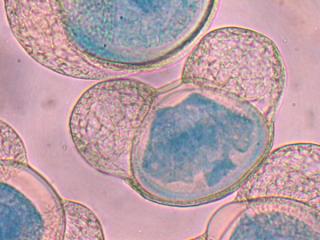
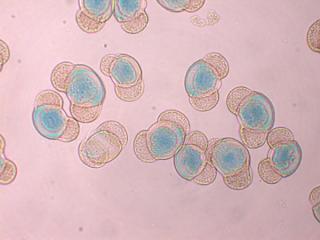

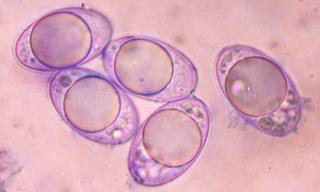








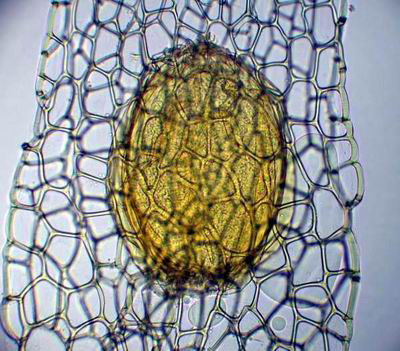
Anacamptis pyramidalis
dans Pollens et Spores
Posté(e)
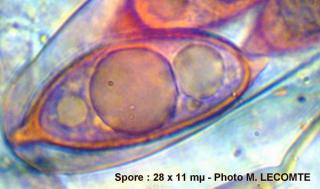
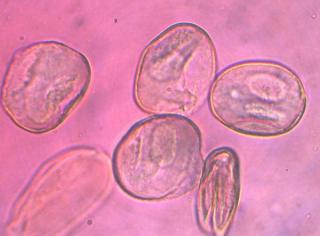
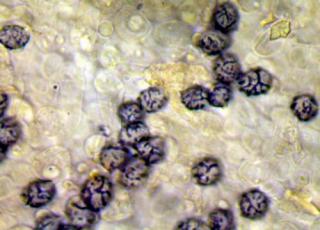
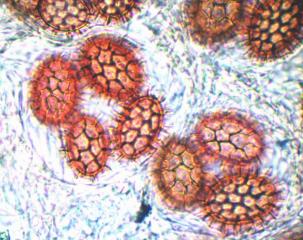
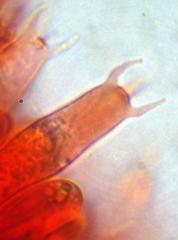
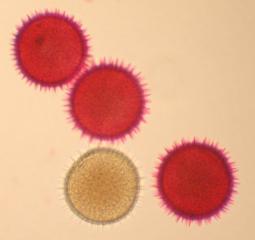
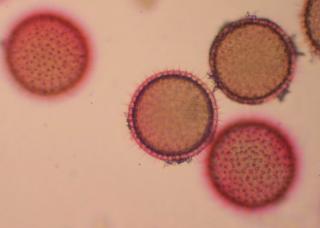
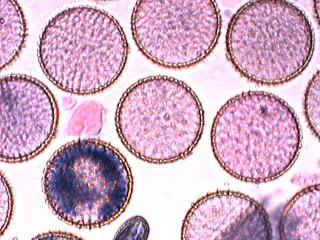
Cher Christian, je profite de l'occasion pour t'adresser un chaleureux et amical bonjour !
Tu auras peut-être du mal à trouver du pollen sur cette fleur (dont les cousines exotiques sont somptueuses), mais par contre le montage et la préparation des graines en valent la peine ! C'est une merveille ...... voir photo ci-jointe !
C'est aussi l'occasion de rappeler que chez les Orchidaceae, certaines espèces de nos régions présentent un labelle qui imite avec beaucoup de vraisemblance le corps d'un insecte femelle, sur lequel les mâles, pris de frénésie amoureuse, viennent se vautrer, emportant ainsi chez les voisines les précieux grains de pollen.
Amitiés à toi et à tout le forum
M :)