-
Compteur de contenus
148 -
Inscription
-
Dernière visite
Messages posté(e)s par Walter
-
-
Adineta
dans - Rotifères
C’est admirable Michel !
et tu l'as fait sans utiliser le flash électronique. Le détail de la tête est très bon. La seule Adineta avec la surface couverte de petits tubercules hémisphériques est appelée ..... Adineta tuberculosa. (c’est rare non ? ;) ) Mais il y a des détails qui ne paraissent pas coïncider. As-tu envoyé les images à Ricci ? elle pourrait l'identifier.
Te félicite Walter
-
Je peux ajouter qui si les coupes sont en alcool, n'importe pas le pourcentage, il suffit de les passer avec un pinceau à l'eau pour récupérer son pliabilité, et ensuite appliquer la coloration souhaitée.
-
5/ Et à la fin tu as ici une coupe longitudinale d’un petit têtard de 4 mm de longueur. Bien sur les intestins ont été fixés avec Formol neutralisé au 10%, et le têtard avec GALA 60, puis lavés à l’alcool 70 et inclus para la méthode traditionnelle. Les coupes furent faites au microtome rotatif, Ces très important de le rappeler, les coupes a la main ne seront pas si bonnes
-
-
-
-
Bonjours (tu veras ce message demain) Florente:
Je crois que ton problème plus que dans l'inclusion et la coloration (le « site » qui t'indique Olivier est très clair et détaillé, égal que la guide de Michel) sera la coupe.
Faire de l'histologie exige des coupes de moins de 10 microns d’épaisseur. Ton Ranvier difficilement te fournira moins de 20 microns, et cela tel donnera une coupe peu lisible, une fois colorié.
De toute manière, comme il me paraît que tu n'abandonnes pas facilement le champ de bataille, je te suggérerais que pour apprendre TA technique tu changes de matériel. Utilise un ver de terre (un oligochète) de quelque 0.5 cm de diamètre et suit avec des soins (en les adaptant a tes matériels) les pas bien établis indiqués par Michel et par Jussieu.
Tu découvriras sûrement que tu ne puis pas faire de l'histologie animal satisfaisante, mais la micro anatomie peut-être. Le ver de terre a une anatomie simple et bien connue. Tu pourras bien contrôler tes résultats. AH ! Après lui donner un bain a lui-même laisse ton oligochète manger et de-manger seulement végétaux bien laves, pendant 2 ou 3 jours. Tu ne voudras pas ruiner le bord précieux de ton rasoir avec les petites pierres de son intestin et des alentours.
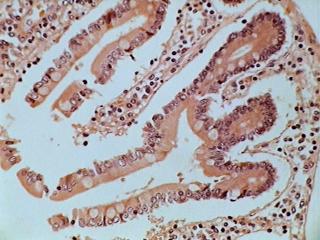
Vont ici cinq de mes échantillons d'histologie. Deux, ces qui sont bonnes, sont d'un duodénum humain coupé à 5 microns d'épaisseur.
1/x 40
-
Hydre (the end)
Merci à l'A P nous pouvons conserver des documents très représentatifs de l'animal vivant, et sauf pour des fins taxonomiques (études comparatives, description de nouvelles espèces, etc..) il n'est pas nécessaire de garder des préparations permanentes. Mais, il peut être un exercice intéressant et c'est pourquoi je donne a continuation les principes pour la préparation permanente des Hydres.
Je demande pardon parce qu'il y a peu de méthodes modernes applicables. Surtout pour l'anesthésie.
Anesthésie : Le meilleur est de placer quelques exemplaires sur une lame et de permettre qu'ils soient fixés fortement. La lame se passe ensuite à une solution saturée de CO2 jusqu'à ce que les exemplaires soient étendus et ne réagis pas. (Stagni, une chercheur italienne, elle soutient que cette méthode réussit toujours. Une solution de CO2 saturée est toute eau soda ou rafraîchissement cristallin gazéifié). Autres chercheurs recommandent l’Hydrate de Chloral (1 goutte à 2% par chaque 5 ml d'eau) il est très difficile d'obtenir ! alcool au 10%, peu efficiente; e inclusive fumée de tabac. On place les hydres avec un peu d’eau dans un godet et celui ci dans une caisse de matière plastique transparente, avec couverture hermétique et on souffle dans l'intérieur un nuage dense de fumée. Utilisez le tabac avec plus grand contenu de nicotine. ¡Peut être, je pense a ce moment, qu’à l'heure actuelle on puisse extraire la nicotine des emplâtres, pilules et autres succédanés qui sont vendus dans des pharmacies et utiliser la solution par gouttes très diluées !
.
Fixation : Gala 20%, ou y compris alcool 70%, chauffés jusqu'à quelques 60 ºC. On prend la lame avec les exemplaires anesthésiés par une extrémité et on écarte l'eau en inclinant la lame en direction contraire. En courant, l'eau étendra l'exemplaire sur le verre. Jetez maintenant le fixateur chauffé sur la lame à la hauteur du pied de manière qui court sur l'exemplaire et le fixe en extension. Submergez la lame 10 minutes dans le même fixateur froid. Vous pouvez laver en alcool 70 et conserver les hydres dans ce liquide par temps indéfini. Peut-être vous veuillez les détacher du support avec un pinceau fin (s'ils n'ont pas été détachés seules)
.
Coloration : Le colorant classique est le Carmin chlorhydrique, boracique ou acétique. Cherchez des formules dans le WWW, ou mieux achetez les produits de Marcel Lecomte. On peut aussi utiliser de l'éosine. Utilisez la solution désinfectant commercial à 2% en la diluant jusqu'au 0.5 %. Laissez les exemplaires dans le colorant jusqu'à ce qu'ils soient teints intensément, et lave avec de l’eau acétifiée (vinaigre blanc) jusqu'a qu'il ne détache pas d'autres nuages de couleur. Terminez en lavant en eau avec 10% de glycérine. Laissez- les 30 min. dans cette dernière solution.
Montage: Utilisez Gélatine glycérinée, ou PVA-G qui n'ont pas besoin d'une déshydratation. Si vous aimées les choses compliquées déshydratez par la série d'alcools (30-50-70-90-100-100) passez à eugenol comme éclaircissant (n'utilise pas le xylol parce qu'il tourne les petites pièces très cassables) et monté en Baume du Canada. NE VOUS OUBLIEZ PAS D'ETIQUETER ADÉQUATEMENT LA PRÉPARATION.
Bon : bonnes sessions de laboratoire. ¡Pitié que a Cancún il n’y a pas des hydres !
J’attend les photos.
WALTER
-
Hydres (suite, 2)
Dissociation.- Placer une hydre dans un godet et extraire presque toute l'eau. Ajouter une goutte de Dissociateur de Bella-Haller. Après 30 seconds décaler rapidement le liquide en l'absorbant avec papier de filtre et ajouter une goutte de violette de méthyle. Laisser agir 2 min. Et décaler le colorant avec papier de filtre. Laver avec un ou deux gouttes d'eau. Ajouter une lamelle et le frapper doucement (avec le doigt ou l’arriere d’un crayon) pour que les cellules se séparent. Afin d'identifier le maximum possible de types de cellules, préparer de deux a trois macérés. Ils doivent pouvoir être identifié au moins : Cellules endodermiques épithéliomusculaires, Cellules glandulaires, Cellules ectodermiques épithéliomusculaires, Cellules interstitielles, Cellules nerveuses et Cnidoblastes, avec cnidocystes
Liquide de Bella Haller
Eau distillée...................................50 ml
Acide acétique glaciaire..................25 ml
Glycérine.......................................25 ml
Violette de méthyle
Eau distillée...................................100 ml
Violette de méthyle.........................0.5 g
Acide acétique glaciaire...................0.20 ml
L'acide acétique est essentiel dans ce colorant et s'il faille parfois en colorier les noyaux, l'addition des quelques gouttes d'acide acétique restaurent généralement son pouvoir. Au lieu de violette de méthyle il peut être utilisé vert méthyle, ou violette de gentiane ou fuchsine acide, et encore bleue de méthylène.
Celui-ci c'est une méthode rapide et les préparations une fois utilisées sont écartées. Si on souhaite conserver des préparations de cellules dissociées il faut utiliser une méthode beaucoup plus longue et compliquée.
-
Hydres (suite)
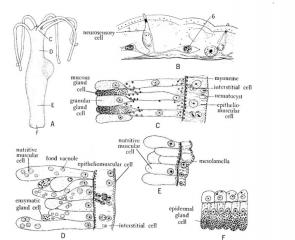
Le corps des hydres est formé par deux couches "endoderme" interne, et "ectoderme" externe.
Dans l'ECTODERME il y a 4 types de cellules. 1 - Les cnidoblastes que nous avons déjà vus. 2 - Le cellules épithéliomusculaires, assez bien reconnaissables, parce qu'elles sont cylindriques, légèrement élargies dans l'extrémité apicale, et avec la base élargie vers les côtés, parce que là se logent des fibres musculaires, 3 - les cellules interstitielles, petites, arrondies ou en forme de poire, généralement situées entre la base des autres cellules, et 4 - celles plus difficiles à reconnaître, qu'ils sont les cellules sensorielles et nerveuses, plus ou moins ovoïdes ou pyramidaux de base interne, quelque fois petites, mais souvent élargies jusqu'à la surface, avec l'extrémité apical qui montre souvent une cil ou une prolongation sensitive. Vous aurez beaucoup de fortune si pouvez reconnaître une neurone, de cytoplasme globuleux, avec prolongations latérales minces, qui sont les dendrites.
Le ENDODERME est appelé souvent gastroderme, parce qu'il couvre la vaste cavité gastrique de l’hydre. Les cellules qui le forment sont généralement (mais il dépend de l'état d'alimentation de l'animal) plus grands, et surtout plus longues que celles ectodermiques.
Ils ont aussi : 1 - cellules épithéliomusculaires avec cils ou flagelles dans l'extrémité apicale pour faire circuler les aliments. Ont des grands noyaux et la déjà connue couche de fibres musculaires dans la base. Si on pouvez les observer en action il serait vu qu'ils ingèrent l'aliment par phagocytose, comme le font les amibes, en formant des vacuoles alimentaires qui peuvent être reconnues dans le cytoplasme. 2- les cellules sensorielles semblables à celles ectodermiques et 3 - deux autres types de cellules spéciales. A) les cellules glandulaires qu'ils produisent des enzymes dans des vacuoles du cytoplasme et s’ouvrent et vident dans la lumière de la cavité gastrique. Évidemment en le faisant elles meurent, et sont remplacées par B) de nouvelles cellules glandulaires développées à partir de petites cellules basales, situées contre la mesoglée. Normalement vous pouvez voir quelques cellules glandulaires qui ne se sont pas ouvert
Le mesoglée c'est en réalité dans les hydres, une couche basale fine sur laquelle se soutiennent d'une part l'ectoderme et d'autre part. l'endoderme. Pratiquement on ne la voit pas.
L'image a ete prisse du texte de L.H.Hyman "The invertebrates" je crois que cést pas necessaire de traduir le texte. Cést tres clair. Dans la colonne de l'hydre sont signalés les lieus auquelles appartienent les details des tissues.
On peut bien voir ces cellules et les différencier, dans des coupes commerciales transversales ou longitudinales effectués avec un micromètre et coloriés adéquatement...... Ou... on peut réussir à effectuer une dissociation de l’hydre comme je vais expliquer ensuite.
-
Ici sont des notes pour mieux étudier les hydres. Se rappeler que mon Française est pensée en espagnol, que le thème exige beaucoup de termes techniques et que les dictionnaires à ma disposition manquent la grande majorité. Pardonnez moi les inévitables erreurs.
Horaba:
Tu as déjà une culture initiale, donc nous partions de ce fait.
L’eau pour cultures secondaires devra être libre de chlore, de plomb et de cuivre o tout autre métal lourd. C’est meilleur d'utiliser de l'eau déminéralisée (potable commercial).
Il peut être utilisé avec avantage de l’eau filtrée, obtenue de la même mare où vivent les hydres.
Tes hydres se nourrissent par elles-mêmes en utilisant des copépodes. Peut-être ils arrivent à un équilibre (moins copépodes, moins des hydres, augmentent les copépodes, augmentent les hydres, et répètent le cycle) mais le plus probable est que les hydres terminent avec les copépodes, parce que ceux-ci sont très difficiles à nourrir, et ils se meurent de faim.
Solution : 1) filtrer de l'eau de la lacune par une toile avec maille 250 microns, approx. (Toile pour des rideaux de "voile") et les ajouter les microcrustacés recueillies, ou 2) cultiver des cladocères.
Si tu te décides pour cultiver les hydres pendant un long temps je te passerai certains méthodes pour cultiver les cladocères.
Si non, passons à la seconde partie.
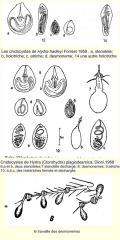
Les CNIDOCYSTES.
Ils sont les structures les plus frappantes des hydres et sont suffisamment typiques comme pour qu’on les utilise dans la différenciation des espèces. Il y a 4 types de cnidocystes. Son étude est faite généralement dans le vivant, avec l’exemplaire légèrement comprimé, de sorte que les tentacules et la colonne sont un peu écrasés et on peut distinguer les différents types.
Ils sont petits (voir les échelles dans les dessins), de sorte qu'il est nécessaire d'utiliser l’objectif 100x en immersion. Rappeler de sceller avec une goutte d'émail a ongles les quatre coins de la lamelle pour qu'il ne se déplace pas. Sceller les flancs il est un opération facultative, mais convenable
Le cnidocystes ont des structures internes filamenteuses qui est nécessaire identifier. Ceci DOIT être fait en fond clair, parce qu'ils sont des structures très réfringentes et en Contraste de Phase ne laissent pas voir l'intérieur. On aura besoin généralement de 3 o plus MAP pour reconstituer postérieurement la structure avec CombineZ-5.0 ou avec Hélicon. (Occasion pour une collaboration avec Foto-Pol) Au contraire le Contraste de Phases sera utile pour étudier les détails des épines des cnidocystes déchargés.
Les diverses sortes de cnidocystes sont :
a) les sténotèles. Ils sont les plus connus et illustrés. Sont les plus grands, Avec une armature interne de grosses épines et un filament urticant enroulé qui est celui qui transmet aux victimes le poison paralysant..
B) Les desmonemes. De forme ovoïde, avec un filament court et lourd généralement enroulé avec un seul tour.
c) Les atriches, sont ceux plus petits, ovoïdales de profil élargi, avec un filament mince, très densément enroulé, qui remplit toute la capsule.
d) Les holotriches, dans mon espèce ils ont aussi une forme ovoïdal, mais dans presque toutes les autres hydres ils ont la forme de sole de chaussure, avec la partie antérieure plus large occupée par quelques tours de filament plus lourd et ensuite une série de tours qui dans mon espèce sont inclinées ou sont horizontales et dans les autres sont verticales.
Si on veut décharger les cnidocystes suffit d'ajouter une solution faible d'acide acétique, ou meilleur de fuchsine acétique, qui en outre colorie les éléments. Remarquer que les cnidocystes ne sont pas des cellules, ils sont organelles spéciales qui sont produits à l'intérieur de cellules qui sont appelées cnidoblastes. Un détail intéressant est que bien que la décharge chimique soit efficace, les cnidoblastes ont un appendice appelé cnidocil, qui répond au contact de la proie en déchargeant le cnidocyste.
Nous verrons demain les autres cellules des hydres. ;)
-
Bonjour a tous!
LA RECHERCHE DU SANG
Notes et techniques…
L'intérêt de Drak à observer le sang, m'a fait penser que moi, et peut-être tous les microscopistes avons eu à un moment donné un intérêt tout particulier pour lui. Mais presque toutes les informations disponibles sont de type professionnel. Il semblerait que le sang ne soit pas un sujet pour amateurs et pourtant il l’est légitimement comme le démontrent les excellents messages postés sur ce sujet.
C'est pourquoi j'ai décidé d'écrire ces lignes à partir de mes mémoires, et c'est pourquoi elles ne sont pas illustrées. Je devrais perdre beaucoup de temps pour appliquer les techniques, et effectuer les photos, ou simplement en demander autorisation aux auteurs pour reproduire les leurs. J’ai d’autres urgences à ce moment. Ainsi, j’ouvre ce nouveau thème.
Plusieurs éléments de ces notes recoupent certaines écrites par mPx, dans le Forum ou dans les Pratiques pour débutants, niveau 2, du Magazine Microscopies, ou bien celles de Jean-Marie Cavanihac dans les mêmes sources. Mais ici ces éléments seront détaillés pour pouvoir en faire une synthèse à la portée de l'amateur microscopiste lui permettant des recherches sur un tissu tellement important qu’est le sang. J’ai laissé de coté la théorie, parce qu’elle a été parfaitement couverte par mPx et Dominique (Spironucleus).
EXAMEN DE SANG HUMAIN.
Récolte : Pour utilisation professionnelle, les hématologistes ont généralement l’habitude de prélever du sang veineux dans un tube qui contient de l'héparine (ou un autre anticoagulant) et de là ils prennent des échantillons pour tous les examens dont ils ont besoin.
Mais plus souvent la reconnaissance des cellules sanguines ce fait à partir d'une goutte de sang obtenue du réseau de capillaire superficiel par simple ponction d'un doigt, ou du lobule d’une oreille, avec une lancette. Celui-ci est la méthode la plus utile pour le microscopiste amateur.
La lancette peut simplement être remplacée par une aiguille. On doit éviter des blessures importantes et pour cela, il est nécessaire de couper un cylindre de bois doux de longueur adéquate, ou utiliser un bouchon de gomme. L'aiguille sera enfoncée dans un de ces supports ne laissant dépasser la pointe que de 2.5 - 3 mm. Cette "lancette" sera conservée immergée dans de alcool à 70% jusqu'au moment de l'utilisation.
Un coton humecté d'alcool sera frotté sur l’extrémité d'un doigt pour le désinfecter et une fois l'alcool évaporé, on effectuera une ponction rapide. On récupèrera sans retard la goutte qui perle pour éviter sa coagulation. Ceux qui ont un parent diabétique qui dispose d'un kit pour dosage de la glycémie, pourront y trouver une lancette professionnelle.
OBSERVATION :
a) Sang frais. Une goutte de sang est placée sur une lame et couverte d’une lamelle. L'examen est décevant par la grande quantité de globules rouges accumulés qui empêchent de voir tout détail.
b- Sang frais, avec dilution préalable. Le sang peut être dilué pour éviter l’effet ci-dessus. Mais on ne peut pas faire ceci avec de l’eau ordinaire ou de l'eau distillée. Les globules exploseraient sous l'effet de la pression osmotique. (Voir le travail correspondant de mPx, dans le Forum Principal de MikrOscOpia, pour comprendre les effets de la pression osmotique) Pour les vertébrés en général on prépare une solution qui contient 9 g de sel de cuisine dans 1 litre d'eau déminéralisée que l’on trouve dans les supermarchés comme l’eau pour fer à repasser.
(Cette solution préparée par un professionnel, à partir d’eau bidistillée et de Chlorure de Sodium très pur est appelée Solution Physiologique (ou Sérum physiologique NDT), et peut être acquise en Pharmacie)
Pour l'observation, prélever dans une seringue à insuline 0.5 ml de la solution physiologique (professionnelle ou faite à la maison) et prélever une grande goutte de sang, en agitant la seringue pour homogénéiser la dilution. (Prélever jusqu'à ce que toute la goutte plus une petite goutte d'air soit entrée dans la seringue. Ceci est dans le but d’ éviter que le sang ne coagule dans l'aiguille hypodermique. La goutte d'air aide à diluer le sang dans le liquide) Une goutte très petite de cette dilution entre lame et lamelle, sera étendue en une couche très fine qui montrera bien les globules rouges, et en utilisant au moins un grossissement de 400x (obj. 40, oculaire 10) vous permettra de voir de très petites gouttes transparentes et ameboidales que sont les globules blancs, se déplaçant dans le fonds de la préparation. Il convient de fermer avec de la Paraffine, VAPA, VALAP ou Vernis à ongles, pour avoir davantage de temps pour l'observation. Si on ne fait pas ça, la goutte sera immédiatement séchée. Voir les globules blancs exigera apprendre à manier avec habileté l’éclairage. On peut utiliser avec succès des disques pour éclairage oblique. Le plus simple est la Flèche de Mathias, (voir dans le Magazine.)
c) Dans une préparation humide, fixée et colorée. Pour observer avec du temps et avec détail une préparation de sang frais, on peut utiliser une modification de la vieille méthode utilisée par les hématologistes pour compter des globules blancs.
Nos outils de base seront une seringue à insuline de 1 ml, un récipient gradué au moins jusqu'à 100 ml (j’utilise un biberon) et la solution suivante.
Liquide de Türk: acide acétique 1 ml, (ou 3 ml) eau distillée 100 ml. Colorer cette solution au bleu méthylène ou violet de gentiane (solutions à 1% préférablement récemment filtrées, jusqu'à un ton défini, mais qu’il soit encore transparent.)
Notes: Le violet de gentiane est vendu dans les pharmacies en solution à 1%, pour utilisation externe comme fongicide. Le bleu de méthylène est vendu en petites quantités, dans des bouteilles compte-gouttes, en solution à 1% pour aquariophilie. Parfois il a un peu de formol. Il n'interfère pas. L'acide acétique à 1 pour cent est obtenu facilement en diluant 20 ml (ou 60 ml, pour 3%) de vinaigre blanc commercial jusqu'à arriver à 100 ml avec de l’eau distillée.
Observation des globules blancs : Prélever à la seringue 0.1 ml de la solution colorée d'acide acétique. Prélever maintenant très rapidement une lourde goutte de sang frais et agiter immédiatement et soigneusement la seringue pour homogénéiser. La goutte doit être aspirée jusqu'à ce qu'une petite goutte d'air entre dans la seringue. Celle-ci aidera à homogénéiser la solution. Il peut être nécessaire d'aspirer une seconde goutte de sang.
La solution détruit les globules rouges, elle tue et fixe les globules blancs et colore leurs noyaux. Examiner une petite goutte de la suspension entre lame et lamelle, en scellant les bords. Utiliser un grossissement de 400x. Les globules blancs auront leur noyau coloré en bleu, ce qui facilite leur observation. On ne verra pas les globules rouges.
Exercice :
Combien de globules blanc vous rencontreriez dans votre préparation si 1 mm3 de sang a une moyenne de 7000 globules ?
Votre seringue à insuline a une capacité de 1 ml et est divisée en 100 parties, chacune d’elles équivaut à 10 mm3
Une très grosse goutte de sang, ou plus d’une si elles sont plus petites, peuvent arriver à un volume de 20 mm3 (soit 2 divisions de votre seringue, et 140 000 leucocytes). Si vous aspirez la solution de Turk jusqu’a 10 divisions, vous aurez une dilution de 20%. C'est-à-dire : 10 divisions contiennent maintenant 140 000 leucocytes en suspension.
Sous une lamelle de 24 x 24 mm vous pouvez mettre sans excès 2 divisions de la seringue, c'est-à-dire que vous deviez avoir sous elle, 28 000 leucocytes.
d) dans un frottis.
Un frottis est l'étalement d'une goutte de sang sur une lame, en couche très fine qui diminue d’épaisseur jusqu’ à son extrémité. Les globules sont étalés en une seule couche de cellules qui ne se touchent pas entre elles, afin de voir les différents éléments qui la composent.
Effectuer un frottis implique tuer et fixer les éléments du sang pour qu'ils soient conservés, et les colorer pour les différencier.
Pour préparer le frottis on a besoin :
1) D’une lame très bien dégraissée, pour permettre un étalement régulier et mince. La lame est préparée en l’immergeant quelques minutes dans l’alcool à 96%, puis on la sèche avec un chiffon qui ne laisse pas du duvet, puis on la passe dans la flamme d'un bec Bunsen ou d’une lampe à alcool, avec mouvement lent mais continu. Le passage par la flamme doit durer quelques 3 secondes. Ceci fait que la surface est propre, dégraissée et mouillable uniformément.
2) Une autre lame à laquelle, on a coupé les deux angles d’une extrémité avec des pinces d'électricien ou mécanicien, de manière à laisser un bord central de 3 ou 4 mm plus petit que la largeur normale de la lame. Ceci a pour but que le sang occupe une bande plus étroite que la lame et rende plus facile l’étude des bords du frottis.
3) Un bec Bunsen avec une faible flamme, ou une lampe à alcool, pour fixer les cellules par la chaleur.
Réalisation du frottis.
A 1.5 cm. Approximativement d'une extrémité de la lame on place une goutte de sang. Le petit bord de l’ ‘étaleur ’ est soutenu sur la lame à peine devant la goutte et on le fait reculer jusqu'à ce que il entre en contact avec cette dernière. La goutte de sang sera étendue tout au long du bord. Avec un élan soutenu on fait avancer l’ »étaleur ». (Pas de saccades, pas de changement de vitesse) Par derrière, le sang sera étendu en couche très fine. Si la goutte était approprié, l’étalement se terminera par une langue très fine à 1.5 cm du bord opposé. Ceci fait, on l’agite dans l'air rapidement jusqu'à ce qu'elle perde sa brillance, et on la passe, 3 fois lentement dans la flamme du brûleur. Ces manipulations étendent dans une seule couche les globules, ils les tuent et les fixent suffisamment pour les manipulations suivantes. Peut-être on n'obtiendra pas un frottis parfait à la première tentative, mais la pratique le permettra.
Inonder le frottis (ou submerger la lame dans en flacon) avec alcool éthylique 96%, ou alcool méthylique 95%, laisser agir une minute et égoutter l’alcool. Dans le flacon vous pouvez garder les lames jusqu’à leur utilisation. Inonder le frottis avec la solution de bleu de méthylène au 0.1%, ou Violet de Gentiane à 0.025%. (Évidemment ces solutions sont préparées en diluant la solution mère à 1% avec la quantité adéquate d’eau distillée.) Laisser agir 1 minute.
Egoutter et sécher à nouveau en agitant le frottis dans l'air. Ce frottis aura les globules rouges et blancs fixés y ces derniers, leurs noyaux colorés.
Observation du frottis.
Si on a un objectif de 40x, deux petites gouttes d’huile d’immersion se placent à équidistance sur le frottis. Sur chaque goutte est appliquée une grande lamelle de sorte qu'on forme une très fine (très fine !) couche. Les lamelles sont maintenues avec des gouttes de vernis à ongles dans leurs coins, puis on laisse bien sécher avant d'observer.
Si on a un objectif à immersion on met une grande goutte d'huile d'immersion directement sur le frottis, sans lamelle. En surveillant par le flanc on fait descendre l'objectif jusqu'à ce qu'il soit presque en contact avec le frottis. Alors, en surveillant à l’oculaire on lève lentement l'objectif (dans les microscopes modernes on descend la platine) jusqu'à ce que l’on distingue nettement les cellules.
Le frottis doit être exploré soigneusement. Les globules blancs sont petits. On pourra apprécier les différentes formes de noyaux et les différentes tailles de ces cellules, comparant avec l'uniformité du diamètre des globules rouges. Ces derniers ont 7 microns de diamètre en moyenne.
e) Coloration métachromatique du frottis.
Les leucocytes sont de différentes formes et fonctions. On peut reconnaître :
Granulocytes (neutrophiles, éosinophiles et basophiles), et mononucléaires (lymphocytes et monocytes). (Voir sa description, chez Domimique Prades)
Des neutrophiles peuvent être classés en 2 catégories. Les cellules en bande, non mûres, avec noyau sous forme de bande en fer à cheval, et le polynucléaires, dans lesquels la bande apparaît avec des étranglements qui séparent des globules d'un plus grand diamètre.
Romanowski a découvert une coloration, améliorée ensuite par May-Grünwald et Giemsa, qui permet de différencier par la couleur spécifique de leurs inclusions cytoplasmiques (granules) et bien sur par la forme caractéristique de leurs noyaux, diverses classes de leucocytes (globules blancs). En Europe c'est la coloration la plus utilisée. Pour investigation parasitologiques du sang on utilise en Europe fréquemment le colorant de Laveran. En Amérique du Nord on utilise souvent le colorant de Wright, méthode plus facile bien que ses résultats ne sont pas tellement voyants.
Je peux vous donner la formule et méthodes de préparation de tous ses colorants. Ils ont comme base des dilutions de bleu de méthylène, Azur I et Azur II, plus Eosine. Les techniques sont très laborieuses et ne se justifient pas si on peut obtenir le colorant préparé commercialement. Sauf pour la satisfaction du bricolage.
Dans les techniques pour débutants du Magazine Microscopies la méthode de May-Grünwald-Giemsa (MGG) est décrite en détail, et on y offre des exemples de tous les types de leucocytes différenciables avec cette technique, et vous avez en plus les incroyables illustrations à 3000 X ou plus à l’écran, fournies par Dominique II.
Toutefois, si on veut seulement observer une paire de frottis d'essai, il n'est pas raisonnable d’acheter( cher), une bouteille de réactif. J'ai obtenu de magnifiques frottis de sang humain normales et pathologiques en visitant quelques laboratoires d'analyses cliniques, expliquant ma condition de microscopiste amateur, ou de professeur au Lycée (quand je l'étais) et en sollicitant quelques frottis qu'ils allaient écarter. Je ne suis presque jamais sorti les mains vides.
Méthode Cubaine de coloration.
Le blocus américain rend difficile l’obtention de colorants traditionnels dans l’île. A l’Institut Finlay, de recherches, quelques médecins ont tenté de substituer le Romanowsky par des méthodes plus simples.
Ils ont réussi, par le même chemin recommandé par JMC, en usant simplement du bleu de méthylène et de l’éosine.
Voici un aperçu de sa technique
1 Fixer la lame avec solution alcool formol 5% pendant 1 minute.
2 teindre avec éosine 0.1 %, 5 min. Laver à l’eau courante.
3 Teindre avec bleu de méthylène 0,1 %, 5 min. Laver à l’eau courante.
Sécher à température atmosphérique.
Dans le travail suivant il est fait une comparaison détaillée avec la méthode de Giemsa.
http:\\www.bvs.sld.cu/revistas/onc/vol16_1_00/onc08100.pdf
Le résultat le plus important (surtout pour l'amateur microscopiste) est que cette méthode tellement simple permet de reconnaître tous les groupes morphologiques de granulocytes, avec toutefois une lacune (ce qui c’est important pour le médecin dans certains cas, mais pas pour l'amateur débutant) dans la différenciation sûre en deux catégories des leucocytes mononucléaires : lymphocytes et monocytes. Pour de nombreuses maladies du sang cette méthode très simple a été proposée pour son utilisation à des l'hématologiste professionnel, donc elle fournit toute l'information nécessaire.
SANG D’AUTRES VERTÉBRÉS
Il y a des différences intéressantes évidemment entre les différentes espèces. Par exemple le cheval a des éosinophiles spectaculaires.
Les poissons, amphibies et reptiles (en incluant ses parents les oiseaux) ont des érythrocytes nucléés.
Le microscopiste qui souhaite faire des recherches en hématologie sur d'autres espèces doit apprendre comment prélever les échantillons. L'oreille, avec ses veines marginales est un emplacement préféré pour presque tous les mammifères.
La ponction de la peau dans le bord d'une aile est adéquate pour la majorité des oiseaux. Les herpétologistes ont l’habitude de couper l'extrémité d'un doigt aux batraciens et aux lacertiliens, etc. Dans tous les cas ne pas oublier de désinfecter le lieu de ponction et la lancette, ciseaux ou bistouri.
En prime pour ceux qui font des recherches sur ces sangs, surtout ceux des poissons et batraciens, est que, dans des préparations de sang frais dilué, ils pourront très souvent reconnaître des parasites sanguins, comme les trypanosomes, (protozoaires flagellés) ou micro filaires (nématodes), étant donné leur mouvement ondulant entre les globules. Ils pourront aussi les observer colorés, en faisant le frottis.
SANG D'INVERTEBRES :
Tous les invertébrés ont dans leurs hémocoeles, un sérum liquide, l'hémolymphe, avec des cellules semblables aux leucocytes. Ils n'ont pas des globules rouges. Ceux des invertébrés qui utilisent l’hémoglobine pour améliorer le transport d'oxygène, l’ont dissoute dans leur hémolymphe.
Un exemple vient des tubifex, oligochètes rouges que beaucoup d'aquaculteurs fournissent à leurs poissons comme aliment.
Celui qui souhaite entrer dans ces recherches devra évidemment apprendre l'anatomie des espèces sur lesquelles il veut faire des recherches (Internet, Livres de Zoologie, Traités de pratiques de Laboratoire de Zoologie) et la façon d'introduire son matériel de prélèvement dans l’hemocele ou le cœur de ces dernières. Dans ces cas on utilise normalement des Pipettes Pasteur pour extraire l'échantillon et on obtient de petites quantités qui peuvent à peine couvrir la surface d'une lamelle.
Insectes, arachnides, mollusques (escargot de jardin, palourdes de rivière, crabes de rivière et mer, huîtres) sont quelques candidats à la recherche.
L'observation dans le vivant est une première étage, suivie par la coloration de Giemsa (dans des recherches très sérieuses), ou par la méthode cubaine, plus à la portée des microscopistes.
L'histologie normale exige des instruments coûteux et des techniques compliquées. (Voir les Instructions pour débutantes (niveau 3) dans le paragraphe de Pratiques du Magazine Microscopies) le sang est un tissu relativement facile pour faire des recherches. Bien que n'apportant pas la diversité fantastique des diatomées ou des micro-invertébrés offerte au microscopiste, le sang est un sujet passionnant et peut être que ces notes encourageront quelqu'un vocations à entreprendre une série personnelle de recherches.
WD
-
Bonjour à tous :
Bonjour André (Aphylla)
J'étais dehors pendant quelques jours. La dernière fois que j’ai visitée le forum il y était cet intéressant problème du rotifère présenté par André. Je pensais qu'elle étais déjà identifié, comme il ne l’est pas j'apporte ma contribution :
Il n'est évidemment pas un bdelloid
Les monogononta peuvent a - avoir des orteils (1 ou 2) ou disques adhésifs ventraux
b - ne pas avoir orteils ni disques
Évidemment notre monogononta a un pied, avec 1 doigt. (C’est à dire qu’il n'a pas une prolongation qui se termine par un gobelet ou un disque adhésif)
Les monogononta de ce type peuvent avoir lórica ou non
Celui-ci n'a pas lórica. Une différence facile à vérifier dans ces rotifères sans lórica est si le pied plus les orteils ils sont plus longs que le corps, ou s'ils sont plus courts.
Dans ce cas ils sont plus courts ou égaux, c'est-à-dire le segment du pied ajouté au segment du doigt il paraît égal ou plus court que le corps.
Les trophi ne sont pas forcipés et la forme du corps est différente de ce qui correspondrait à un Dicranophoridae, que pouvait être une option.
.
Avec trophy d'un autre type j'ai seulement deux options :
1) Tetrasiphon Ehrenberg qui se caractérise pour avoir deux longues antennes latérales terminées en pointe, près de le pied et avec un corps élargi et des pieds très courts.
2) Microcodon, Ehrenberg, espèce côtière d'eau douce avec la structure qu'ils montrent les photos d'André. Et avec des plaques pourpre juste sur le mastax, probablement l’hypopharinx
De Microcodon j'ai la référence d'une seule espèce. Mais ma bibliographie n'est pas mise à jour. L'espèce c’est Microcodon clavus, Ehrenberg, 1830, apparentement avec quelque 200 microns de longueur.
Edmondson, et Hyman (1951) soutiennent qu'il y a une seule espèce
Selon : http ://www.nies.go.jp/chiiki1/protoz/morpho/rotifera/r-mic-on.htm il y a 3 espèces. Ceux qui aient une meilleure bibliographie ils pourront travaillier plus à fond dans la détermination de cette espèce.
Koste, dans ce travail : http ://www.naturwissenschaftlicher-verein-os.de/onm/onm27/koste.pdf il identifie aussi un seul Microcodon. Sa figure se ressemble plus à l’individus d'André que celle de Hyman (chercher par Abb.26)
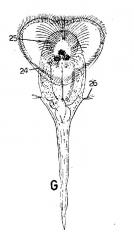
J’ajoute une image copiée d'une plate de Hyman - "The Invertebrates" Vol III, qui je crois que, tout comme celle de Koste, est assez convaincant.
a bientôt Walter
-
Le problème des mesures environnementales n'est pas simple. Pour connaître bien un habitat on doit avoir accès à un laboratoire de chimie limnologique, ce qui est totalement dehors de la portée d'un amateur moyenne.
Un petit livre de Limnologie énumère les paramètres suivants :
Température, (en fonction de la profondeur et de son cycle journalier)
Transparence
Intensité lumineuse et composition spectrale de la lumière selon la profondeur
Mesure de la vitesse de flux des eaux courantes
Granulométrie des sédiments
pH (variation pendant le jour)
Dioxyde de carbone libre
Oxygène dissous (et son cycle quotidien) et ceci pondéré par le salinité de l'eau et la hauteur au-dessus du niveau de la mer à laquelle il est fait le échantillonnage
Ammoniaque dissoute
Phosphates dissous
Alcalinité
Dureté par calcium et dureté totale
Matière organique dissoute (mesurée par BOD ou par oxydation avec bichromate)
Évidemment une analyse totale de la qualité de l'eau il implique en outre la détermination de tous les anions et les cations présents.
Et celle des bactéries indicatrices de pollution humaine ou animale (coliformes totaux, coliformes fécaux, streptocoques)
Chaque paramètre exige un échantillon pris dans des conditions adéquates. Par exemple pour l’oxygène l'échantillon doit être pris dans un échantillonneur tel qui évite la pollution de l'échantillon avec l'oxygène atmosphérique. On ne peut pas prendre l'échantillon pour oxygène en submergeant une bouteille et en laissant qui l’air soit expulsé en entrant l'eau, cela est suffisant pour varier la concentration de l'échantillon.
Une première étape vers la simplification est fait par les aquiculteurs qui ont besoin de connaître l'atmosphère dans laquelle vivent ses poissons ou ses crevettes ; ils existent des kits pour la détermination de tous les paramètres importants, faites par Hach ou Lamotte par exemple. Et celui qui veut les obtenir ne doit pas plus que chercher dans Internet par ces marques pour trouver la liste des paramètres déterminables. De mon point de vue comme amateur sans moyens économiques importantes, ceux kits-là sont presque tellement hors de portée comme le laboratoire de chimie limnologique.
Les aquariculteurs ont baissé une autre étape et quelques marques comme Tetra ou Aquapharm produisent kits aptes pour l'aquarium qui peuvent être considérés à la portée de beaucoup d'amateurs, selon je vois le niveau économique des membres de ce Forum, mais sa sensibilité est celle qu’ils ont besoin pour comprendre ce qui passe dans un aquarium, non dans un lac, rivière ou mer.
Toutefois données comme température, transparence, dureté, pH et de l'oxygène dissous, peuvent aider à comprendre d'où vient un certain échantillon. C’est meilleur que rien. On a besoin seulement de 2 kits, dureté et pH, un thermomètre et un disque de Secchi, ou quelque chose semblable, et quelques produits chimiques (et connaissances adéquates de chimie et travail en laboratoire comme le travaille avec balances analytiques, dissolutions jaugées, titulations avec des burettes etc..) pour arriver a déterminer l'oxygène.
Toutefois il y a des appareils électroniques pour mesurer des pH, Oxygène dissous, conductivité, tout dépend de l'argent que chacun peut investir. Il passe avec ceci la même chose qui avec les microscopes.
En définitive, je ne crois pas qu'on puisse généraliser la prise de paramètres environnementaux. Je serai reconnaissante pourvu qu'on ajoute ces données à un échantillon. Mais je crois que dans la majorité des cas nous devrons se conformer avec le pH, (Kit pour aquariums, avec sensibilité de 1 unité de pH) dureté (kit pour aquariums) Température (sensibilité 1 degré Celsius) et transparence (disque de Secchi) ou substitut. Ce qu'implique un investissement modeste et décrit grossièrement l'atmosphère de l’endroit ou l’échantillon fut pris.
Ouf ! :angry: C’était très long pour arriver ici.. Pardonne mois touts les « horreurs » :unsure:
-
Mes deux chers lecteurs : ;)
L'Extracteur se prête évidement a assez d’expérimentation. La plus évidente est certainement celle qui indique JMC d'utiliser des lumières de différentes couleurs, pour échantillonner peut-être sélectivement déterminés taxons. Comme n'est impliquée aucune sédimentation, mais tout le contraire, je ne crois pas qu'incliner l'appareil puisse augmenter la vitesse de translation vertical des micro-invertébrés. Mais oui, je pense qui pourrait aider à des animaux qui glissent sur le substrat, (turbellariés, nématodes, micro-oligochaetes) à chercher une sortie de la position inconfortable dans le fonds de la bouteille. Je pense qu'une autre option est de placer le récipient en eau réchauffe pour augmenter la vitesse de détérioration de l'ambiance et mobiliser plus a quelques espèces. Je n'ai jamais fait ces tentatives. Si quelqu'un les fait il serait intéressant de connaître les résultats.
Merci pour votres commentaires
Walter
JMC : je crois que maintenant je puis recevoir correspondance. Fait en nouveau intente !
-
Il est certainement un autre chaetogaster
-
Bonjour à tout le forumistes :
Bonjour Bruno :
Je suis retournée à Cancún après des jours d'absence, donc certaines de mes interventions seront sur des sujets qui ont dormi le même temps sans une réponse.
En ce qui concerne le cilié mystérieux, je crois que nous pouvons déjà lui donner un nom. Au niveau générique, comme il correspond (les hypotriches ont 216 genres et 1186 espèces dit quelque auteur)
Avec presque sécurité on peut assigner le « cilié de Morbihan » au genre URONYCHIA (avec des ongles dans la queue, le nom paraît assez approprié). Un petit video assez révélateur peut être trouvé dans le deuxième de cette série de 4 :
http ://internt.nhm.ac.uk/jdsml/zoology/protistvideo/list.dsml ?GENUS=Uronychia&list=gallery
¡Bonne chasse en Morbihan ! :D
Walter
-
Et bien, mes chers amis, pour rentrer dans les Forums, je souhaitait faire une nouvelle présentation de ma personne, parce qu'íl y a maintenant beaucoup de gens nouveaux. :huh:
Et, recommencer évidemment mes interventions avec une certaine suggestion intelligente, et pourquoi non, éblouissant. ¡Il n'est pas possible pour le moment !
Mais cette longue disquisition sur comment incinérer les diatomées me rappelle qu'en commençant mes travaux de micrographie, je lisais dans la bibliothèque de ma Faculté beaucoup de livres français déjà anciens à cette époque, et maintenant pratiquement antédiluviens.
Je parle d'éditions du siècle 19. Une d'elles était un traité de botanique où ils donnaient pas à pas toutes les indications que Jean et Dominique ils ont présenté dans ce forum de diatomées. Mais … au lieu de le plus ou moins inoffensif peroxyde d'hydrogène, ou de l’hypochlorite, et du non tellement inoffensif acide chlorhydrique, les diatomistes de l'époque utilisaient des méthodes plus agressives, qui ils incluaient en outre l'Acide Sulfurique concentré et le Chlorate de Potassium.
Mon guide pour la récolte, la culture, la propreté et le montage des diatomées, traduite à l'Espagnol avec ma petite lettre de ces années a une extension de 5 pages. Sur le sujet actuel les indications retraduites au français ¿ ? disent ce qui suit :
On fabrique un support avec un fil de fer plié en angle droit et terminé dans un petit cercle, Sur celle-ci on place une lame carrée, de acier, de taille un peu plus grande qu'une lamelle et ont pli ses pointes de manière de le soutenir, sans aucun obstacle pour permettre sa dilatation normale. Sur une lamelle on place une goutte du liquide avec les diatomées (conservées bien propres selon la méthodologie qui s’explique dans les pages précédentes dans l’alcool 70) et la lamelle est placé sur la lame d'acier. Elle est réchauffée fortement avec un brûleur Bunsen. L'alcool sera allumé et son ébullition distribuera parfaitement les diatomées. On baisse ensuite la flamme, en laissant évaporer le liquide lentement. Une fois séché on réchauffe la lame d’acier et la lamelle jusqu’au rouge vif ce qui suffira a détruire la substance organique restant. On laisse refroidir et on procède au montage (à l'époque ils utilisaient du Baume du Canada), après expulser l'air des frustules avec un bain de Xylol.
¿Un bon méthode alternative, sûrement plus économique que le four d'émailler, pour ces qu’ils veuillent s’entamer avec les diatomées ?
Pardonné moi si au lieu d'une génialité, j'ai exposé une bêtise. ¡Les diatomées ne sont pas ma spécialité ! :rolleyes:
En outre, ces qu'ils ne me connaissent pas ils se seront déjà rendus compte de parce que j'attire généralement les toujours bien reçues corrections de nôtre ami Olivier ;)
amities de Walter
-
Vous travaillez à une telle vitesse qui ne me donnez pas le temps ni de traduire mes notes. Collotheca a aussi des larves semblables, mais Rotipi a tant Ptygura comme Collotheca dans sa mare.
-
Selon une ami française le mot correct serait "collants" est-il ainsi ?
mPx: Tout à fait Walter !
-
Bon soirée Olivier, Rotipi et les forumistes:
Le « vermicologue » a été au principe quelque chose de désorienté. Ensuite il s'est rappelé de son second travail publié. Il y a....plusieurs dizaines d'années.
En ce moment je travaillé avec quelques beau rotifères coloniaux appartenant à deux espèces du genre Sinantherina. Les adultes adhèrent unes à d'autres par l'extrémité du pied et forment de belles sphères flottants, avec les disques céphaliques étendus, en rotant dans l'eau entretemps ils nagent. Ou bien ils sont fixés sur des plantes flottantes.
Elles portent leurs oeufs adhérés au corps et quand les jeunes éclosent se livrent a une vie nomade, en traçant avec un fil muqueux qu'elles ségrégent par l'extrémité du pied, pourvu d'un petit gobelet cilié une espèce de réseaux, à travers lesquels ils glissent, un après l’autre jusqu'à ce qu'ils terminent en se réunissant, et en unissant ses pieds pour former des sphères semblables à celles de ses parents.
Elles ont deux yeux dans l’extrémité antérieure et une couronne simple de cils, qui dans l'adulte se développe pour former le disque céphalique.
Un autre genre semblable, planctonique, est Conochilus.
Ton "ver" inconnu il est une de plusieurs choses. Une larve (ou jeune femelle) de Sinantherina, ou de Conochilus, dans ce cas tu devrais voir à grand a augmenté la structure très délicate du mastax, ou... un mâle de Conochilus. S’il est un mâle, serait plus large, mais en tout cas tu devrais pouvoir voir à grand augment près du centre du corps, un testicule sacciforme, contenant des spermatozoïdes mobiles.
Observe bien ton étang, et passe un réseau fin (tu puis la faire jusqu' avec une ¿chaussette, será cette parole ? de nylon, de femme) pour chercher les colonies flottantes. Ou fait des recherches sur les végétaux submergés et flottants pour trouver les colonies des mères. Il vaut la peine. Tu nous donneras de belles photos.
Ta lacune est le petit habitat avec une plus grande diversité de rotifères, que j'ai connu jusqu'à présent.
En plus, ton rotifère annulé est une Taphrocampa. Avec la typique tache noire qui est l'organe retrocerebral, avec le canal en Y dont les branches aboutissent a l'apex de la couronne.
Tu verras que j'utilise déjà mes deux mains et je m'encourage à des longues lettres. La prochaine semaine je pourrai déjà me présenter à nouveau dans le Forum.
-
Bonnes nuit-bons jours chers forumistes :
Une petite précision impertinente ;) : Daphnia est un genre des Cladocères (d'autres sont Ceriodaphnia, Moina, etc.) Si nous ne savons pas le genre toujours nous pourrons trouver avec la classification en appliquant la dénomination supérieure.
Alors pour les espèces montrées par Chris et Aphylla il suffit de dire qu'ils sont Cladocères. Elles sont également des photos belles et informatives :D
-
Pardon Spironucleus :
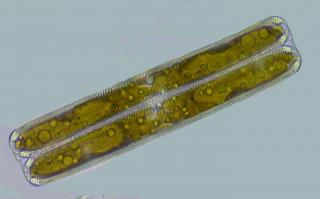
Je n'ai pas pu résister à la beauté de tes photos et ai décidé de reconstruire ce que sûrement tu as vu avec ton microscope. J'ai trouvé en Cancún une espèce très semblable (si non égal - je suis aussi un analphabète dans les diatomées) mais je n'ai jamais pu prendre une photo tellement belle.
Évidemment ce qui les diatomologues ont besoin sont des squelettes propres, mais pour moi cette diatomée vivant il est beaucoup plus intéressant. ¡Pitié qui s'est morte !
Walter
-
Bon soir Champ-Rotipi :
Je préfère que tu adoptes le second nom. Depuis que tu es collaborant tu as livré au Forum très belles photos de rotifères très intéressantes.
Celui-ci que tu as maintenant en écran est une Mytilina sp. Un détail définitoire sont les deux épines au bout de sa lorique et le plie dorsal que si tu regardes avec attention tu peut le distinguer dans la première photo.
Merci pour tes apports. Walter



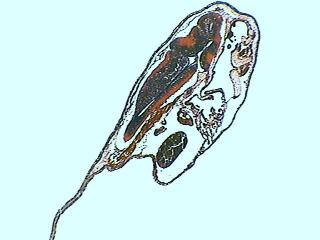
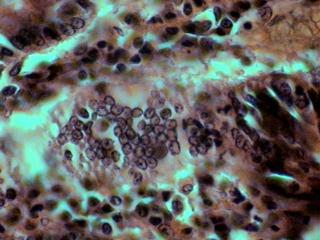
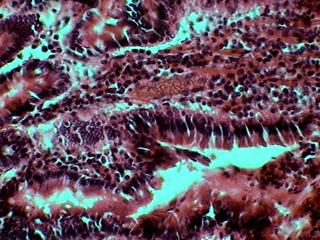
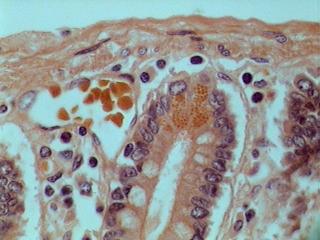
Bdelloïde sur Gammarus sp.
dans - Rotifères
Posté(e)
Bonjour Michel (parce que je crois que tu liras ceci demain)
Félicitations pour tes belles découvertes d’épizoïques sur le Gammarus. Je crois qu’il n'y a pas de doute que tu as une Embata dans ta collection. Je regrette que mon penchant pour les bdeloids soit arrêté par le caractère inopérant de mon microscope et de ma camera photographique… et je regrette plus qu'en Cancún il n'y ait presque pas de micro faune d'eau douce… parce qu’il n'y a pratiquement pas de corps d'eau douce. J'espère que Michel P ait l'amabilité d'établir un lien entre ce beau travail et la clé des genres de Bdelloidea. Embata n'avait pas une photo ajoutée et cela complétera l'information.
Amitiés sincères.
de Walter