-
Compteur de contenus
148 -
Inscription
-
Dernière visite
Messages posté(e)s par Walter
-
-
bonne apres midi chers forumistes
Je ne savait pas où mettre cette message : « Préparation des échantillons ? Prisses de vue et traitement d’images ?
J’ai décidé de le diviser en deux. Cherché aussi dans l’autre Forum
Les trophi sont les pièces dures du mastax des rotifères. Le mastax comprend en outre la musculature qui déplace les trophi. Mastax et Trophi ils forment le système saisissant et masticateur des rotifères. Dans les déprédateurs de l'ordre Monogononta (à auquel appartient Brachionus) l'appareil sclérosé est formé par 7 pièces. Comme ces pièces sont de différente forme, selon la famille, le genre ou l'espèce elles sont un caractère important pour identifier les rotifères. Depuis des débuts du Vingtième Siècle les chercheurs ont appris à séparer les trophi pour les étudier en détail. La méthode traditionnelle est d'infiltrer une goutte de hypochlorite commercial, ou d'hydroxyde de sodium ou potassium sous la lamelle.
On prépare un "compresseur de vaseline". Vous étendez d'abord une couche très mince de vaseline solide sur la paume de la main et on passe ensuite deux bords opposés de la lamelle sur cette surface pour reprendre un peu de la matière grasse. Le rotifère est placé dans une petite goutte au centre d’une lame. En appliquant le couvre sur la goutte avec le rotifère on obtiens une chambre, supportée dans deux bords et ouverte dans les autres deux ce qui aide à échanger des liquides sous le couvre. Avec une aiguille emmanchée on comprime le rotifère qui on veut étudier jusqu'à qu’il ne se déplace déjà pas et on met une goutte de la solution corrosive dans un des bords ouverts du couvre. En absorbant de l'eau par l'autre côté on obtient que le corrosive atteigne le rotifère et le dissolve, en laissant les trophi libres.
L'amateur microscopiste qui veut étudier en détail les trophi il devra utiliser cette méthode. Mais aux taxonomistes modernes déjà (y avec raison) ne leur suffit pas la micrographie photonique et ils recourent indispensablement au MEB. De beaux exemples de trophi obtenus avec MEB peuvent être vus dans ce site italien (mais écrit en Anglais). N'importe comment les images ne parlent pas, elles montrent.
http://users.unimi.it/melone/trophi/start.html
Utilise la liste latérale du site pour voir les images MEB des trophi de dizaines d'espèces
-
Bon apres midi Michel:
Tes photos sont impressionnantes. Chaque fois meilleurs.
L'Anglais c’est l'Anglais. Mais, même si tu ne pouvais pas le lire, tu puis jouir de ces magnifiques photographies de Martin Mach un amateur allemand (curieusement spécialiste dans tardigrades).
http://www.microscopy-uk.org.uk/mag/artjul02/mmfloscul.html
la quatrième et sixième images sont des belles animations qui valent bien le clic de la souris qu’on a besoin pour les ouvrir.
Amicales salutations
Walter
-
JMC :
Rh - bleu-orangé ? Le fond est noir. N'auras tu pas utilisé un W-Q ? Il serait bon que nous examinions et uniformisions la terminologie des filtres. Je vais mettre des nommes aux filtres de la planche que j'ai présentée hier, pour que nous pouvons les examiner.
En ce qui concerne tes photos tu puis déjà réclamer un titre de Maître. Chaque jour elles sont plus belles et de sujets toujours très intéressants.
amitiés
-
Bon cher Champipi:
Nous sommes à la fin du chemin. Avec ses quatre lobes, ses deux "antennes”, et son longue pied adhérente elle ne peut être autre chose qu’une Floscularia, échappée de son tube. Toutes les « floscularia » vivent dans des tubes cylindriques, la majorité des espèces les font en fabriquant des petites boules avec leurs propres excréments et en les collant dans cercles successifs. Parfois plusieurs individus collent leurs tubes sur celui d'un autre exemplaire et forment de petites colonies arborescentes. Si tu puis continue à chercher jusqu'à trouver un individu encore dans son tube.
Amitiés de Walter
-
Jean Marie :
Je ne suis pas très informé sur la systématique des Foraminifères. Je puis seulement soupçonner des relations avec des genres connus. Tu puis faire tes propres recherches en utilisant par exemple ces deux bonnes références.
http://nmnhwww.si.edu/paleo/foram/fgraphics.html
http://hoflink.com/~kane/index.html
¡Pardonne mois les “exotismes”! ;)
-
Bonne après midi aux Forumistes
Je voulais parler de Trichoblastes (que je crois peut être une traduction acceptable de Trichoblasts, le terme anglais) Dans aucun des documents en français a ma disposition, je vu l’utilisation du terme, même si les trichoblastes sont très évidentes dans les Polysiphonia
Je vous demande pardon, je ne sait pas pourquoi j’ai utilisé l’autre terme (ce pour les araignes) Je veux faire l’édition des messages a bientôt.
Jean Marie : je crois que ton image est celui d’un carposporophyte ou les cellules 2n de la Polysiphonia se développent
-
-
Polysiphonia, suite 2
Le bouton de croissance
a.- une vue générale avec la disposition de grands trichobotries
b.- Le bouton, avec un Rheinberg centre bleu, périphérie claire (illumine en jaune le sujet !)
c.- le même commenté :
1.- trichobotries de défense du bouton
2.- le bouton avec les cellules en croissance
3.- mise au point au centre du filament. On voit la cellule centrale, et deux périphériques avec (au centre) le tetraspore se développant.
4.- diatomée épiphytique
-
-
Bonjours a toutes et tous, ici l’autre algue
Il y avait de petites sphères d'une petite algue rouge en tournant dans le flux et reflux de la marée.
Celle que j'ai repris il a démontré sous le microscope être une espèce de Polysiphonia. Celle-ci est une algue très répandu (je l’ai collecté dans la Patagonie, et aussi a l’Uruguay) qu'il donne belles exicatas (voir la photo jointe) et qui a un cycle vital intéressant.
Pour s'informer sur ce cycle, suivre ces liens.
http://lebrusc.chez.tiscali.fr/pages/reprod5.html
http://biodidac.bio.uottawa.ca/Thumbnails/Rhod002b-gif.htm
Pour un article général sur les Polysiphonia voir cet article magistral de Jean Parmentier.
www.microscopy-uk.org.uk/mag/artmar99/red.html
C'est l'article meilleur illustré du réseau, et ses images ont été copiées dans beaucoup d'autres sites.
Je crois que mes images peuvent illustrer additionnelment quelques aspects d'un des types de plante que produit Polysiphonia pendant son cycle vital : le tetrasporophyte
Ici c’est la belle exicata de Polysiphonia sp (seulement pour mon herbaire virtuelle) L’image original avez 1100 pixels de larguer ; et une vue général avec l’obj. x4 du thalle et ses ramifications (fond noir) (comme une exception cette image fut agrandie des 640 aux 750 pixels, pour mieux accompagner l’antérieur)
Salutations de Walter
-
Michel :
il est très agréable de te voir utiliser ton microscope et partager tes images avec nous. Ton Leitz se comporte en accord avec sa lignée, mais toi l'ajoutes beaucoup de ta part.
Avec mes plus sincères salutations Walter
-
Cher Aphylla:
Olivier a mis les choses dans son lieu. Mais hier au soir j’avais préparé cette note (qui ma donne bien de travaille pour la traduire, ainsi je l’inclus égal) Serai de pluie sur l’eau.
Seulement quelques rotifères son facilement identifiables. Dans un group avec des centaines d’espèces l’identification peut être fait seulement si on observe beaucoup de caractéristiques en forme détaillé. Tu as, et ces photos le démontrent, une équipe appropriée pour ces investigations.
Mais tu dois comprendre que une ou deux images ne suffissent pour identifier une espèce. En principe le rotifère doit être étudié de cote et de dors (plusieurs fois une image ventral est nécessaire) Ces toujours indispensable prendre des photos des « pieds » ou « orteils » qui offrent toujours détails d’intérêt. Et peuvent aider aussi des images qui montrent les organes intérieurs et ses relations. Dans beaucoup d’espèces les « trophi » (les pièces de l’appareil masticatoire) doivent être photographiés en détail. Les « rotifèrologistes » séparent les « trophi » en dissolvant le corps avec de l’hypochlorite et les montent en glycérine pour les étudier en diverses positions. Christian Colin peut te dire que n’est pas facile. (J’ai avec lui une obligation à être liquidé prochainement)
Tu vois que c’est impossible (normalement) offrir une réponse au niveau de l’espèce. Si la tienne est une « trichocerca », j’ai le registre de 50 espèces, de lesquelles, selon tes images) 9 peuvent être bons « candidates » et 4 au moins exigerait d’avoir des bonnes descriptions, mesures et images, sur tout des « trophi » pour pouvoir faire quelque affirmation avec suffisante certitude. Ça, sans compter les beaucoup d'espèces qui je peux n’avoir enregistrés. Où l’évent de que ce ci soit une nouvelle espèce.
Le genre c’est plus facile, mais pas toujours.
Par exemple si ton espèce est une trichocerca, tu devrais montrer : Une- qu’elle est tordue sur son axe longitudinal en forme asymétrique, et Deux- que les deux orteils son de différente longueur (un d’eux peut être inclusive très petit et difficile a déceler)
Sur l’organe en forme de cane il est une partie des trophi. Une pièce latérale appelée le « manubrium »
Walter
-
Cher Spironucleus:
Dans mon article "Microscopes, Filtres, Diaphragmes et Obturateurs" j'ai décrit comment faire les disques de contraste avec une imprimeuse a jet d'encre, et les différentes tipes de disques
salutations de Walter
-
Bon après midi Olivier :
Quand j’étais jeune, :D en Montevideo j’utilisé pour sceller mes préparations, et avec succès, le ciment de Rondeau du Noyer
Lanoline anhydre………………………………..20g
Résine……………………………………......………80g
On chauffé la lanoline a feu douce, pour la fondre et la dessécher. Quand elle ne produit plus d’écume on ajouté la résine, chauffant jusque fusion totale. Je l’appliqué avec un fer chauffant similaire au tienne. ¿Sera qu’il sera possible d’obtenir la résine en France ? En Cancún Il n’est pas disponible. Mais en Durango il y a. Seule que j'aime mieux le vernis a ongles.
On peut aussi utiliser le VALAP (Vaseline, Lanoline, Paraffine en parties égales) Ici ces matériaux son obtenibles dans les maisons qui vendent des produit pour la fabrication de produits de beauté a la maison. C’est plus élastique que la paraffine seule, ne se casse facilement et s’adhère mieux au verre.
Amitiés de Walter :)
-
La suite
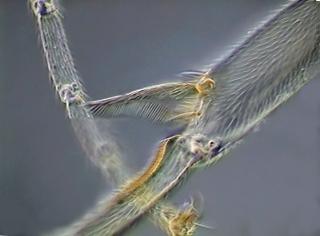
Dans l'union entre le tibia et le basitarse de la seconde jambe, comme il est vu dans la photo, il existe une éperon, qui ne m'a pas donc paru rare puisque il peut servir d'arme de défense, ou pour d'autres tâches. Mais dans la même position dans la première jambe il existe une espèce de peigne combe, accompagné de épines, qui est plié sur une surface bombée et cannelée transversalement. En soupçonnant qu'il puisse avoir une fonction dans la propreté, ou dans l'émission de son, ou dans la récolte d'un certain matériel spécial j'ai révisé le réseau sur l’anatomie de fourmis.
L'organe détecté dont je partage l'image avec vous est une étrille antenne. Un organe complexe destiné à la propreté des antennes, antennules, et les autres jambes.
L'image jointe a été prise à 5 niveaux avec un 40x planachromatique, dans mon microscope National Optical, et traité manuellement pour reconstruction spatial, et en Neat Image pour éliminer le bruit de fond.
Les commentaires sur le traitement manuel je les ferai dans le forum de Electronique & Informatique où Olivier a présenté son intéressante exposition pas à pas qui met à la disposition des amateurs francophones le programme CombineZ4.
-
-
Bonjours les Forumistes:
Mon petit-fils de 12 années est entré dans mon laboratoire à l’air complice et avec une petite bouteille dans sa main. Dans le fonds de la bouteille, sûrement morts de cirrhose hépatique, flottaient 4 petites fourmis dans une couche de vodka (qui l’a donné son père) de 1 cm d'épaisseur.
Son objectif était bien clair. Démontrer à ses amis du collège la puissance du microscope de son grand-père. Comme j'avais rejeté un invasion massive de nourrissons de 10 à 12 années pour leur montrer mon laboratoire, il exigeait que je prépare et photographie "bien grand" une fourmi.
Donc j'aie pris une fourmi, je lui ai mis en eau pour le restituer sa flexibilité et je l’ai monté en PVA-L de la meilleure forme que j’ai pu. Mes yeux et mains ne sont pas déjà totalement appropriés pour de telles tâches.
Deux jours ensuite je l'ai photographiée par parties, j'ai monté la mosaïque, j'ai l’ai pratiqué son cosmétique en PhotoPaint, j'ai imprimé une feuille lettre avec l’«énorme fourmi » à toute couleur, et l'honneur et crédibilité de mon petit-fils fut sauvé.
Objectif 10x planachromatique, 6 images indépendantes. Mosaïque préparée en PhotoPaint.
Je ne m’enorgueillis pas du résultat de mon travail. Vous pourrez juger par la reproduction ci jointe. Mais en observant cette petite bête j'ai trouvé un détail que m’a intrigué, et que je commente dans la suite.
-
Bonjours Bruno:
ce que tu vois sur le dos du gastrotriche est un gros oeuf. C'est normal. Le gastrotriche est un Chaetonontus sp.
amitiés de Walter
-
-
Bonjours mes amis. Ici Cancún une autre fois
Après une demain orageuse, la plage recevait un ressac de fragments d'algue, et des cylindres gélatineux étranges dont je m'occuperai après.
Ils m'ont intéressé plus les algues presque complets de thalle filamenteux, sûrement récemment détaché de son support, que les fragments de celles de thalle plat (certaine rouges, et d'autres cafés) et j'ai repris un poignard de une vert et d'un autre rouge.
Je commence par la verte qui est plus facile.
La première photo est un simulacre d’exicata. Les exicata sont préparations d’algues sur papier canson desséchés pou être conservés dans l’herbaire. J’ait fait la préparation mais sans la léser sécher totalement (a quoi bon) et j’ai l’ait photographié et identifié avec le PhotoPaint. C’est une exicata express seulement pour le Forum.
Sa structure est très claire, et il s'agit d'une Cladophora.
-
Mon Dieu!!! :o
-
Bonjours a tous, ici la continuation de la saga Cancunais
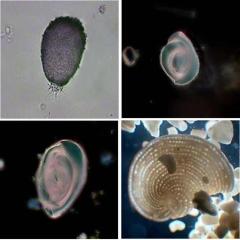
Dissimulé entre le sable que j'ai pris pour mon échantillon, il y avait quelques hôtes inattendus. Je présente ici mes premières Foraminifères de Cancún.
Dans le sens des aiguilles d’un montre :
Gromia sp. Vivant. Mais elle n’ai s’a pas daignée d’étendre les multiples filopodes que sortent de la bouche de sa coquille.
Quinqueloculina sp. Vide, la lumière marginale faite bien visible sa nature porcelaineuse
Une autre Quinqueloculina? Mais je vois beaucoup de chambres dans cet individu ; sûrement sera un genre prochain. Quelqu’un connais de Foraminifères ?
Un Elphidium sp. Pour adapter la photo a l’espace disponible je l’ai réduit un 10%
Disque pour fond noir de 12 mm. Gromia en fond clair
Originales à 640 x 480, découpes a 370x370 px.
Obj. DIN Planachromatique x 40
Elphidium avec le 10x
-
Vivent les vacances !
Abas les pénitences !
Livres et cahiers au feu
Et les maîtres au milieu !
Monsieur Ricaud, mon professeur de français, poussait nous avec joie quand nous sortions ce juillet du lycée en chantant la chanson récemment apprise. Quelques semaines plus tard sa joie a disparu pour toujours quand fut abattu sous les cieux de la France l'avion de son jeune fils.
Mais la chanson irrévérencieuse ma accompagné toute la vie. Y compris maintenant que les vacances sont un événement volontaire (et peu fréquent)
Assis sous les étoiles dans la plage, avec un ciel noir et tellement transparent qu'il me fait croire que je suis a l’intérieure d’un diamant noire, je laisse courir entre mes doigts le fin sable calcaire de Cancún, en voyant passer les navires illuminés pleins de touristes qui cassent irrespectueusement la magie de la nuit avec leurs cris.
Et je pense alors que puisque non autre chose, je puis partager avec vous au moins.... le sable. Je mets une poignée dans ma poche. Je se déjà ce qui dira ma Nelly, au lendemain....
Le sable de Cancún est corail mort et rodé pendant des décennies jusqu'à se transformer en des petits grains d’un couleur crème. C'est un sable qu'il ne brûle pas. Moi, et tous ceux que nous avons fait l'expérience de visiter des plages de sable granitique et d'autres matériels d'origine pierreuse nous savons qu’il est difficile de marcher dans le sable dans un demi - jour du soleil rayonnant. Sur cette plage on peut marcher sans crainte. Il est seulement agréablement tiède.
Microscope National Optical
Camera digital intégrée au microscope
Prise des photos au format 640 x 480
Premier photo x 4, fond clair
Deuxième, x 10, fond noire
Troisième, x 10 Disque de contraste WQ (bleu/rouge)
C’est le disque que j’appelé RhQ, mais c’est un invention de Win van Egmond, c’est pour quoi j’ait changé sa dénomination.
-
Bon aprés midi les Forumistes
J'ai recommandé l'utilisation de la fructose comme un milieu de montage qui permettrait de conserver par long temps une grande diversité de matériels. Elle est même le milieu standard utilisé par beaucoup d’algologues.
J'utilise une préparation commerciale qui est une solution pratiquement pure de fructose, et que j’obtiens dans les supermarchés locaux. Par correspondance avec David Walker, et avis de membres du Forum il est évident que cette solution n'est pas vendue en Europe, ou au moins elle n'est pas fréquente.
Larry Leggs a présenté en Micscape la préparation d'un milieu basé exclusivement dans la Fructose en poudre. Selon mPx cette forme de fructose est facilement obtenue sur les marchés français, dans la section de produits diététiques.
Mais je sais aussi que l'article de Larry, écrit en Anglais, avec 4 pages consacrées au sujet et avec une analyse plus vaste, n'est pas sûrement accessible facilement à tous les membres du Forum.
Comme je pense que la fructose et l'Alcool Polyvinylique (ce dernier est facilement obtenu avec Marcel Lecomte) sont deux des moyens les plus utiles pour l’amateur, je traduis ici (avec des modifications) les peu de lignes nécessaires pour préparer le milieu de montage.
Matériels : 2 flacons cylindriques à large bouche de la taille souhaitée (30 - 40 -50 ml est plus que suffisant). Fructose en poudre, eau "distillée" ou "desionisée" de celle utilisée pour batteries d'automobiles.
Préparation : marquer une bouteille par sa face extérieure dans les 2/3 de sa hauteur, et l'autre aux deux tiers et en outre à la moitié du tiers restant.
Remplir les deux bouteilles avec fructose en poudre jusqu'à la première marque. Dans la première bouteille ajouter de l'eau peu à peu jusqu'à arriver à la marque des 2/3. Il se forme une suspension trouble, Couvrir la bouteille et la laisser reposer jusqu'au matin suivant.
Remplir la seconde bouteille avec eau jusqu'à la marque supérieure. Procéder égal qu'avec la précédent.
Au jour suivant on aura deux solutions parfaitement limpides, avec deux concentrations utiles pour différents matériels.
Ma solution commerciale, je ne sais pas si par sa propre concentration ou pour posséder un certain antibiotique (non déclaré dans l'emballage) elle n'est pas contaminée par des champignons ou des bactéries.
Ceux qui veulent avoir une plus grande sécurité avec les solutions préparées peuvent utiliser 10% moins d'eau en préparant les solutions et ensuite compléter le volume avec Listerine. Listerine a couleur (bleu, verdâtre ou jaunâtre) choisisses celui qui vous satisfait plus et rappelé-vous que dans les quantités utilisées cette couleur n'influence les objets montés ni interfère avec la vision de ces derniers au microscope.



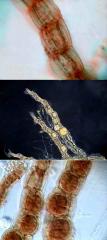






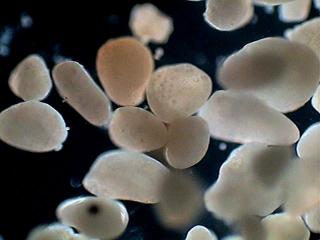
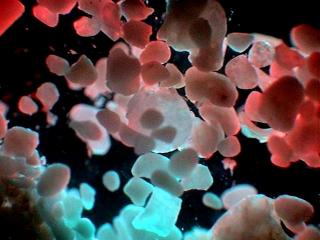
Trophi de Brachionus (2)
dans - Rotifères
Posté(e)
Re-bon apres midi
Je ne savait pas où mettre cette message : « Préparation des échantillons ? Prisses de vue et traitement d’images ?
J’ai décidé de le diviser en deux.
Brachionus a un type de trophi qui est appelé "malleate". JMC l'a montré en action dans une belle animation.
Il y a plus d’une année j'étudiais une population de Brachionus à Durango quand j'ai trouvé un exemplaire mort, assez détruit, mais avec les trophi bien contrastés.
Malheureusement il était dans une vu totalement frontale ce qui n'est pas très convenable, mais j'ai décidé lui prendre une série de photos au x 40.
J'ai photographié 10 plans différents avec l’intention de les traiter avec CombineZ ...et probablement étant donné mon immédiat changement a Cancún me suis oublié de ces images.
Je les ai trouvées hier et j’ai décidé d'essayer de reconstruire le mastax. La tâche s'est transformée un peu en une aventure que je veux partager.
Les images étaient un peu foncées et avec beaucoup de bruit. J'ai commencé pour leur appliquer une augmentation de contraste qui a favorisé assez les images des trophi.
J'ai ensuite traité toutes les images avec Net Image, y j'ai finalement utilisé CombineZ pour les amalgamer.
Le Commande Do Combine (Voir Special dans la bar a commandes) il m'a donné des images désastreuses, ce pourquoi j'ai recouru a Do Average (Enhanced) et cette fois j'ai obtenu une reconstruction acceptable. Mais...
Le fond (restes des parties molles du rotifère envahies par des champignons et des bactéries) était très inadéquat.
Par conséquent j'ai utilisé l'outil de coupure de PhotoPaint pour sélectionner le mastax avec un zoom de 300x pour pouvoir suivre les bords plus fidèlement.
J'ai inverti le masque pour choisir le fond et je l'ai appliqué le effet de « estompe gaussien », et j’ai contrôlée l'intensité jusqu'à séparer le mastax du fond.
Le résultat est celui que vous pouvez voir dans les images jointes. Dans la deuxième j'ai ajouté les noms des différentes pièces.
Celles-ci son 1 fulcrum, 2 manubri (pluriel de manubrium), 2 unci (pluriel d'uncus) et 2 rami (pluriel de ramus) Note : l'ensemble de fulcrum plus rami est appelé "incus"
J'ai joui du résultat, bien que depuis le point de vu taxonomique il n'est pas utile. Pour déterminer l'espèce j’aurai en outre eus besoin de vues supérieurs des unci et leurs dents (forme, taille et disposition), vue dorsal de l'incus, et vues latéraux du manubrium. C’est pas facile, mais les anciens (plus que mois) ils l’ont fait par décades.
L'idéal est de dessiner l'ensemble des trophi dans 3 dimensions. Cela le fait très bien le MEB, pour à peine un peu plus de travaille. Par chance les espèces de Brachionus peuvent être identifiés presque toujours par leur lórique.
Il y a un détail intéressant, entre l’uncus a gauche dans la photo (a droite dans les trophi) et le ramus du même côté il y a une masse que seulement peut être interprété comme quelque aliment qui devait être broyé au moment de la morte.
C’est amusant ! Un si long texte pour deux petites images !!!