-
Compteur de contenus
1 088 -
Inscription
-
Dernière visite
Messages posté(e)s par jmaffert
-
-
Pour les lames, j'utilise des lames dégraissées RS France, bords rodés. Elles sont bien propres.
Pour les lamelles, beaucoup sont sales. J'ai trouvé des Menzel-Gläser en 18 x 18, qui sont bien propres d'origine.
Voir Internet pour les fournisseurs...
Cordialement
-
Contrairement à l'eau du robinet, pauvre en bactéries et en nombreux ions, sauf le calcium, l'eau de pluie est pauvre en calcium, ce qui en fait tout son intérêt pour l'arrosage des plantes.
En effet beaucoup de plantes ne supportent pas le calcium et la teneur en calcium d'un terrain peut changer notablement la végétation qui y pousse. L'évaporation continue de l'eau pour les plantes en pots augmente la teneur en sels dans la terre.
Ainsi le Midi (SE) de la France est essentiellement calcareux et la végétation est la garrigue. Le massif des Maures et la Corse ne sont pas pas calcareux et la végétation, avec le même climat, y est le maquis.
Une large concentration en calcaire est acceptée dans l'eau potable, ce qui n'est pas supporté par beaucoup de plantes, surtout en pots, comme dit ci-dessus; citons les camélias, les orchidées, etc...
Les fientes d'oiseau ne sont pas une gêne pour les plantes (en quantité modérée), ni beaucoup d'éléments de pollution cités par Tryphon. Alors oui à l'eau de pluie pour l'arrosage des plantes, surtout en pots, mais certainement pas pour boire !
Amicalement
-
Bravo à tous pour cet article très bien documenté et illustré.
Amicalement
-
Il faut aller chercher sur la Biodiversity Heritage Library.
Cordialement
-
Magnifique !
-
Désolé, j'avais fait une réponse ce matin, qui s'est perdue.
Il faudrait attendre que ton "champignon" soit bien mûr, car il s'agit peut-être quand même d'un myxomycète (qui ne serait alors pas un champignon...) au stade plasmode; les véritables spores (probablement rondes) se formeront dans la chair. Les cellules polygonales étant la membrane autour de la forme amiboïde. Les rares hyphes et rares (?) spores seraient alors celle d'un ou plutôt de deux champignons qui pousseraient sur/dans le myxo.
Ca pourrait aussi être un ascomycète dont les asques seraient dans des logettes incrustées dans la chair, mais le manque d'hyphes est problématique pour un champignon.
Pour tenter de lever l'option ascomycète, tu pourrais poster ta découverte sur ASCOFrance, sité dédié aux ascomycètes auquel participent de vrais spécialistes français et étrangers, beaucoup plus compétents que moi.
Amicalement
-
Bonjour,
je suppose qu'il y a une lentille de Bertrand escamotable comme sur le même module pour Orthoplan.
J'utilise le même genre de module sur Orthoplan depuis des années. C'est très agréable. Effectivement on ne se rend pas compte que le module est en place, car la qualité optique est excellente.
Quand on a de bons objectifs, le grossissement 10x des oculaires est un peu faible pour saisir les petits détails.
Sur Orthoplan ça monte au grossissement 3,2x, peu utilisable car la luminosité s'effondre. Je vais rarement au delà de 2x.
Seul souci que j'ai eu : des erreurs de mesure en oubliant que le zoom n'était pas sur 1x !
Cordialement
-
Comme dit Dominique, il faut les plonger dans l'eau après usage pour le colorant ne sèche pas.
Après lavage , Il faut les rincer et les sécher tout de suite ou les rincer à l'eau déminéralisée ou à l'alcool comme dit Cosinus. Si on laisse sécher les lames mouillées il y a un dépôt de sels minéraux.
Pour faire des économies, je fais trois préparations par lame : on peut mettre facilement une lamelle au centre et une de chaque côté. J'utilise donc trois fois moins de lames que de lamelles.
Cordialement
-
Il est donc clair que ces cristaux sont biréfringents. C'est compatible de la calcite, mais aussi d'autre chose. C'est normal que le comportement optique soit différent selon les directions de propagation.
Pour aller plus loin, j'ai peur qu'il ne faille trouver un spécialiste de cristallographie... ou de tomber par chance sur quelque chose qui ressemble sur Internet, la forme de ces cristaux troués étant particulière.
Amicalement
-
Bonsoir, la calcite étant bien biréfringente, ça devrait se voir avec des essais en lumière polarisée.
Amicalement
-
C'est sûr. Il y a des expériences chimiques basiques que l'on peut faire comme de mettre les "cristaux" dans un acide (vinaigre, acide chlorhydrique) ou une base (soude potasse). S'ils se dissolvent c'est déjà une indication intéressante.
La biréfringence ou une simple polarisation rotatoire (regarder entre polariseurs croisés) sont aussi des test assez faciles à réaliser, surtout le deuxième et peuvent mettre sur la piste d'un minéral plutôt qu'un élément organique.
Cordialement
-
Très bel et intéressant article avec une quantité impressionnante de techniques microscopiques.
Merci
-
Ces derniers objets sont très jolis, mais sont-ce des cristaux ? les formes arrondies seraient curieuses pour des cristaux. Mais quoi ???
Ca a quand même l'air bien différent des cristaux de Buteo, assez extraordinaires par leur cavité.
Cordialement
-
Désolé des messages se sont croisés.
L'article de Gatimel est un amas de conneries, qu'il n'a pas inventées, mais simplement recopiées sans comprendre. Espérons qu'il est meilleur praticien que physicien (c'est ce qu'on lui demande). Le premier schéma correspond au deuxième que j'ai dessiné il y a deux jours dans ce même sujet. Il n'a bien sur pas vu qu'en décalant légèrement l'image sur la rétine, le signal disparaissait...
Son deuxième schéma est totalement faux car il n'a pas réalisé que les capteurs avaient une surface et n'échantillonnaient pas "ponctuellement".
Dans une bande de luminance uniforme, il n'y a pas d'aliasing, etc...
C'est l'exemple typique de connaissances mal digérées et d'un manque de réflexion personnelle. On ne peut pas lui en vouloir car les études de médecine ne sont pas des études de physique.
A titre d'anecdote, j'ai été deux ans assistant de physique en faculté de médecine. Le Professeur de physique était un médecin. (Aïe ! Aïe Aïe ! )
Amicalement
-
Astigmatisme
Citation : "L'astigmatisme n'est pas amélioré par un grossissement supérieur. Avec un 20 X tu auras le même astigmatisme qu'avec un 10 X .
C'est ton œil qui est astigmate et il le restera, Ou alors tu as aussi une correction dioptrique en plus de l'astigmatisme.
Mais qui n'est pas astigmate ?
L'astigmatisme n'est pas toujours gênant et ne nécessite pas toujours une correction tout dépend de son degré et de la gêne."L'astigmatisme, comme d'autres aberrations, diminue l'acuité visuelle. On voit les grosses lettres chez un ophtalmologue, pas les petites. Un oculaire plus puissant agrandit l'image. Les aberrations de l'oeil sont alors moins sensibles.
Une paire d'oculaires coûte beaucoup moins cher qu'un zoom de microscope...
Cordialement
-
Désolé, tant que tu appliqueras à tort/hors contexte un très intéressant et exact théorème de traitement du signal, je réagirai.
Comme exemple d'article citant à tort ce théorème je t'envoie sur :
http://www.gatinel.com/glossaire/nyquist-theoreme-de/
qui est un amas d'idioties d'un médecin spécialiste qui n'a rien compris et qui se gargarise de théories auxquelles il n'a rien compris.
Il y a aussi plein d'articles de photographie dans le même style. Tout le monde se recopiant, sans comprendre, ce qui ne m'étonne pas car c'est compliqué (il suffit de lire l'article dans Wikipédia sur ce théorème, par exemple).
Si dans "tous les documents que j'ai pu consulter" tu en as de sérieux, je suis preneur. S'il y a des exemples concrets, je suis aussi preneur.
Je reconnais que 10 est un arrondi. Quand je disais 2 à 3 c'était 2 à 3 fois plus que Shannon. En fait ça devient convenable vers 8 à 10 échantillons par cycle. Pour t'en rendre compte, échantillonne une sinusoïde avec des durées variables, comme je l'ai représenté dans mes dessins précédents. Tu verra de toi-même à partir de combien d'échantillons ça commence à ressemble au signal qu'il aurait fallu restituer. Si tu trouves qu'à 2,3 échantillon par cycle le signal ressemble à quelque chose, c'est désespéré.
Amicalement
-
- "Plus les photosites sont petits actuellement environ 1,4 µm pour 14 Mp.
- Plus l'image restituée est grande et donc plus facilement recadrable.
Illusion, il n'y a pas plus de détails."
Il vaut mieux lire :
- plus il y a de pixels, plus l'image est recadrable
- plus les pixels sont petits, mieux l'image intermédiaire est restituée
" Plus les détails sont fins.
Illusion, les détails sont sur l'image intermédiaire pas créés par la camera."
Heureusement que la caméra ne crée pas de détails ! pour qu'elle ne les fasse pas disparaître, il faut échantillonner avec beaucoup de petits photosites...
Amicalement
-
Tout à fait d'accord.
A la question sur les oculaires :
- plus le grossissement est faible, plus le champ est grand et inversement
- il est plus rapide de changer un oculaire qu'un objectif. Nos anciens avaient des microscopes à 1 ou 3 objectifs, pas à 5 ou 6 et pas de tourelles interchangeables.
- les oculaires sont moins chers que les objectifs
Ceci dit avec un très bon objectif, je trouve que le grossissement de 10 est un peu insuffisant (mes yeux ont de l'astigmatisme...). je me sers donc quelquefois du zoom de mon microscope pour plus de confort sur les petits détails.
Je l'oublie d'ailleurs quelquefois et suis surpris par les dimensions que je mesure ! :)
Cordialement
-
"Bien entendu, si on veut minimiser les effets du crénelage, on peut essayer de diminuer la taille du photo-site, même le plus sot peut le comprendre". C'est exactement ce que je veux dire : l'image au foyer de l'objectif a une certaine qualité, limitée par les lois de la physique et la qualité du microscope.
Si on veut la reprendre à l'oeil, on rajoute un oculaire suffisamment puissant pour ne pas atteindre la limite de résolution de l'oeil.
Si on veut la reprendre avec un CCD, en la dégradant peu, il faut environ DIX échantillons (photosites) par cycle de la fréquence spatiale maximum que délivre l'objectif. Je ne veux pas faire de la transformée de Fourier, mais observer au mieux l'image fournie par l'objectif.
Amicalement
-
Je vois que notre cher Tryphon continue à joyeusement mélanger les concepts :
- d'analyse de spectre
- de visualisation d'un signal ou d'une image
Oui, quand on veut numériser un signal pour en mesurer le spectre, une échantillonnage légèrement supérieur à deux fois la fréquence maximum est suffisant pour retenir l'information fréquentielle.
Non, quand on veut visualiser un signal, cet échantillonnage est notoirement insuffisant. Tu t'es probablement servi d'un oscilloscope numérique. T'es-tu demandé à quelle fréquence était échantillonnée la jolie sinusoïde que tu regardes ? certainement à deux échantillons par cycle !!Amicalement
-
Effectivement, sur ta photo agrandie on voit bien les détails.
Le moiré est dû à un échantillonnage très proche de la fréquence que l'on observe. Dans ce cas, selon la synchronisation entre le signal et l'échantillonnage, il y a de grandes variations dans le signal.
Un exemple classique est donné par les voilages devant les fenêtres. Quand le tissu est en double dans les plis, selon que les fils sont en face des fils ou en face des trous, on voit des zones plus claires et plus sombres. Comme l'écartement entre les fils n'est pas parfaitement constant, cela fait des dessins. C'est le moirage.
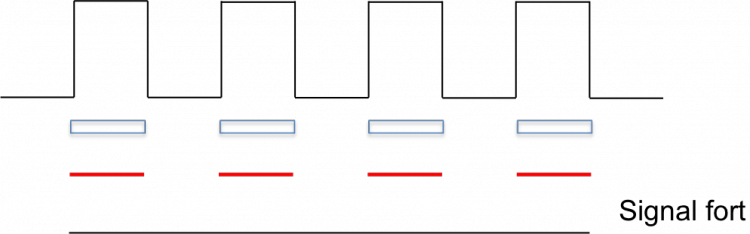
Reprenons le cas de l'échantillonnage d'un signal blanc/noir par un CCD. Premier cas à deux photosites par cycle (un cycle c'est un blanc + un noir) :
En noir, l'éclairement vu de profil, en bleu les photosites et en rouge le signal de sortie. Ici pas de chance,les photosites captent tous du blanc et du noir en quantité égale : le signal résultant est uniformément gris. En décalant latéralement :
Le signal est "parfaitement" restitué. Entre les deux, on percevra plus ou moins de modulation. Si la fréquence d'échantillonnage est légèrement différente de la fréquence qu'on observe, il y aura des endroits où on sera "en phase" où on verra la modulation et des endroits où l'on sera "en quadrature" (décalage d'un quart de cycle) où l'on ne la verra plus, d'où effet de moiré.
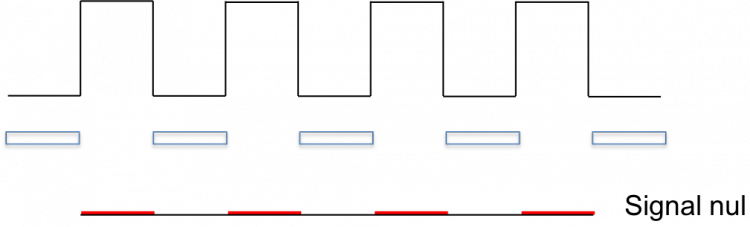
En sous-échantillonnant comme tu le fait, on se trouve dans le cas suivant où un détecteur sur deux n'est pas utilisé :
ou, selon le décalage :
Si la fréquence d'échantillonnage n'est pas exactement un sous-multiple de ce qu'on observe, il y aura à nouveau des décalages et des zones plus ou moins claires, d'où à nouveau effet de moirage.
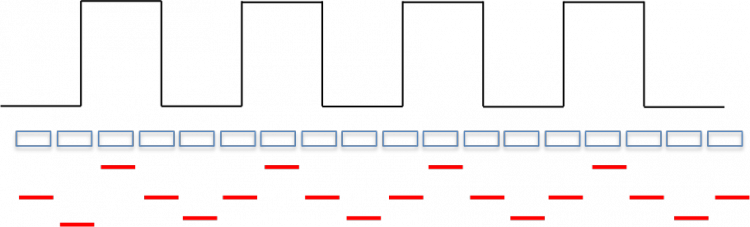
A l'inverse, si l'on échantillonne mieux, comme dans l'exemple suivant, à 4 échantillons par cycle :
il y a une dégradation du signal, mais il n'y aura pas d'effet de moiré, s'il y a un décalage latéral.
En résumé, le moiré apparait en cas d'échantillonnage voisin de deux échantillons par cycle ou un sous-multiple. Un échantillonnage correct du signal nécessite 8 à 10 échantillons par cycle (j'insiste :blink: ), pour ne pas le dégrader et il n'y aura pas de moiré !
Cordialement
-
Bonjour Jean-Luc,
c'est bien de faire des essais réels avec des objectifs différents. Je pense cependant qu'il faudrait ré-agrandir les photos (ou un fragment) pour qu'elles soient à la même échelle, ce qui faciliterait la comparaison.
En numérotant tes photos de 1 à 8 :
- je ne vois plus les trous sur la photo 2
- sur la photo 3 il y a un effet de moiré, ce qui arrive quand on échantillonne à une fréquence proche de celle de l'objet
- photo 7 : est-ce aussi du moiré ?
Cordialement
-
"Pour l'image c'est pareil, si l'image est meilleure sur les courbes, mais si on ne voit aucune différence à l'écran où au microscope, cela me fait deux belles jambes."
Justement, il me semblait qu'on pouvait voir une différence sur les images que j'ai envoyées. Je regrette de ne pas avoir de commentaires directs dessus.
"192 000 Hz alors qu'on plafonne à 10 000 et légèrement plus quand on est jeune, çà me fait rigoler." Ne pas confondre fréquence acoustique (ou fréquence spatiale) et fréquence d'échantillonnage. C'est le sujet.
Tryphon est un Saint Thomas au carré : (Saint Thomas)2. A Saint Thomas, Notre Seigneur a dit : “Parce que tu m’as vu, tu as cru. Heureux ceux qui n’ont pas vu, et qui ont cru !” » (Jn 20, 24-29).
Tryphon voit (des images virtuelles, l'effet de l'échantillonnage) et ne croit toujours pas...
Bien amicalement et Joyeux Noël
-
J'essaie simplement d'expliquer que l'échantillonnage au sens de Nyquist-Shannon conserve l'information spectrale mais dégrade le signal. Que pour ne pas trop dégrader le signal, il faut échantillonner à des fréquences plus élevées.
Le traitement du signal a de fortes ressemblances entre des signaux électriques, issus de sources différentes : audio, radio, hypefréquences (signaux monodimensionnels, fonction du temps) et de l'optique (signaux bidimensionnels dans l'espace). Beaucoup de règles qui s'appliquent aux uns s'appliquent aux autres.
Si des professionnels numérisent les signaux à 192 kHz / 24 bits, c'est pour ne pas les dégrader, les conserver et pouvoir faire du traitement dessus. Ensuite, ils sont repassés à 44 kHz et moins de niveaux pour diffusion grand public. Apparemment ils se sont aussi aperçus que l'échantillonnage Nyquist-Shannon dégradait le son, comme j'espère t'avoir montré qu'il dégradait l'image...
Amicalement





Truffe
dans Mycologie microscopique
Posté(e)
Bonjour,
précision sur les spores : chaque spore est une seule cellule et elles ne commencent pas déjà à se diviser.
Comme pour beaucoup de cellules, l'intérieur n'est pas homogène. Au microscope optique on ne voit pas beaucoup de détails. On peut cependant distinguer des zones d'indice différent, comme les grosses guttules rondes dans les spores de la photo 5. Sur la photo 6, il n'y a toujours qu'une seule cellule, mais la guttule centrale est divisée en plusieurs guttules. La spore est probablement plus jeune.
Amicalement