-
Compteur de contenus
1 550 -
Inscription
-
Dernière visite
Messages posté(e)s par Jean-Luc Bethmont (Picroformol)
-
-
Bonjour,
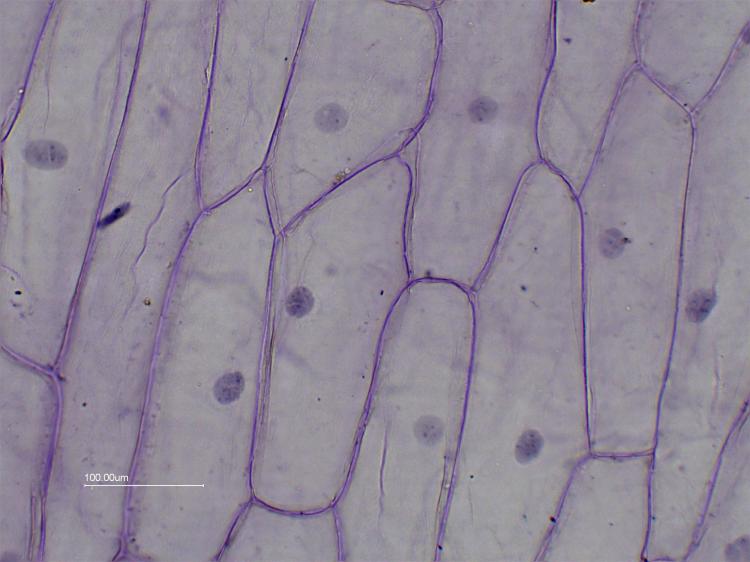
Suite à la réponse de JPL j' ai fait des recherches dans mes vieux colorants en poudre et j' ai retrouvé du bleu de toluidine ( cuvée d' il y a 40 ans au moins !). j'en ai fait une solution aqueuse à 1 % environ pour colorer les moyaux de cellules d' oignon blanc, j' ai tâtonné pour avoir une coloration à peu près correcte.
Vue avec l' objectif x20:
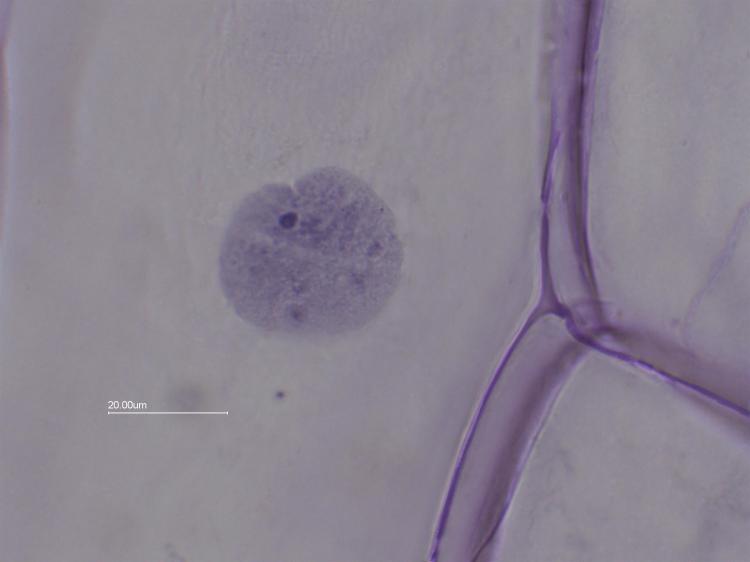
Vue avec l' objectif x60:
On voit bien le cytoplasme qui a "floculé" ,le noyau (diamètre environ 33 µm) et les nucléoles en bleu foncé qui sont au nombre de 2 à 4 par noyaux.
cordialement,
JL
-
Bonjour,
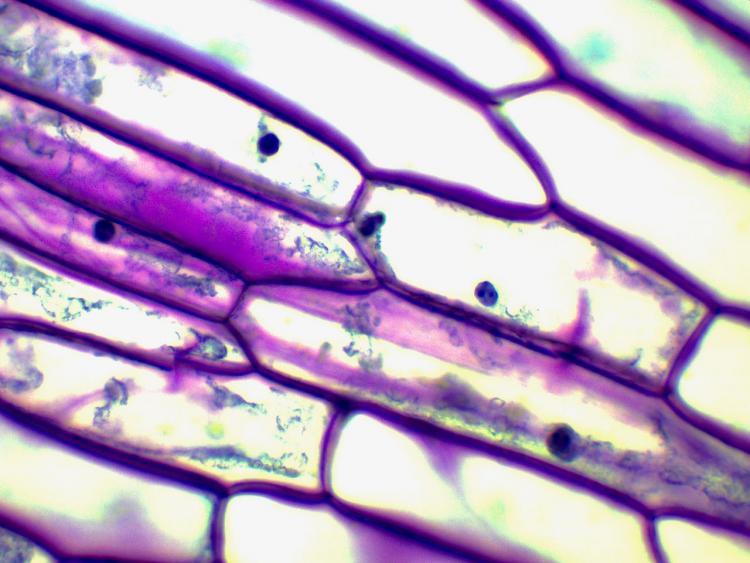
En faisant du rangement j' ai retrouvé cette préparation toute faite d' épiderme d' oignon, je ne connais pas le colorant utilisé.
Observation fond clair objectif x40:
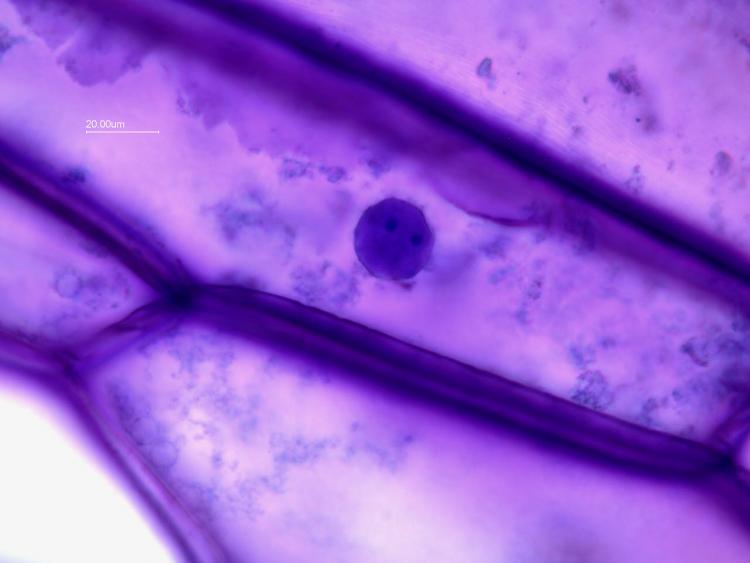
Avec l' objectif x100 on voit clairement le noyau avec des nucléoles:
Le diamètre du noyau est d' environ 32 µm
Cordialement,
JL
-
Encore un article enrichissant.
Et pas une coquille dans le texte........
Cordialement,
JL
-
Bonjour Laurent,
Ta question aborde un sujet assez vaste.
Je ne sais pas si tu débutes complètement en microscopie ou bien si tu as déjà une expérience mais tu ne fais que des préparations temporaires ?
Quoi qu' il en soit, une préparation définitive a pour but de conserver le sujet a observer le plus longtemps possible
dans un état le plus proche possible de ce qu' il est au moment de sa "récolte" avec éventuellement une coloration.
A partir de là on peut considérer 3 étapes (en simplifiant):
- la fixation qui a pour but de conserver au mieux l' échantillon; pour cela on utilise des agents physiques (chaleur)
ou chimiques (formol par exemple) certains sujet n' ont pas besoin de fixation (aile de mouche par exemple).
-la coloration permet de mettre en evidence des éléments invisibles en microscopie à fond clair (le noyau de cellule par exemple). Les colorations peuvent être plus ou moins complexes.
-le montage définitif peut-être fait en milieu aqueux (glycérine gélatinée) ou dans d' autres milieux non miscibles avec l' eau (baume du Canada) dans ce cas une étape de deshydratation est nécessaire.
Tu trouveras sur le magazine du forum et dans de nombreuses documentations des recettes pour chaque sujet à étudier des plus simples aux plus sophistiquées.
Comme en cuisine il faut acquérir un tour de main en pratiquant et en essayant de comprendre pourquoi il y a un échec. Note bien ton protocole et respecte les temps indiqués.
Commence par des choses simples sans produit toxique. Par exemple une aile de mouche peut-être montée sans fixation, sans coloration avec de la glycérine gélatinée (Regarde les articles dans Mik-Mag).
N' hésite pas à nous faire part de tes succès et tes échecs.
Cordialement,
JL
-
Bonjour Dominique,
Le Rete mirabile est un système que je ne connaissais pas.
Je suis toujours stupéfait par la puissance de l' évolution pour trouver la meilleure solution a un problème physico-chimique !
Cordialement,
JL
-
Merci pour l' info, effectivement j' ai regardé un peu chez Roth le nitrate d' argent est à environ 1600 € le kg
-
Bonjour Dominique,
Je ne vais pas être très original en disant que c' est une belle étude !
Penses-tu qu' un amateur peut observer des neurones dans le "cerveau" d' un organisme primitif après dissociation (sans coupe au microtome) et coloration ?
Cordialement,
JL
-
Bonjour Denis,
Pour faire simple:
- concernant le prélèvement tu utilises un scalpel ou une aiguille lancéolée pour racler la moisissure à la surface des feuilles ou bien encore une petite pince pour effectuer le prélèvement.
- tu déposes sur la lame porte objet une ou deux gouttes de glycérine , tu dilacères le prélèvement dans la glycérine, tu recouvres avec une lamelle couvre-objet et tu appuies
doucement sur la lamelle.
Et le bleu coton dans tout cela ?
Il faudras te procurer du bleu coton dans le lactophénol (bleu au lactophénol) comme ici:
Tu remplaces la glycérine par le bleu coton dans la préparation.
Cordialement,
JL
-
Bonsoir,
Très enrichissant !
Un organisme dit "animal" qui peut se reproduire par bourgeonnement comme un "végétal" c' est assez bluffant.
cordialement,
JL
-
Pour les champignons et leur identification consulte le site suivant:
-
-
Bonjour Dominique,
Ton sujet a permis d' étancher aussi bien notre soif physique que notre soif intellectuelle :)
Pour l' origine de la substance qui entoure la flore je me demande si on ne pouvait pas rapprocher cela des biofilms bactérien ou la substance gélatineuse qui rassemble les algues vivant en colonie par exemple ?
Cordialement,
JL
-
Bonjour Butéo,
Je trouve la dernière photo et la technique pour l' obtenir très intéressante . Comme d''habitude je fais une recherche sur l' internet et je suis tombé sur cette page:
http://www2.ac-lyon.fr/etab/lycees/lyc-69/bernard/IMG/pdf/protocoles_etude_poil_cheveu.pdf
Cordialement,
JL
-
-
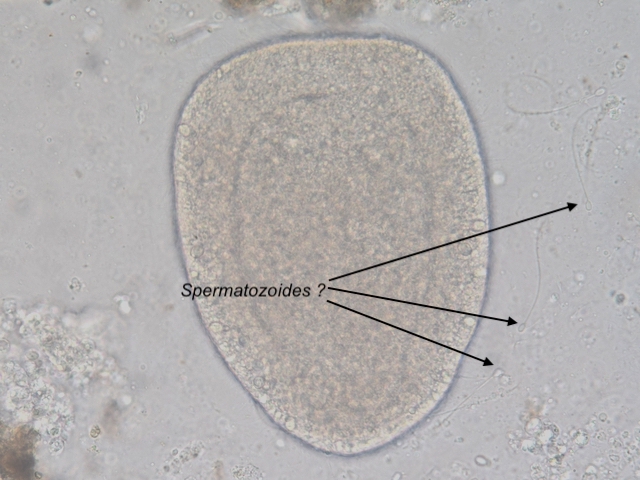
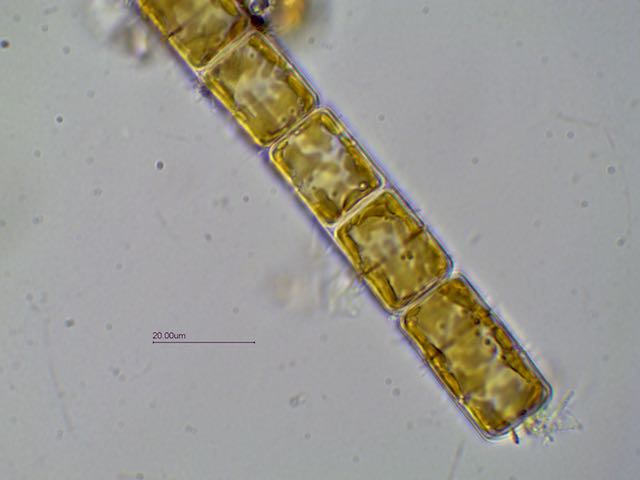
Bonjour,
Présente en assez grande quantité dans un échantillon d' eau douce (mare dans le Val d' Oise) la diatomée Melosira forme des filaments:
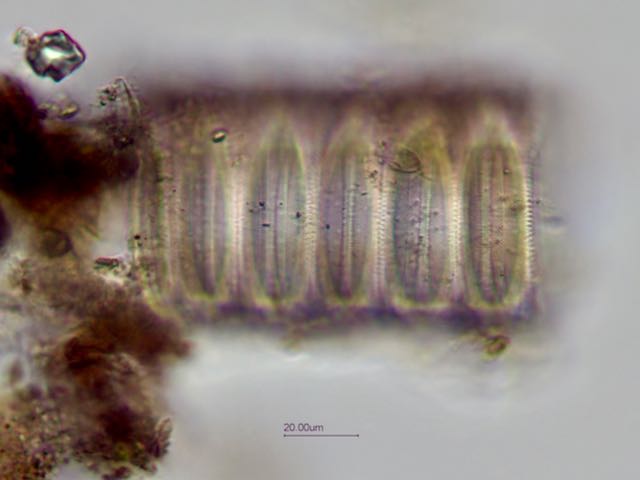
Deux autres vues x60 et x100:
Au niveau des frustules vides ont aperçoit des "dents" à droite permettant l' amarrage de chaque frustule et les stries qui ornementent chaque thèque:
enfin les auxospores qui correspondent à des oeufs fécondés (reproduction sexuée)
Sur le site suivant une expication des modes de reproduction:
https://sites.google.com/site/sheobiogt/organism-study/life-cycle
Cordialement,
JL
-
Bonsoir Philippe,
Merci pour ton appréciation .
Pour répondre a tes questions:
La camera utilisée est une Optixcam 5MP (celle que j' utilise habituellement)
L' objectif est un 60 plan achro:
L' éclairage oblique est obtenu avec ce cache mis entre les deux lentilles du condenseur:
Enfin j' ai traité les images pour éliminer le fond et les poussières, chaque image est le résultat de l' addition d' une douzaine d' images identiques. (Je ferais un petit topo à l' occasion).
Cordialement,
JL
-
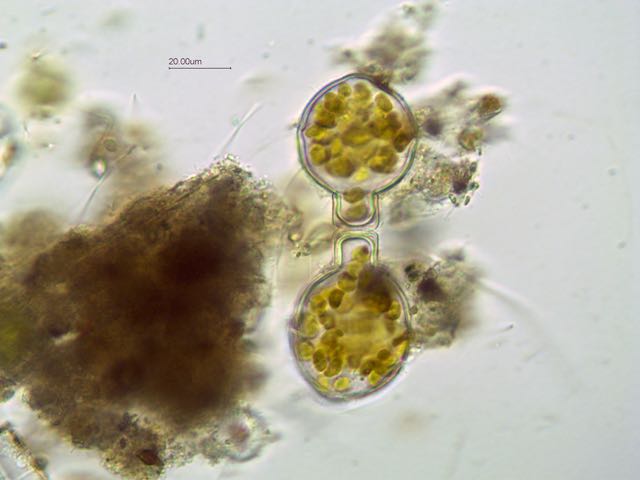
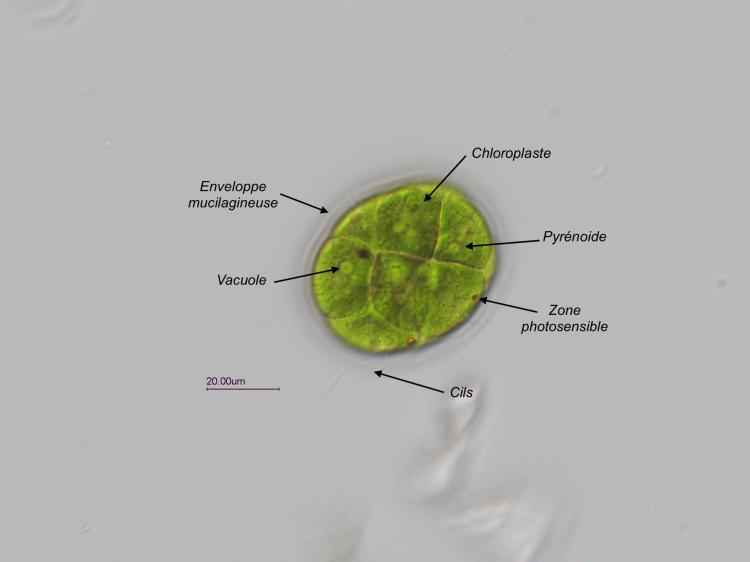
Bonjour,
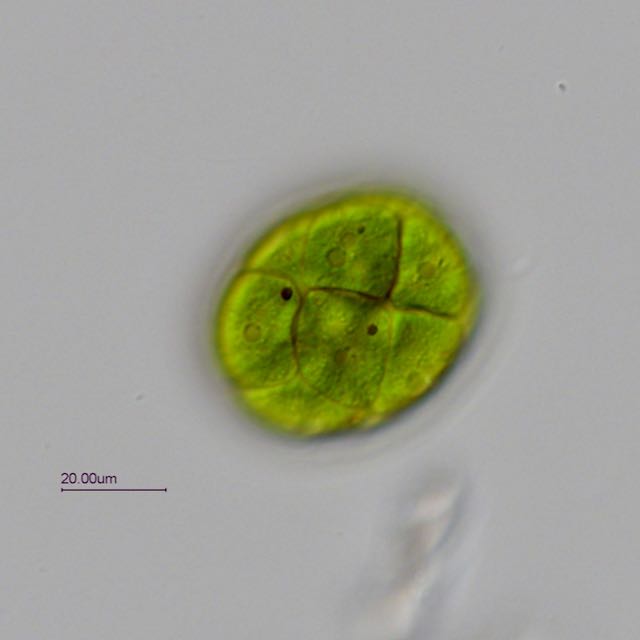
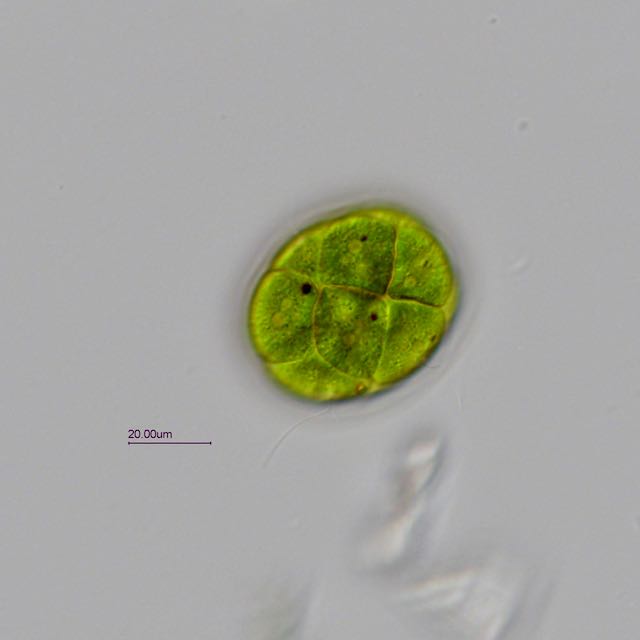
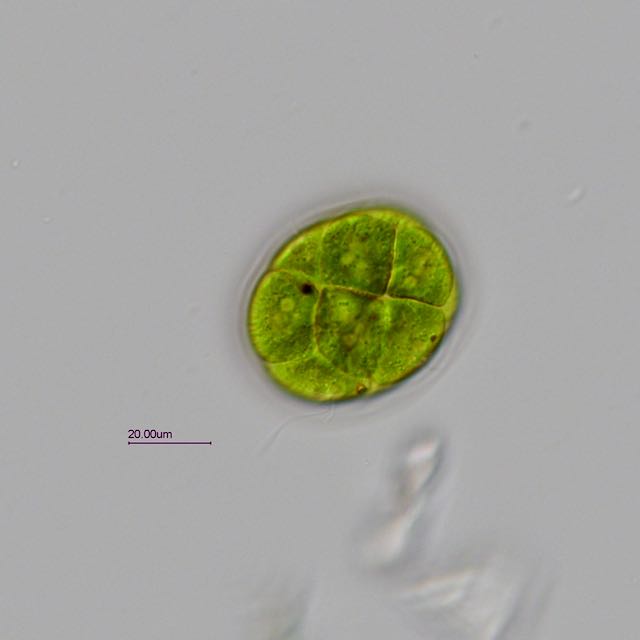
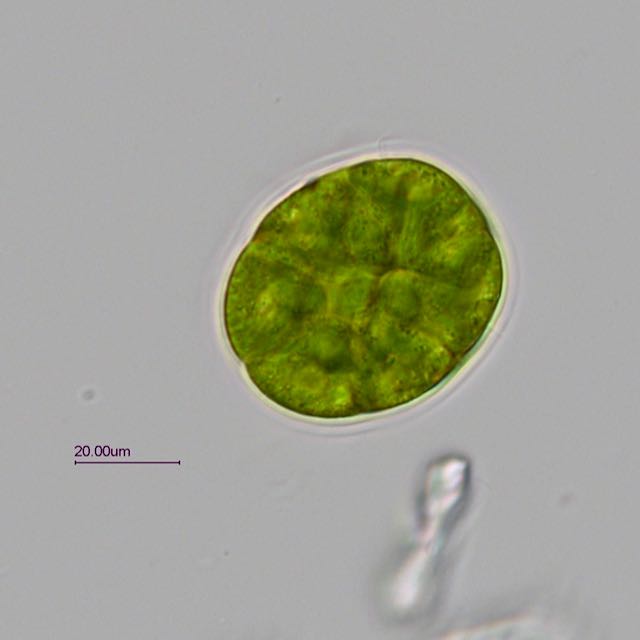
Trouvée dans un prélèvement d' eau douce (mare dans le Val d' Oise) une algue verte organisée en colonie dans une enveloppe mucilagineuse.
Observation en fond clair avec un éclairage oblique.
Une série de 4 photos prises à des niveaux différents pour mieux voir les détails:
L' algue est très mobile et mesure environ 45 µm sur 55 µm. Les cils sortent de l' enveloppe pour assurer la mobilité.
La colonie peut-être composée de 4 à 16 cellules.
Ci dessous une photo annotée (j' espère ne pas avoir fait d' erreur).
Cordialement,
JL
-
rien n' est parfait en ce bas monde :(
-
Bonjour Dominique,
Encore un minutieux travail qui permet d' appréhender l' organisation insoupçonnée des petits organismes.
Bravo :)
JL
-
Bonjour,
Pour la beauté de ces ornementations voici un (ou une) Calliteara pudibunda photographié dans le Val d' Oise:
un lien pour en savoir plus:
https://www.insectes-net.fr/pudibonde/pudibunda2.htm
Cordialement,
JL
-
Super Dominique,
On s' instruit à chaque article.
Si j' ai bien compris le gui est considéré comme parasite strict ?
Sait-on si l' arbre hôte n' en tire pas quelques profits malgré tout ?
Cordialement,
JL
-
Bonjour Dominique,
Encore un formidable travail très enrichissant :)
cordialement,
JL
-
Bonjour Dominique,
J' attends toujours d' avoir un peu de temps devant moi pour lire tes articles remplis d' informations pertinentes !
-
Merci, Patrice, pour ta contribution .











Thymus Ris de veau
dans Dominique
Posté(e)
Bonjour,
Effectivement je me souviens d' un documentaire sur le sujet où il était question d' études qui mettaient en évidence le fait que des personnes qui avaient côtoyé des animaux dans leur enfance étaient moins sujet aux allergies et étaient plus "robustes" vis à vis des infections.
Cordialement,
JL