-
Compteur de contenus
4 088 -
Inscription
-
Dernière visite
Messages posté(e)s par Jean Marie Cavanihac
-
-
Bonjour
Félicitations à Dominique pour cette série sur le calamar ! J'admire la patience car la dissection de cette masse blanchâtre n'est pas aisée !
Pour le système circulatoire, la logique voudrait que le coeur Central se contracte une fraction de secondes après les coeurs branchiaux, une fois que le sang oxygéné y est revenu après son passage dans les branchies (par analogie avec le système oreillettes/ventricules des vertébrés). C'est vrai que ce n'est pas visible dans la remarquable vidéo...
Amitiés
JMC
-
Bonjour
Il n'y a pas de rubrique "documentation" aussi je poste ici ce lien du Michigan Technological University , il s'agit d'un "open book" (accès libre) dont tous les chapitres sont intéressants avec des conseils pour les préparations etc ...Un gros travail bien présenté qui peut aider à l'identification des sujets et à la microscopie en général. ! Le plus souvent les sites en .edu sont pérennes mais libre à vous d'en faire une archive ! (1200 MO !)
Le titre Bryophytes ecology est un peu réducteur mais on y trouve des chapitres sur protozoaires , rotifères etc
Le volume 2 qui donne des images de rotifères inclue aussi, fungi, insectes, et autres habitants des bryophytes par exemple
Volume 3 : modes de collecte et observation, coloration, montage (appliqués aux mousses mais utilisables ailleurs)
Volume 4 mousses...(1740 pages quand même )
https://digitalcommons.mtu.edu/oabooks/4/
Amitiés
JMC
-
Bonjour
pour aider :
Colorant de la cellulose.
Ajouter à 100 mL, 4 grammes d’alun de potasse et 1 gramme de carmin, faire bouillir très doucement un quart d’heure environ, laisser refroidir et filtrer, ajouter quelques gouttes de formol pour éviter le développement de moisissures.Extrait du site où il y a d'autres préparations :
https://www4.ac-nancy-metz.fr/physique/ancien_site/labos/doc/indicateurs/indicateurs.htm
Amitiés
JMC
-
Bonjour
ce n'est peut être pas le bon forum pour poster cette observation , mais cet organise marin m'a d'abord fait penser à une algue sauf qu'on ne voit pas de chlorophylle !
Et en effet les Beggiatoa sont des bactéries autotrophes chimosynthétiques tirant leur énergie de l’oxydation des sulfites et sulfures. Elles se développent à l’interface entre des milieux sans oxygène (vases) et l’eau de mer. Et aussi dans les sources chaudes à grande profondeur.
On distingue dans les cellules des granules de sulfures (encadré) . L'échelle correspond à l'image principale . Le spécimen observé est très légèrement mobile par glissement.Le prélèvement est fait sur un cordage trempant dans l'eau e.n grattant le dépôt
AMitiés
JMC
-
Bonjour
Puisqu'on en parle, voici les pipettes que j'utilise depuis des années (matériel très sophistiqué ;))
En 1 j'utilise une dosette de collyre comme "poire" qui est assez "dure" ce qui évite d'aspirer trop de liquide et de perdre le spécimen dans la poire . introduit a force un tube de verre (mais ce pourrait être en plastique ) et au bout, toujours entré en force, un capillaire plastique diamètre interne 0,5 mm.
2 une poire ( récupérée comme contenant de sauce dans un entremet !) avec un morceau de gaine thermodurcissable transparente emmanchée en force, et son diamètre réduit en chauffant pour avoir une extrémité effilée
3 poire idem avec un capillaire verre (tube à hématocrite) non effilé en bout : ouverture 1 mm
4 Une pipette plastique usage unique (mais elle sert depuis des années ) pour aspirer dans le flacon d’échantillon (aspiration plus puissante)
5 une macro pipette diamètre interne 4 mm: tube verre monté sur poire (rouge) de labo (avec 2 spires en noir de ruban auto vulcanisant pour adapter le diamètre) Utilisée pour spécimens > 1 mm.
Je me sert pratiquement toujours de la 1 pour isoler un spécimen ...
AMitiés
JMC
-
Bonjour
Superbe ! Et toujours admiratif pour ta patience !
Amitiés
JMC
-
Il existe plusieurs espèces de bryozoaires marins (littéralement à partir du grec Bryo : mousse et Zoos animal) dont certaines possèdent des loges calcaires contenant les individus (ou Zoïdes) mais l’observation ci dessous explore une autre espèce qui ne possède pas de structure calcaire, donc reste molle et assez transparente pour voir l’anatomie interne des spécimens.
Il s’agit ici d’un bryozoaire cnenostome zoobotryon verticillatum (toujours du grec : zoos : animal et botryos : grappe de raisin ). Plus connu sous le surnom de bryozoaire spaghetti car il ressemble assez aux vermicelles asiatiques ! Image de l’échantillon :Bizarrement sur le net on trouve beaucoup de photos de ces buissons d’individus sur des sites de plongée par exemple mais très peu d’images microscopiques des zoïdes eux mêmes. Donc allons documenter cet aspect d’autant qu’il s’agit de spécimens faciles à prélever et qui se conservent plusieurs jours pour leur étude.
Quand on parle de buissons ce n’est pas une image ,les colonies peuvent atteindre 30 cm de diamètre voire 1 m et dans les ports peuvent causer des dégâts sur les prises d’eau en les obstruant ! Ils se développent rapidement lorsque l’eau de mer atteint les 22 degrés ce qui a été le cas cette année pendant plusieurs semaines.
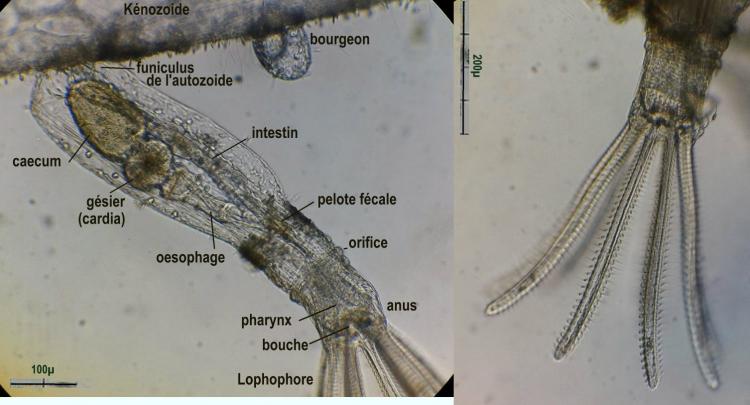
Buisson à 80 cm de profondeur et site du prélèvement, à droite sur une coque.On y distingue deux types d’individus : Les autozoïdes chargés de nourrir la colonie et un autre type : les kénozoïdes qui forment un stolon servant de support aux autozoïdes
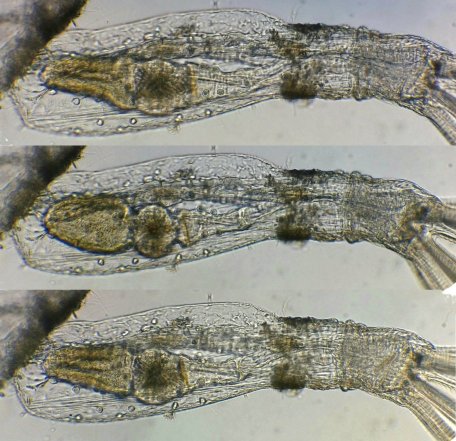
Voyons le détail d’un autozoïde : à droite détail du lophophore à 8 branches couvertes de cils qui ramènent les particules nutritives vers la bouche située au fond du cône formé par ces branches. ( Cliquer sur les images )On voit sur l’image commentée à gauche, le système digestif qui forme un « U » se repliant au fond de la loge avec la partie descendante depuis la bouche qui comprends le pharynx, l’œsophage, et ce qui tient lieu d’estomac :un gésier capable de casser les diatomées et le cardia qui débouche sur l’intestin en partie remontante. Celui ci se termine par l’anus situé à l’extérieur du lophophore au niveau de la bouche ce qui les classe dans les ectoproctes. Il est d’ailleurs assez amusant de voir le mouvement de déglutition de l’œsophage lorsque qu’une particule est ingérée ! Un montage de trois images illustre ce processus
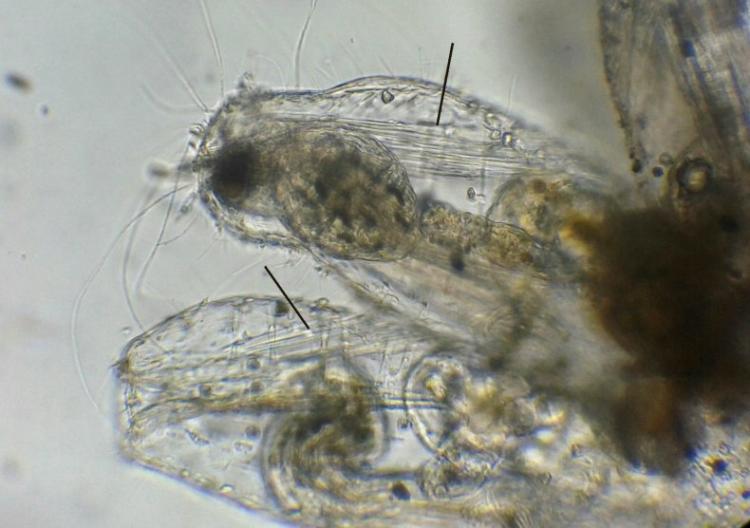
Le lophophore peut se rétracter dans le corps de l’individu au travers de l’ouverture grâce à un muscle dont on distingue les fibres attachées au bas du zoïde dans ces individus rétractés. (flèches sur l’image ) . L’extension du lophophore se fait par contraction de muscles circulaires dans la paroi de la loge, qui par la pression induite, éjectent celui ci.
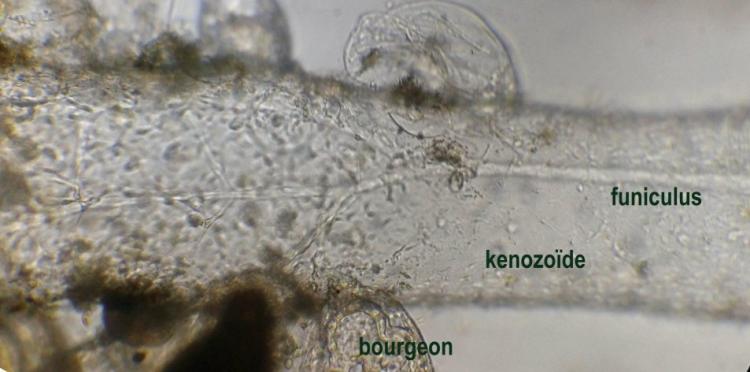
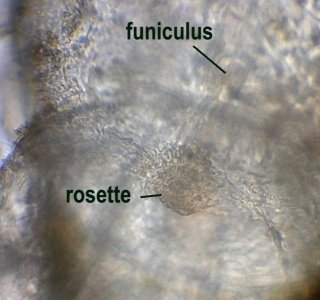
Le second type de zoïde est le kénozoïde qui comporte moins de détails mais on y distingue une structure centrale le funiculus (latin : cordon) qui relie chaque kénozoïde .Ce dernier est sous pression et si on le perce la structure devient flasque.
Sur cette image on voit qu’un réseau de cellules relie le funiculus aux bases de chaque zoïde . Vraisemblablement ce réseau sert au transport et au partage des nutriments.
Au point (nœud) ou deux branches de kénozoïdes se séparent on observe une structure dite « rosette » reliant les funiculus de chacune des branches, son rôle est mal connu et elle est difficile à observer : en voici une tentative !
suite
Les kénozoïdes portent des bourgeons qui deviendront de futurs autozoïdes (image qui m’évoque toujours les œufs extraterrestres dans Alien !) . Le mode de reproduction est peu documenté, en tous cas je n’ai rien observé à ce sujet. Mais voir référence ci dessous .
En dehors du problème causé par le volume des colonies, il y a également la capacité de filtration des autozoïdes qui vient en concurrence des mollusques filtreurs pour la capture du plancton.
Point positif , cependant, les colonies servent aussi d’abri pour les poissons juvéniles et portent souvent d’autres espèces comme ces caprelles (à gauche) qui s’y agrippent ou ce petit nudibranche trouvé sur le spécimen, qui broute sur les stolons !
Références :
http://lanwebs.lande...zoobotryon.html
https://doris.ffessm.fr/ref/specie/520
ANDRÉ Frédéric, HARMELIN Jean-Georges, PEAN Michel in : DORIS, 21/03/2021 : Amathia verticillata (delle Chiaje, 1822),
https://platewatch.n...erticillata.pdf
Classification :
https://www.marinesp...tails&id=851581
Reproduction :
https://link.springe...435-019-00438-4
Une étude intéressante quand au protocole utilisé pour déterminer la capacité de nutrition :
https://www.tandfonl...30.1968.9515230
--- Commentaires sur ce sujet : ici https://forum.MikrOscOpia.com/topic/19403-zoobotryon-amathia-verticillata-commentaires/?p=80486 -
Bonjour
Merci Patrice et Jean-Luc,
ce qu'on peut dire c'est que l'identification à ce stade larvaire n'est pas facile !
Amitiés
JMC
-
Bonjour Patrice,,
Oui c'est possible, j'ai cherché sur le net mais les formes larvaires évoluent vite et je n'ai pas trouvé l'équivalent en image. Ce qui m'interpelle c'est l'absence d'antennes et la présence de ce qui semble une bouche (?) ciliée...
Amitiés
JMC
-
Bonjour Dominique,
Jolie étude ...J'avais une question sur les coupes cryogéniques : le microtome et couteau sont ils aussi maintenus au préalable au congélateur ?
Amitiés
JMC
PS : il me semble que le premier lien ne pointe pas vers ton dernier article sur cactus
-
-
Bonjour
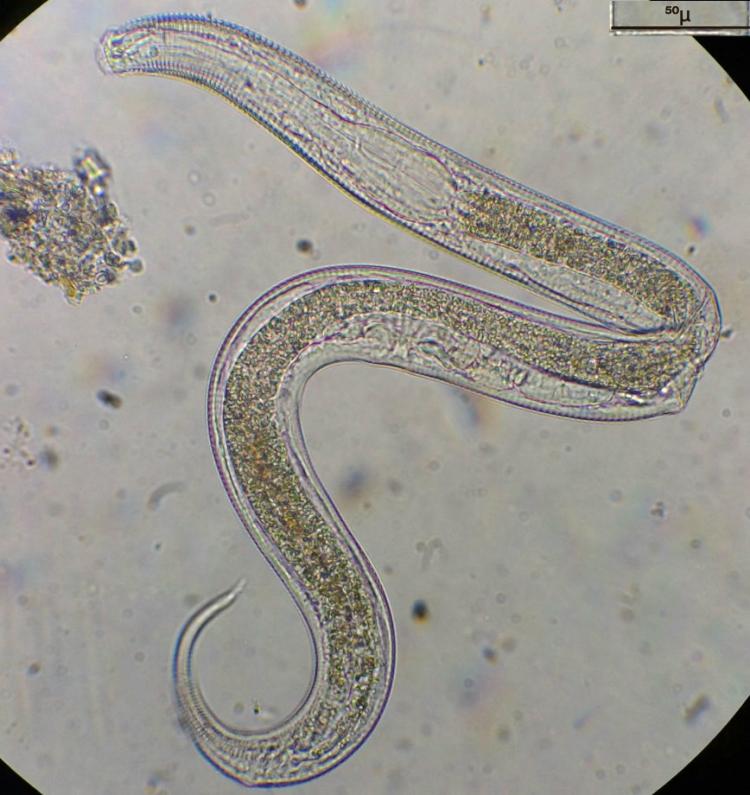
Un ver marin dont je ne sais pas le nom , ni s'il s'agit d'une larve de ver qui sera plus grand à l'age adulte !
Deux images du même individu vivant ou l'on voit, entre les deux, une contraction du système digestif et sur l'image de droite, au bas de la tête une tache ovale plus sombre qui manifestait une activité ciliaire...
Ps: je mets dans le titre les deux orthographes, pour faciliter les recherches
Amitiés
JMC
-
Bonjour
le gif animé est pratique pour un phénomène répétitif...Ce est pas la peine de faire de longues séquences puisque le mouvement ne change pas et la fonction loop permet d'avoir une animation permanente. Par contre la conversion MP4 / gif donne un gif 4 fois plus lourd et j'ai dû supprimer les 3/4 des frames!
Amitiés
JMC
-
Bonjour
Petit complément, peut être la même moule qui a grandit : en polarisation au x 6,3 ; on voit que la coquille est calcaire
Un détail des branchies au X 40 :
Et une image des cils en mouvement (avec un effet stroboscopique) dans un Gif animé obtenu par conversion d'un MP4 (!) (Je n'aime pas mettre des vidéos sur YT), téléphone portable tenu à la main !
Amitiés
JMC
-
Bonjour
Belle et originale étude ! Bravo pour la technique du cryomicrotome domestique !
Amitiés
JMC
-
Bonjour,
Merci Dominique, pour le filet, il n'était pas nécessaire ici, échantillon recueilli par grattage d'un cordage immergé... Pour le filet on peut en faire un avec du voilage à rideau (la maille est de l'ordre de 200 µm) mais c'est suffisant pour ramener pas mal de choses y comprises inférieures à 200 µ.
Amitiés
JMC
-
Bonjour
En complément de l'étude de Dominique ici : https://forum.MikrOscOpia.com/topic/19268-moule-reproduction/
voici quelques images complémentaires du développement : il s'agit de plusieurs individus
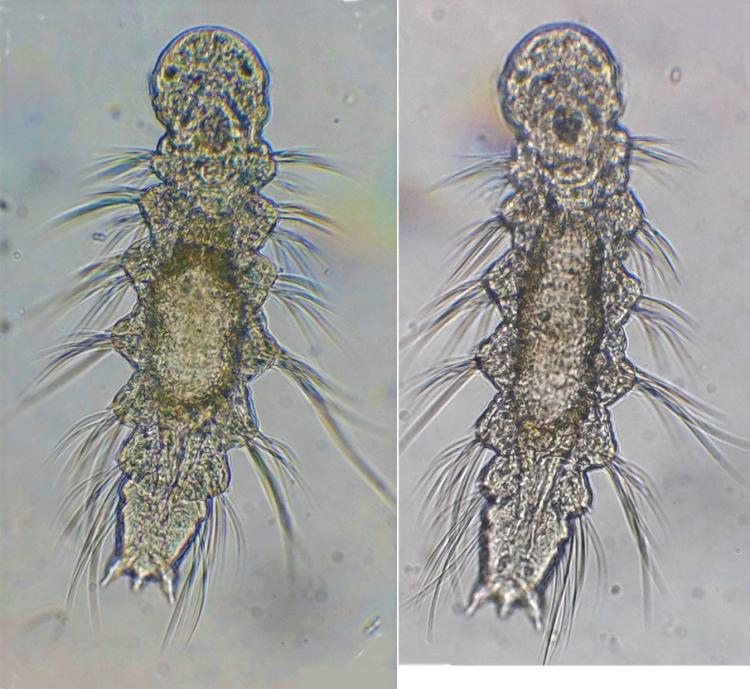
Stade Veliger : au x 15
Juvénile 1 on remarque les cils sur les filaments des branchies (C'est mieux en vision directe, on les voit bouger !)
Autre stade un peu plus développé : un peu plus de branchies
Même spécimen en fond noir, la flèche montre le pied
Amitiés
JMC
-
Bonjour Dominique,
Très belle étude et toujours des coupes époustouflantes (surtout sur des pièces archi molles !) !
Un lien illustré sur le cycle de reproduction
et une image perso (ancienne !) de ce qui doit être une forme juvénile où l'on voit le début des branchies
Amitiés
JMC
-
-
Bonjour,
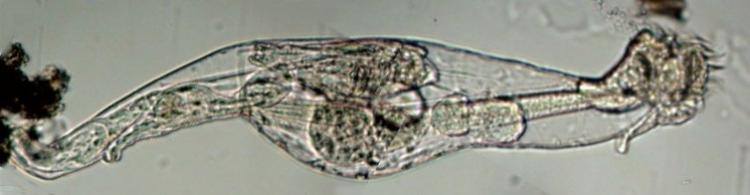
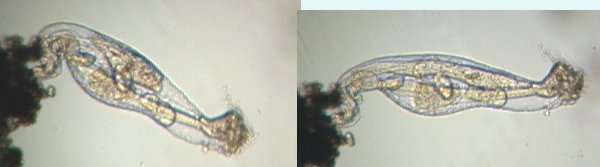
Toujours dans d'anciennes vidéos (2002! soit 20 ans ) retrouvé ce rotifère qui à l'époque m'avait intrigué car il y en avait un petit dedans ... Je n'ai pas trop d'images de détail mais ce qui bougeait et s'étirait à l'intérieur n'était pas un organe du gros rotifère c'est sûr
Je crois que les bdelloides sont capables de viviparité ? Image reconstituée à partir de 3 images au x 15 probablement
détails :
Amitiés
JMC
entre 2 images successives, il a bougé !
-
Bonjour
Merci de vos appréciations...je ai pas trop peaufiné le fond! Le problème quand on assemble des images élémentaires, c'est les différences de lumière de l'une à l'autre et la transition se voit particulièrement sur un fond clair !
C'était avec ma première caméra analogique, 384x388 pixels...j 'aimais bien sa dynamique sur les valeurs de luminosité que je ne retrouve pas sur les caméras numériques 2mpx!
Amitiés
JMC
-
-
-
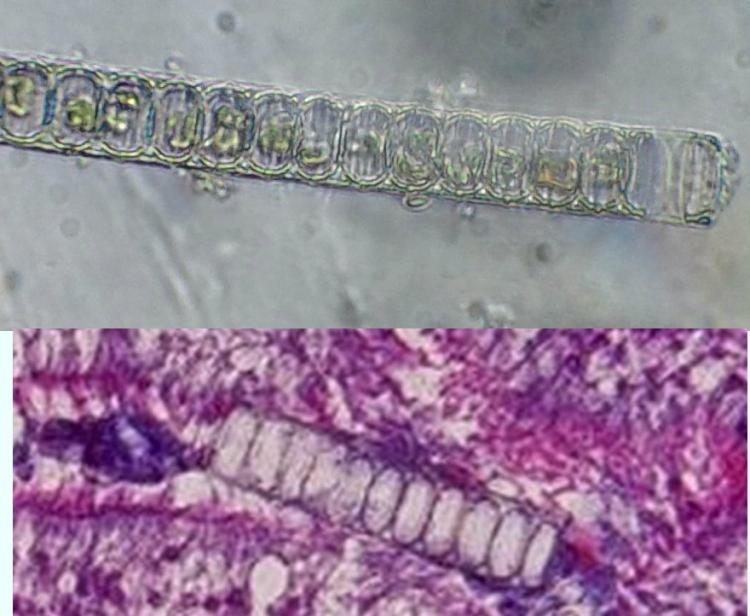
Bonjour Dominique
Superbe travail comme toujours ! Et quelle patience pour toutes ces coupes...
J 'aime bien l'image avec la diatomée coincée dans le transit ... Probablement Paralia Sulcata !
Amitiés
JMC











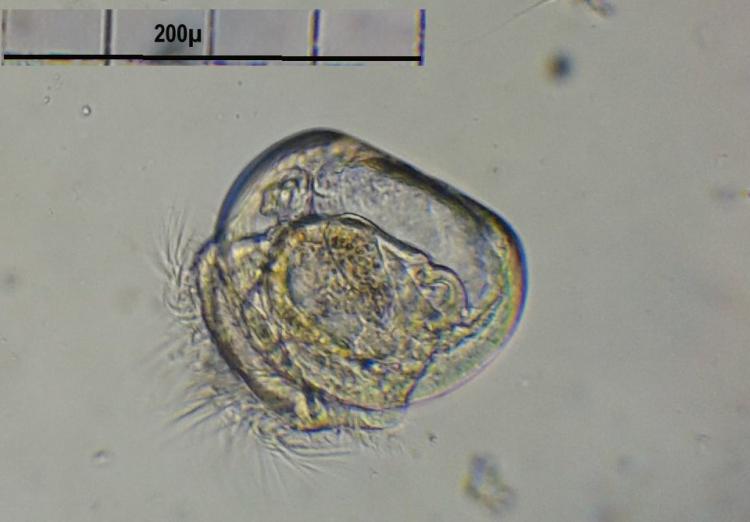
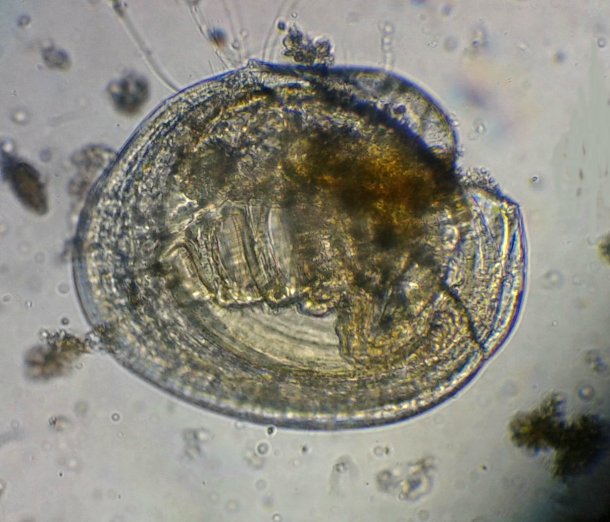
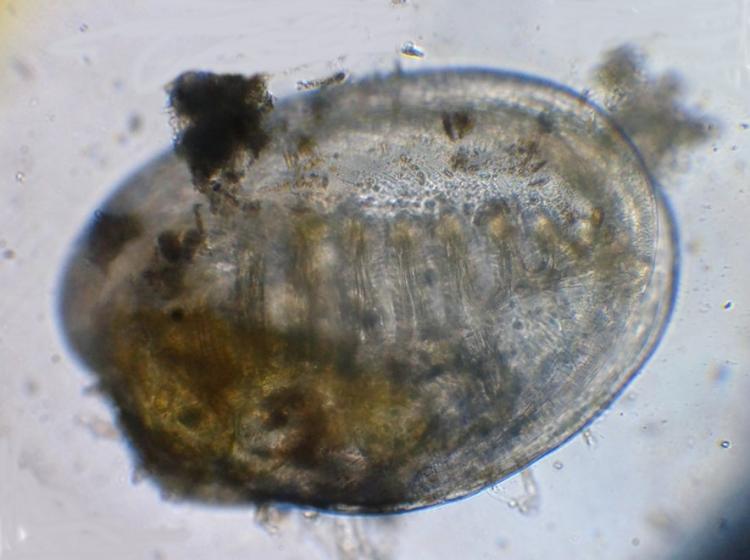


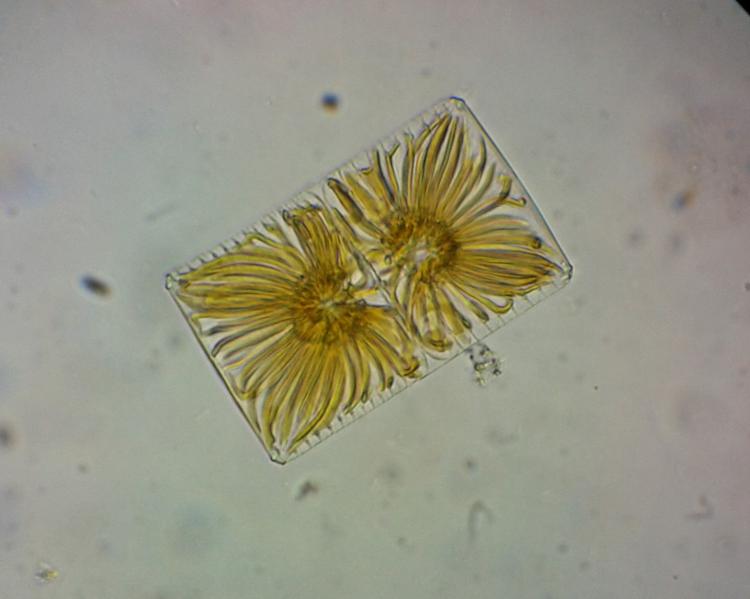


Spirale mystère
dans BIOLOGIE MARINE
Posté(e)
Bonjour
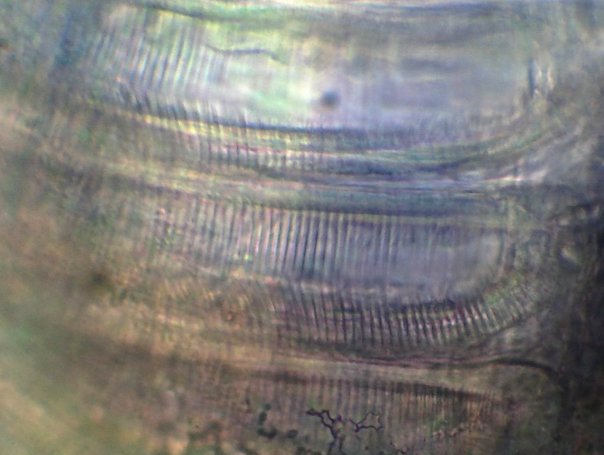
Foraminifère. On voit les perforations qui laissent sortir les pseudopodes.
Amitiés
JMC