-
Compteur de contenus
4 164 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Jean Marie Cavanihac a gagné pour la dernière fois le 4 septembre 2024
Jean Marie Cavanihac a eu le contenu le plus aimé !
À propos de Jean Marie Cavanihac

Contact Methods
-
ICQ
0
-
Yahoo
Micromars2001
-
Website URL
http://
Champs personnalisés
-
Motivations.
promouvoir la microscopie amateur, aider les nouveaux arrivants !
Visiteurs récents du profil
Jean Marie Cavanihac's Achievements
-

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour à tous Jean Marc , on peut utiliser le LM338 qui va à 3 A ce qui est largement suffisant pour des Leds . Pour calculer le courant dans R1 la formule est 1,25/R1. (R1 en ohms). L'inconvénient est que toute l'intensité va passer par le rhéostat R1 qui doit tenir le coup... ça se trouve des rhéostats 2 W mais c'est un peu cher.Je préconiserait un commutateur 6 positions commutant des résistances de puissance (entre 1 et 2 w) sachant que c'est rare qu'on ait besoin d'un réglage très fin de la lumière...* Je peux faire un schéma si besoin Amitiés JMC * J'ai une alim simplifiée pour led 1 W avec 2 positions : Normal et Boost cette dernière position n'étant utilisée que pour le X 40 -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour En analogique il y a le LM338 K qui peut aller jusqu'à 5 ampères (3 A pour 338 sans K) et son montage en générateur de courant ci dessous.. On doit pouvoir remplacer R1 par un commutateur de plusieurs résistance supportant les intensités demandée; on n'a pas forcément besoin d'un réglage fin... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour vu sur ce site plusieurs types de radiateurs et même certains ventilés de petite taille . pour une LED 3 watts que l'on n'utilise pas toujours à pleine puissance cela doit suffire...Pour l'alimenter en courant continu c'est moins évident, les drivers "tout fait" sortent en courant alternatif.... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Je voudrais attirer l'attention sur le fait que ces petits modules d'alimentation ne sont pas des générateurs de courant . Une faible variation du réglage de la tension peut faire varier dans de grandes proportions le courant dans la led . voir ici https://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-LEDS-2/LEDS2.htm A défaut un fusible en série avec la LED me parait indispensable : par exemple pour LED 3 watts fusible 1,5 A, pour 10 watts 3,15 A ou 4 A etc... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Jean Luc Moi c'est Jean-Marie (pas Jean Marc ! ) Le problème principal pour la LED c'est de pouvoir la positionner à la place de l'ampoule actuelle. Bien que la LED soit plus petite , il faut aussi loger son radiateur indispensable. Pour une remplacer une ampoule de 30 w on peut estimer qu'une LED 3 W (qui consomme 1 ampère) est suffisante. Les alims pour LEDS disponibles travaillent en courant constant mais en alternatif ! Il faut concevoir une alimentation filtrée en courant continu ou utiliser une alimentation de laboratoire réglable en courant. Il faudrait avoir une photo de l'ampoule en place pour voir si la transformation (réversible) est possible Pour Neat Image le principe est de prendre un échantillon de bruit seul sur une zone unie de l'image et de faire son spectre en fréquence puis le soustraire de l'Image. Probablement en utilisant la transformée de Fourier. Mais si on peut d'emblée obtenir une bonne image le post processing est inutile. AMitiés JMC -
Jean Marie Cavanihac a commencé à suivre Population de l'estran de la plage du Havre , Capture Rapide , Exploration d'un bac extérieur rempli d' eau et 1 autre
-

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
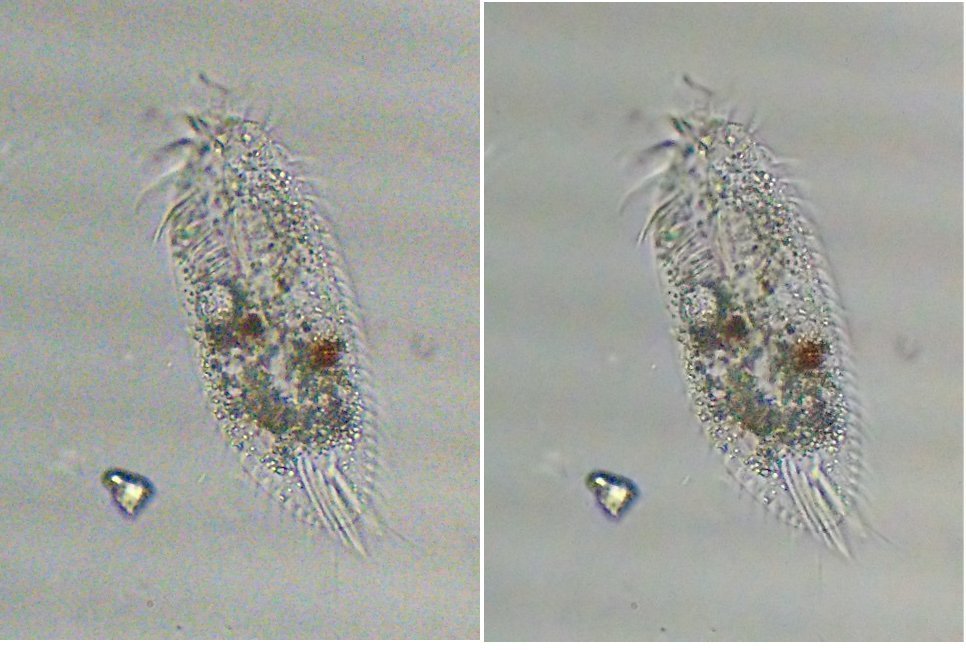
Bonjour Jean Luc Vraiment intéressante ta démarche , que l'on pourrait aussi appliquer au zooplancton vivant et qui m'intéresse à ce titre !. Pour le scintillement (et les barres sur les images) la solution serait de passer en éclairage LED alimenté en courant continu filtré , il pourrait être même possible au moment de la prise de vue de suralimenter brièvement la LED pour faire un pseudo flash (comme sur les téléphones) . Pour le bruit on peut utiliser Neat image dont voici le résultat avec la version gratuite et en prenant comme échantillon un rectangle en haut à droite de l'image: Amitiés JMC -

Exploration d'un bac extérieur rempli d' eau
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique L'algue filamenteuse n'est pas une cyanobactérie... Je pense à Geminella peut être , mais je ne suis pas très riche en algues d'eau douce ! Amitiés JMC -

Population de l'estran de la plage du Havre
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique Voisin dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique Bonne initiative ! c'est intéressant de pouvoir suivre les populations au cours de l'année . On dirait que les premières images de la série sont en contraste de phase ? avec une certaine perte de résolution par rapport au fond clair me semble-t-il ... En parlant d'estran cela m'a rappelé ce site qui décrit pas mal d'espèces : https://nature22.com/estran22/estran.html Amitiés JMC -

Piles coulées
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Il me semble que les diodes laser rouges sont alimentés en 2,2 volts et environ 30 mA.. Elle sont chatouilleuses sur la régulation/limitation du courant (risque d'emballement thermique) . Démonte la platine et vois le cheminement du PCB ... peut être y a t il juste une résistance entre le laser et la pile ? A moins qu'il y ait du monde en CMS du coté cuivre ! D'ailleurs on ne voit pas d'où vient l'alimentation de cette platine... AMitiés JMC -

Le Mystère des dominos.
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Un grand classique des "dominos" ce sont les vis qui se desserrent avec le temps = contact intermittent qui charbonne = surchauffe ! Je ne vois pas de rapport avec le fil de terre cependant ... AMitiés JMC -

Piles coulées
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Peut être que le circuit sert a allumer alternativement l'un et l'autre laser...Essaye de nettoyer avec un pinceau et de l'alcool , retourne le PCB pour voir s'il n'y a pas une puce dessous, tu en prends une photo pour voir les pistes et on essayera de faire de la rétro ingénierie; il n 'y a pas beaucoup de composants, c'est jouable... Amitiés JMC -

Cochenille les dégâts sur les branches .
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique Je suis impressionné par tes coupes dans un matériau aussi dur. Et devant l'étendue des déformations je me demande s'il n'y aurait pas une bactérie injectée par les cochenilles ? Ce n'est pas trop dans l'intérêt du parasite de détruire sa source d'alimentation ! Amitiés JMC -

Diatomées indicateurs des pollutions métalliques
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique Voisin dans Diatomées (Discussions)
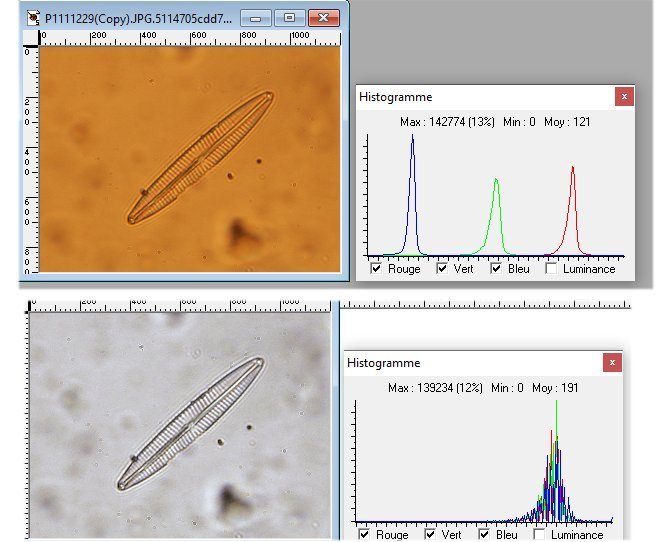
Bonjour Pour la balance des blancs : si microscope avec lampe halogène régler l'appareil photo sur lumière artificielle. Le réglage du condenseur n'agit pas sur la balance. Par contre fermer le condenseur améliore la profondeur de champ. Pour régler l'intensité de la lumière utiliser le potentiomètre de la lampe. Par exemple avec l'objectif 100 pousser la lumière a fond et fermer le condenseur. Mais les images sont récupérables ! voir ici : Voici le résultat : en jouant sur l'ajustage des 3 canaux et l'étirement de l'histogramme : Amitiés JMC -
Bonjour Dominique Je suppose que les images sont faites au Tomlov. La coupe colorée à l'acridine est magnifique ! Amitiés JMC
-

siphonophores
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
C'est le problème ! On n'a pas de référence pour déterminer la taille surtout dans les images sous marines . D’après la littérature, la plus longue chaine de zoïdes serait de l'ordre de 50 mètres...Je pensais aussi que la plupart des espèces étaient plus grandes mais sur des images scientifiques (avec échelle indiquée) on reste de l'ordre de 1 à 5 mm pour la taille des zoïdes, bien sûr la tige peut être bien plus longue...J' ai mis une échelle sur l'image de la cloche de muggiaea, les autres images sont à la même échelle. Les images partielles étaient faites à l'objectif X 6,3 Amitiés JMC