-
Compteur de contenus
4 166 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Messages posté(e)s par Jean Marie Cavanihac
-
-
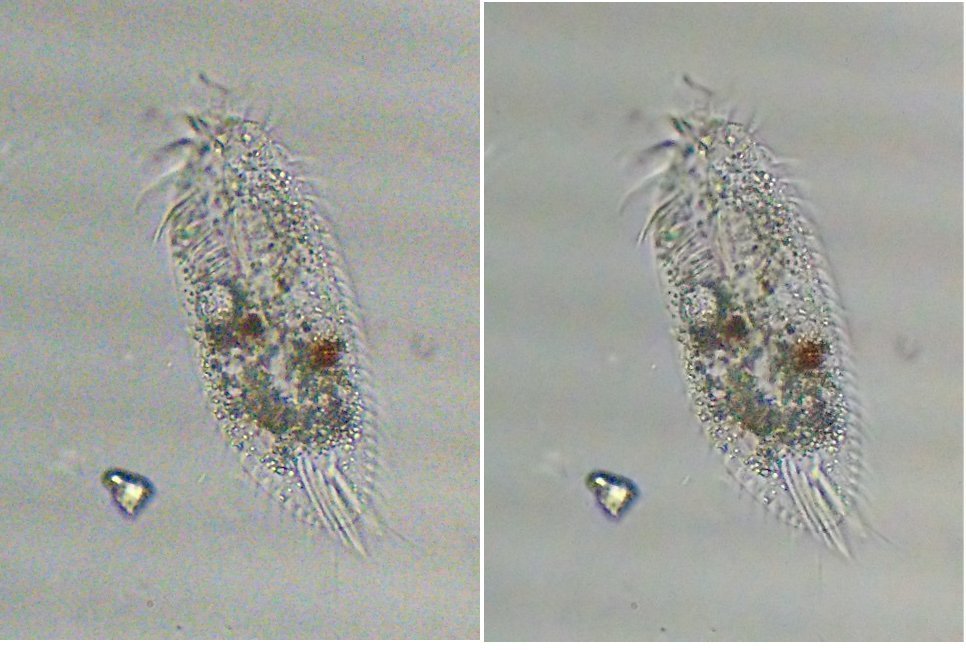
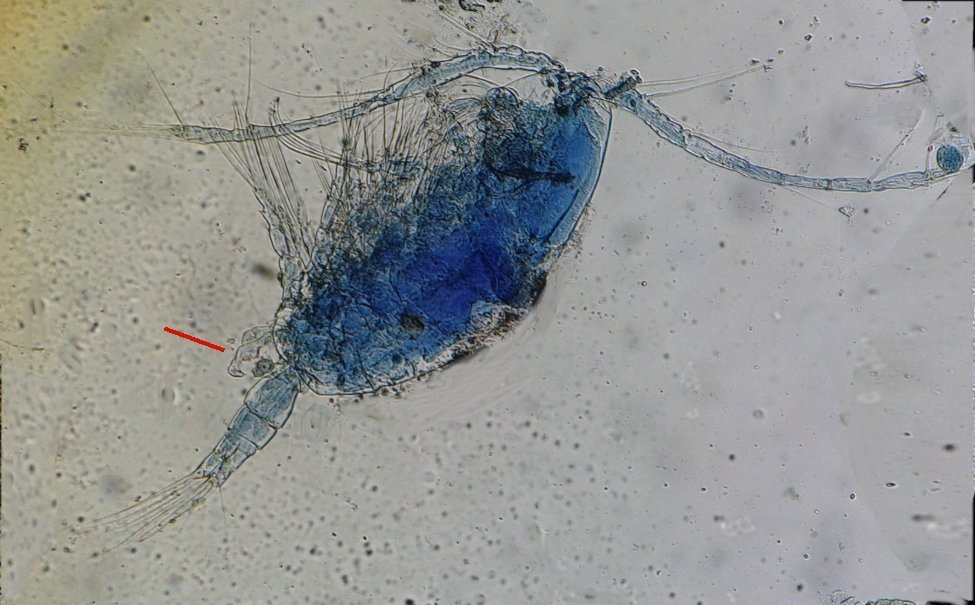
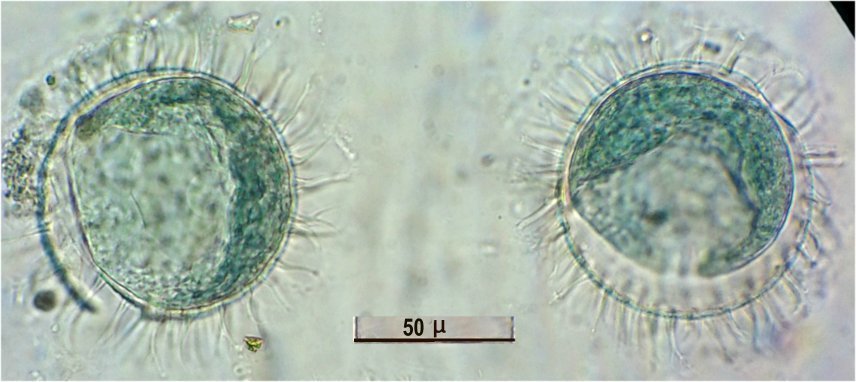
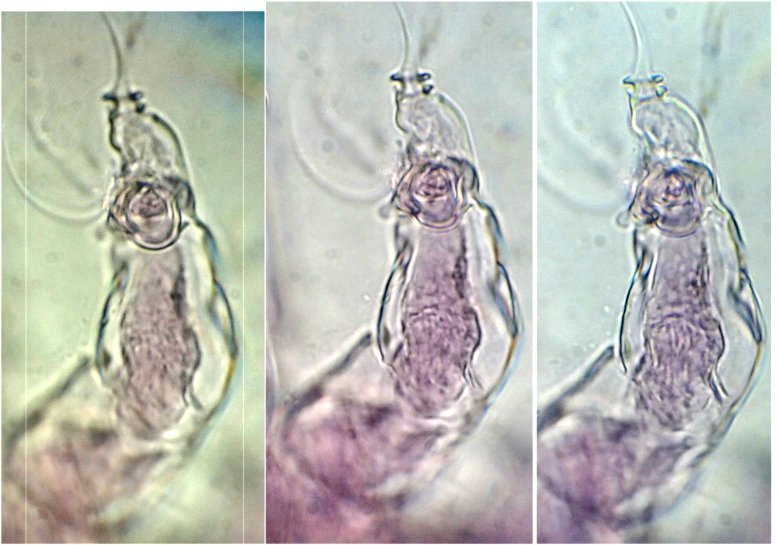
Il fait trop chaud pour aller chercher des échantillons, mais parfois ceux ci tombent littéralement du ciel !
En effet tous les matins des hirondelles tournent dans ma cour, se posent sur les fils à linge, gazouillent à tue tête, et parfois, en s’envolant, laissent un petit cadeau :
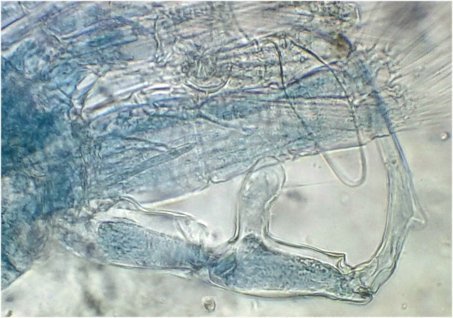
Voici donc sur une feuille du figuier une fiente qui mesure environ 1,5 cm.
En la diluant dans de l’eau , surtout la zone foncée, révèle un grand nombre de parties d’insectes. Sachant que les oiseaux n’ont pas de dents on peut s’interroger sur ce qui permet d’obtenir de si petits morceaux. Je pense que leur gésier doit contenir des particules de sable qui permettent la mastication.
N’étant pas entomologiste pour deux sous, je ne m’avancerai pas sur l’identification des insectes ingérés, mais contrairement à ce qu’on pense ce ne sont pas que des moustiques !
Il peut être utile d’utiliser une mini goutte de liquide vaisselle pour aider à mouiller les morceaux de kératine . A défaut d’identification on peut toutefois regrouper les structures par fonctions . Sauf mention contraire les images sont faites au x 15 :
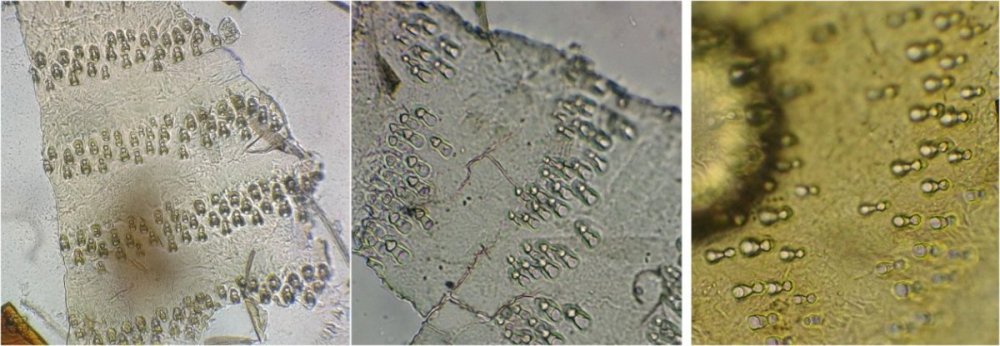
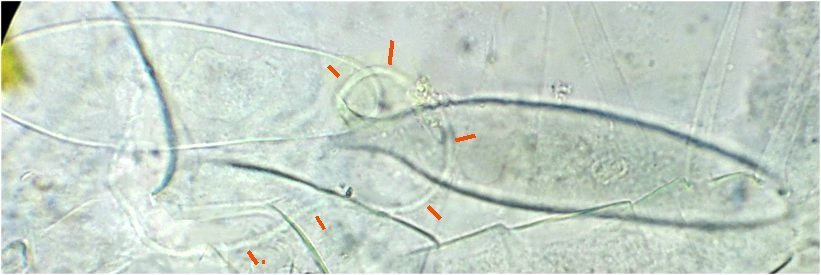
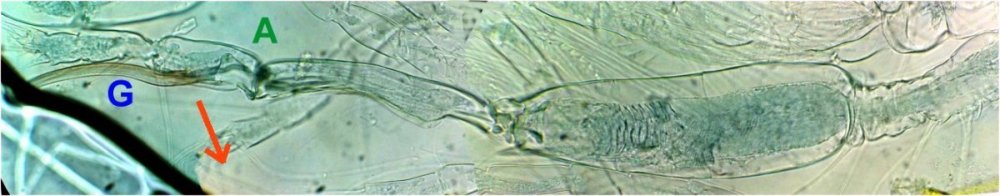
Les écailles d’ailes : on remarque la présence d’écailles longues et fines provenant certainement d’ailes de moustiques mais aussi d’autres types d’écailles :
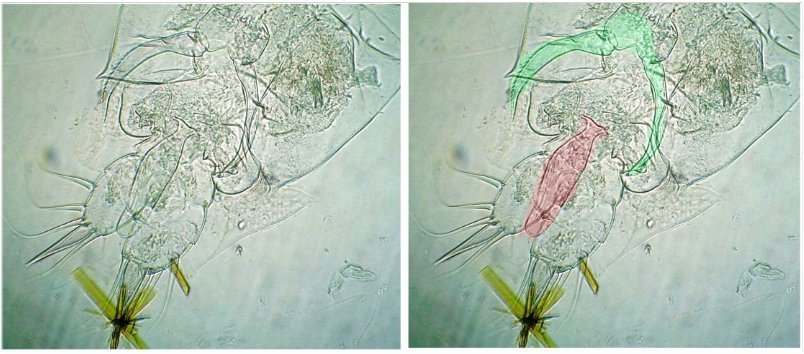
Des fragments d’ailes où l’on distingue les pédicelles d’attache des écailles
Voir ici : https://forum.MikrOscOpia.com/topic/19533-%C3%A9caille-des-papillons/#comment-81091
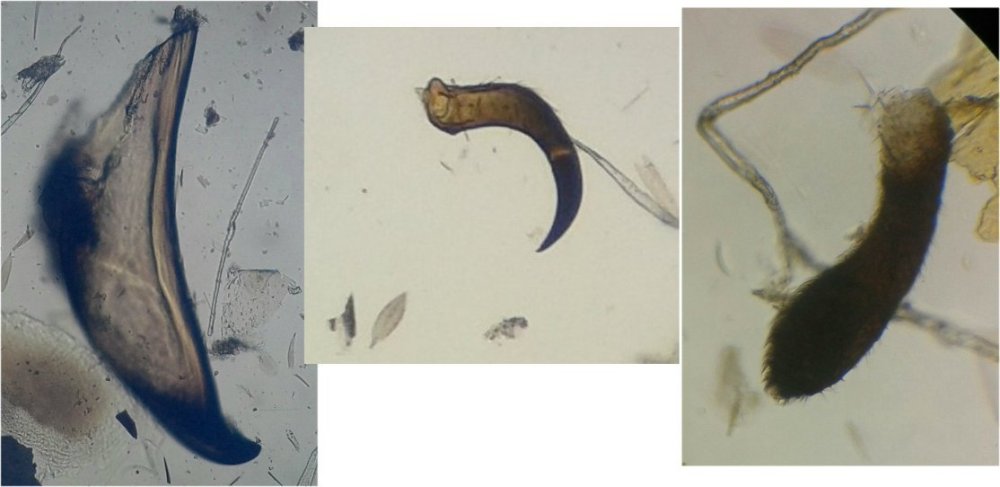
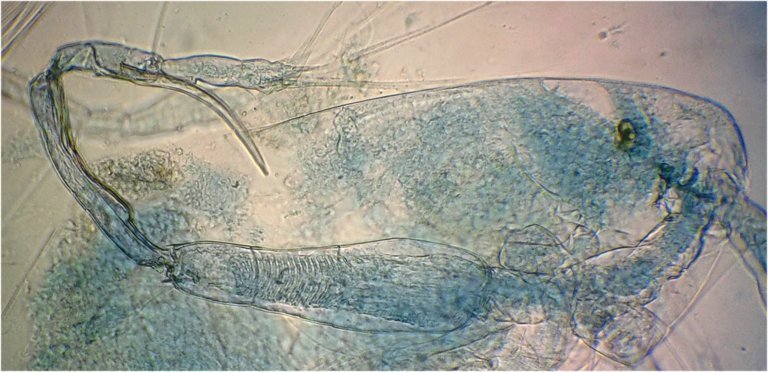
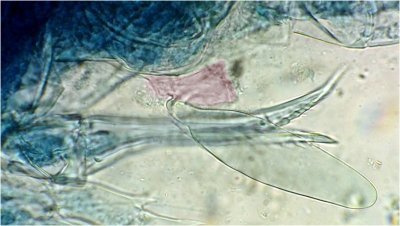
Des pattes difficiles à identifier car très morcelées
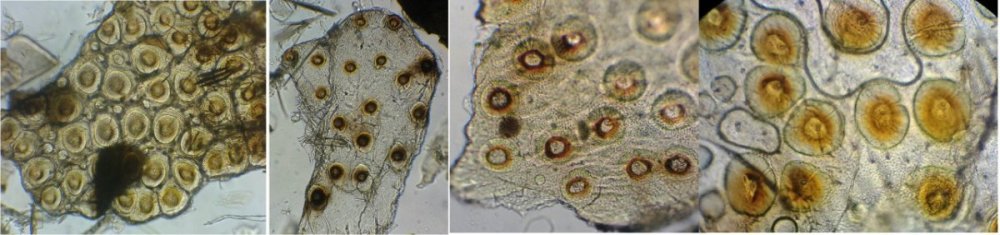
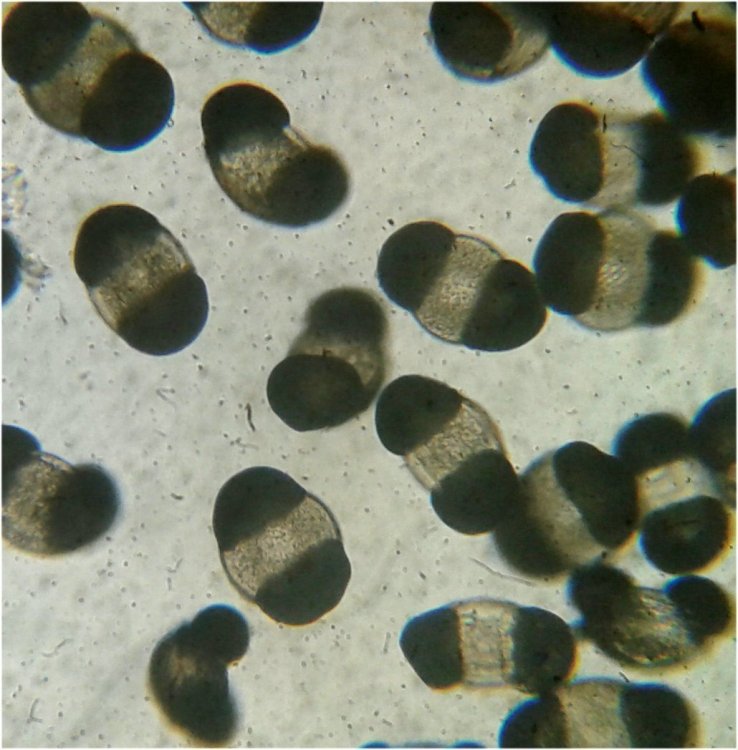
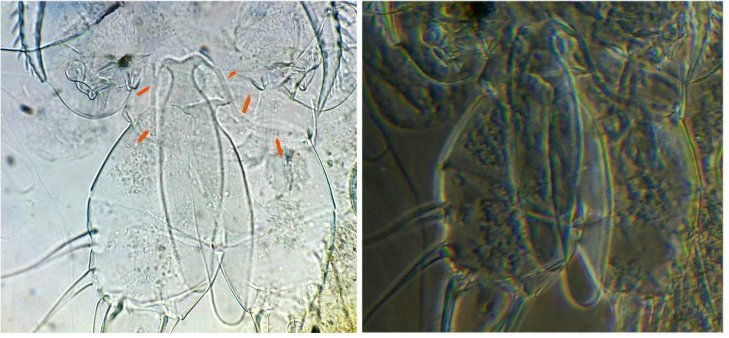
des cornées faciles à reconnaître par leurs éléments hexagonaux
des fragments d’épiderme ou d’élytres avec des ornementations circulaires et des poils aux centre de chacune
des griffes / mandibules / palpes
-
Bonjour à tous
Jean Marc , on peut utiliser le LM338 qui va à 3 A ce qui est largement suffisant pour des Leds . Pour calculer le courant dans R1 la formule est 1,25/R1. (R1 en ohms). L'inconvénient est que toute l'intensité va passer par le rhéostat R1 qui doit tenir le coup... ça se trouve des rhéostats 2 W mais c'est un peu cher.Je préconiserait un commutateur 6 positions commutant des résistances de puissance (entre 1 et 2 w) sachant que c'est rare qu'on ait besoin d'un réglage très fin de la lumière...*
Je peux faire un schéma si besoin
Amitiés
JMC
* J'ai une alim simplifiée pour led 1 W avec 2 positions : Normal et Boost cette dernière position n'étant utilisée que pour le X 40
-
Bonjour
En analogique il y a le LM338 K qui peut aller jusqu'à 5 ampères (3 A pour 338 sans K) et son montage en générateur de courant ci dessous.. On doit pouvoir remplacer R1 par un commutateur de plusieurs résistance supportant les intensités demandée; on n'a pas forcément besoin d'un réglage fin...

Amitiés
JMC
-
Bonjour
vu sur ce site plusieurs types de radiateurs et même certains ventilés de petite taille . pour une LED 3 watts que l'on n'utilise pas toujours à pleine puissance cela doit suffire...Pour l'alimenter en courant continu c'est moins évident, les drivers "tout fait" sortent en courant alternatif....
Amitiés
JMC
-
Bonjour
Je voudrais attirer l'attention sur le fait que ces petits modules d'alimentation ne sont pas des générateurs de courant . Une faible variation du réglage de la tension peut faire varier dans de grandes proportions le courant dans la led . voir ici
https://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-LEDS-2/LEDS2.htm
A défaut un fusible en série avec la LED me parait indispensable : par exemple pour LED 3 watts fusible 1,5 A, pour 10 watts 3,15 A ou 4 A etc...
Amitiés
JMC
-
Bonjour Jean Luc
Moi c'est Jean-Marie (pas Jean Marc ! )
Le problème principal pour la LED c'est de pouvoir la positionner à la place de l'ampoule actuelle. Bien que la LED soit plus petite , il faut aussi loger son radiateur indispensable. Pour une remplacer une ampoule de 30 w on peut estimer qu'une LED 3 W (qui consomme 1 ampère) est suffisante. Les alims pour LEDS disponibles travaillent en courant constant mais en alternatif ! Il faut concevoir une alimentation filtrée en courant continu ou utiliser une alimentation de laboratoire réglable en courant.
Il faudrait avoir une photo de l'ampoule en place pour voir si la transformation (réversible) est possible
Pour Neat Image le principe est de prendre un échantillon de bruit seul sur une zone unie de l'image et de faire son spectre en fréquence puis le soustraire de l'Image. Probablement en utilisant la transformée de Fourier. Mais si on peut d'emblée obtenir une bonne image le post processing est inutile.
AMitiés
JMC
-
Bonjour Jean Luc
Vraiment intéressante ta démarche , que l'on pourrait aussi appliquer au zooplancton vivant et qui m'intéresse à ce titre !.
Pour le scintillement (et les barres sur les images) la solution serait de passer en éclairage LED alimenté en courant continu filtré , il pourrait être même possible au moment de la prise de vue de suralimenter brièvement la LED pour faire un pseudo flash (comme sur les téléphones) .
Pour le bruit on peut utiliser Neat image dont voici le résultat avec la version gratuite et en prenant comme échantillon un rectangle en haut à droite de l'image:

Amitiés
JMC
-
Bonjour Dominique
L'algue filamenteuse n'est pas une cyanobactérie... Je pense à Geminella peut être , mais je ne suis pas très riche en algues d'eau douce !
Amitiés
JMC
-
-
Bonjour Dominique
Bonne initiative ! c'est intéressant de pouvoir suivre les populations au cours de l'année . On dirait que les premières images de la série sont en contraste de phase ? avec une certaine perte de résolution par rapport au fond clair me semble-t-il ...
En parlant d'estran cela m'a rappelé ce site qui décrit pas mal d'espèces :
https://nature22.com/estran22/estran.html
Amitiés
JMC
-
Bonjour
Lors de l'identification du copépode paracartia grani Lien ci dessous
https://forum.MikrOscOpia.com/topic/20108-reproduction-du-copépode-paracartia-grani/#comment-83424
L'identification avait été facilitée par sa pince (P5) :

en reprenant une autre lame voici une nouvelle pince qui parait utiliser le même principe et permet d'identifier l'espèce : Acartia clausi de la même famille que le précédent . (Image au x 40)

Une photo du mâle : ce n'est pas sa pince qui est un peu cachée (flèche) mais celle d'un autre spécimen : (Image au x 6,3). L'antenne géniculée est celle de gauche sur l'image

Pour l'instant je n'ai pas identifié la femelle mais il doit y en avoir sur la lame.
Identification grâce a "M.ROSE(Faune de France 26)Copepodes-pelagiques". J'en profite pour rendre hommage à tous ces scientifiques, qui ne disposant pas de moyens photos aussi pratiques que les nôtres, ont réalisé à la main les dessins des détails d'identification !
Amitiés
JMC
-
Bonjour
Une image que j'ai retrouvée sur une autre lame montrant l'antennule géniculée pliée dans la position qui maintien la femelle :

Amitiés
JMC
-
Bonjour
Allez je tente Colpidium ?
http://protist.i.hosei.ac.jp/pdb/images/ciliophora/colpidium/index.html
Amitiés
JMC
-
Piles coulées
dans Sujets
Bonjour
Il me semble que les diodes laser rouges sont alimentés en 2,2 volts et environ 30 mA.. Elle sont chatouilleuses sur la régulation/limitation du courant (risque d'emballement thermique) . Démonte la platine et vois le cheminement du PCB ... peut être y a t il juste une résistance entre le laser et la pile ? A moins qu'il y ait du monde en CMS du coté cuivre ! D'ailleurs on ne voit pas d'où vient l'alimentation de cette platine...
AMitiés
JMC
-
Bonjour
Un grand classique des "dominos" ce sont les vis qui se desserrent avec le temps = contact intermittent qui charbonne = surchauffe ! Je ne vois pas de rapport avec le fil de terre cependant ...
AMitiés
JMC
-
Piles coulées
dans Sujets
Bonjour
Peut être que le circuit sert a allumer alternativement l'un et l'autre laser...Essaye de nettoyer avec un pinceau et de l'alcool , retourne le PCB pour voir s'il n'y a pas une puce dessous, tu en prends une photo pour voir les pistes et on essayera de faire de la rétro ingénierie; il n 'y a pas beaucoup de composants, c'est jouable...
Amitiés
JMC
-
Bonjour Dominique
Je suis impressionné par tes coupes dans un matériau aussi dur. Et devant l'étendue des déformations je me demande s'il n'y aurait pas une bactérie injectée par les cochenilles ? Ce n'est pas trop dans l'intérêt du parasite de détruire sa source d'alimentation !
Amitiés
JMC
-
Bonjour
Merci Dominique mais j'ai eu la chance de retrouver cette lame (en fait 2) contenant beaucoup de spécimens. J'avais dû la faire compte tenu de l’abondance de calanus dans l'échantillon ...et en plus ce devait être une période de reproduction
J'ai oublié de citer une référence intéressante :
Amitiés
JMC
-
Additif
J'ai oublié l'image de la femelle (ici en fond noir, le sujet étant devenu très transparent ), la flèche verte montre la pince )

-
Pourquoi s’intéresser à la reproduction de cette espèce de copépodes ? A cause de leur importance dans le transfert d’énergie, dans la chaîne alimentaire, entre le phytoplancton et le zooplancton. Les copépodes sont une des sources principale d’alimentation des jeunes poissons.
Leur nombre est considérable, et pour une seule autre espèce (calanus finmarchicus) abondante dans les mers du nord, on estime la production à ...300 millions de tonnes par an!
Sur d’anciennes lames de plus de 20 ans montées à la gélatine glycérinée se trouve ce copépode d’ espèce calanus et deux choses attirent l’ attention : une patte en forme de pince P5 et une antennule A1 (à droite de l’image ) où l’on voit des segments élargis . Il s’agit d’un dimorphisme sexuel et j’ai cherché des explications sur le Net ….Ce qui m’a entraîné dans une recherche à plusieurs niveaux avec des aller-retours sur cette lame. L’espèce ici est Paracartia grani (décrite dans un article précédent ) et ces deux particularités servent à l’accouplement.

Voici en résumé succinct le processus (qui peut avoir des variantes selon les espèces ): le mâle maintient la femelle au moyen de la griffe de l’ antennule géniculée et grâce à cette pince P5 (une cinquième paire de pattes modifiée) lui transfère un spermatophore qui va adhérer à l’abdomen.( cas de l’espèce Paracartia )
Selon l’espèce la femelle transfère le sperme (qui n’est pas mobile) dans sa spermathéque ou garde le spermatophore qui lui servira à féconder ses œufs en temps utile selon leur maturation…Les spermatozoïdes n’ont pas de flagelle et ne sont pas mobiles .
Une recherche méthodique sur la lame montre le spermatophore sur lune femelle : coloré en rose sur l’image de droite, la pince a été colorée en vert. Au fil du temps les spécimens se sont éclaircis ce qui explique les images peu contrastées.

En reprenant la même lame et en l’ explorant méthodiquement on y trouve deux mâles et une dizaine de femelles et voici le résultat : quelques images au x 15 : sur la deuxième image le spermatophore a été coloré en rouge car peu visible sous le spécimen ...
Il y a peu d’images de cet « organe » temporaire sur le Net d’où l’intérêt de ce montage d’images : Les spermatophores présentent tous une forme particulière à leur extrémité supérieure et sont tous positionnés exactement au même endroit sur la femelle . Selon la littérature, le mâle de cette espèce utilise une plaque portant le spermatophore qui s’adapte parfaitement à la morphologie de la femelle et la colle avec une substance adhésive

On voit ici le spermatophore avec la pince du mâle , peut être en cours de transfert

En cherchant sur une autre lame on voit la pince de la femelle en train de manipuler le spermatophore : on ignore si elle cherche à le retirer, mais la partie colorée en rose pourrait être la plaque citée plus haut.

Observant de prés la dernière image du montage (celle avec les deux spermatophores ) sur l’agrandissement ci dessous on distingue (flèches rouges ) ce qui semble être deux tubes partant de la partie supérieure (flèches rouges ) : un des spermatophores est bien placé mais le second semble collé au hasard. Peut être celui d’une autre espèce ? Images au x 40, en contraste de phase pour l’image de droite. Il s’agit peut être d’un artefact ?

Un autre balayage de la lame permet cependant de trouver une femelle d’une autre espèce qui porte deux spermatophores en position différente: et ceux ci semblent bien avoir au moins un tube
Un gros plan au X 40 laisse deviner ce tube très long (flèches rouges) : le col du spermatophore peut s’allonger beaucoup lors du transfert.

Enfin , prés de 2 spécimens femelles, quelques œufs : probablement œufs de résistance avec une enveloppe épineuse

En conclusion de cette observation assez exceptionnelle , sur laquelle j’ai passé plusieurs heures , il est intéressant de voir qu’avec le temps on peut approfondir la connaissance des spécimens et voir par soi même des choses qu’on ne rencontre pas souvent dans les documentations !
Actuellement avec la qualité des photos et surtout la connaissance des détails à observer je ne fais plus de montage de lames...Je préfère les observations « live »
-
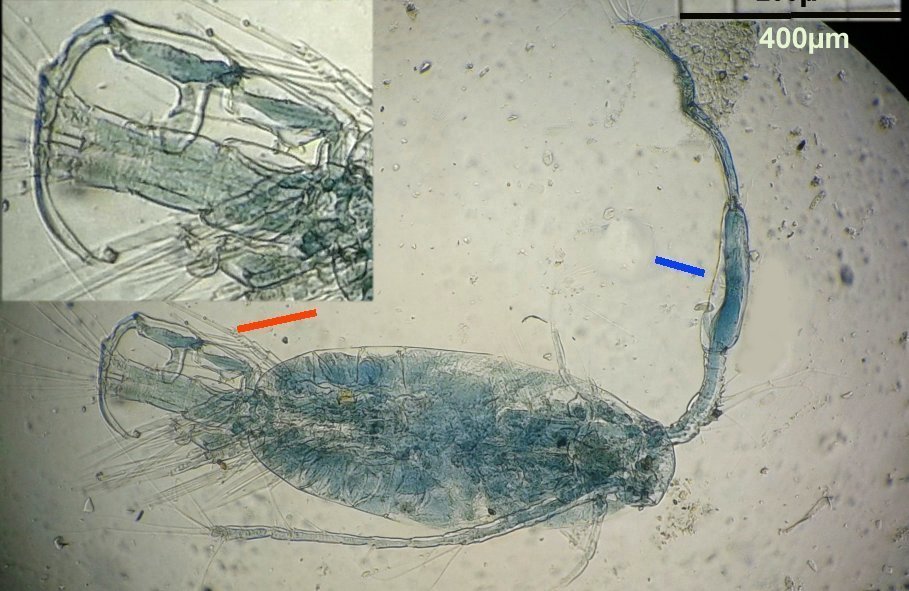
Dans tous les prélèvements marins on rencontre des copépodes à tel point qu’on finit par ne plus y faire attention. Il sont même parfois gênants car leurs mouvements rapides sur la lame déplacent les sujets que l’on observe . Au début de mes observations de plancton , il y a une vingtaine d’années, j’avais fait quelques lames montées à la gélatine glycérinée… En revisitant ces lames je retrouve cette image colorée d’un copépode de l’ordre des Calanus (qui compte une quarantaine de familles) :

On remarque deux choses : flèche rouge : une patte de la cinquième paire fortement modifiée (appelée P5) et flèche bleue : une antennule (A1) présentant une partie élargie . Ces deux détails font penser à un dimorphisme sexuel … Et vont aider à identifier l’espèce.
Il existe des clés de détermination (voir fin de page ) mais je ne suis pas à l’aise avec elles car elles supposent de connaître parfaitement la terminologie utilisée dans leur domaine et surtout de pouvoir visualiser les parties du spécimen qui permettent cette identification : en effet souvent les appendices intéressants sont cachés sous les spécimens.
Exemple de définition de clé : et ce n’est pas la plus compliquée :
Pointe terminale de Re3 de P3 et P4 fortement dentée en dehors ; F plus de 5 fois plus longue que large . »
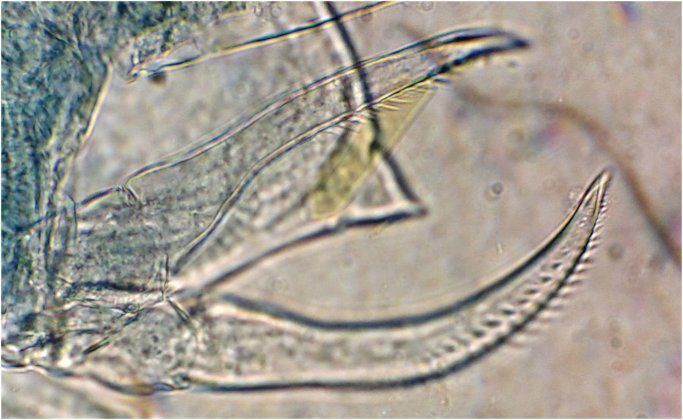
Ici la pince très particulière (en médaillon) et assez bien visible, devrait nous aider ainsi que la particularité de l’antennule ...
Le recueil de 1933 de « Faune de France 26 » fourni des dessins correspondants qui identifient Paracartia Grani (en fait il semblait y avoir un doute par rapport à Acartia mais c’est la même famille).
Avec ce nom précis on peut interroger la remarquable base de données de l’Observatoire de Banyuls qui donne la fiche d’espèce de Paracatia Grani et les documents y afférant, provenant de plusieurs études sur l’espèce.(lien plus bas)
On retrouve les références bibliographiques de ces études sur le Net ; quelques planches extraites confirment la forme de la pince et montrent aussi celle de la femelle.

On remarque la complexité de la pince du spécimen mâle et on est un peu dans le cas où l’on trouve une pince mécanique dédiée à une spécialité artisanale et qui n’a qu’une seule fonction ; par exemple :

(Ici pince à Avoyer = donner de la voie à une lame de scie à bois en inclinant chaque dent alternativement sur la gauche et sur la droite )
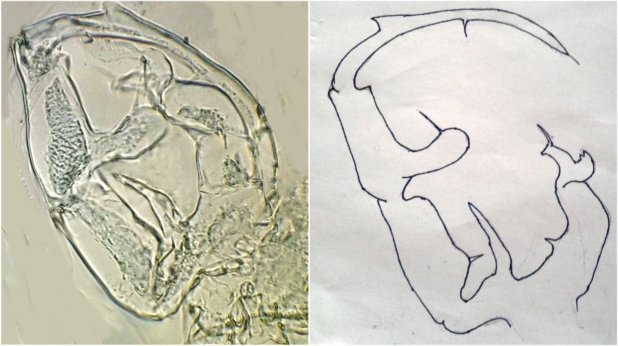
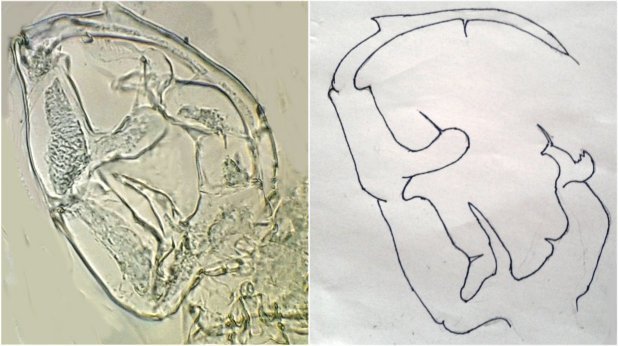
On se doute que cette pince a une finalité précise dans l’accouplement , mais connaître son fonctionnement serait intéressant : cela s’apparente à de la rétro-ingénierie sur de la micro-mécanique. Comme il y a deux ou trois mâles sur la lame, on trouve diverses positions de la pince dont voici une image ‘nettoyée’ , à droite un schéma que j’ai fait à partir de ces images

La structure à droite sur mon dessin, en face de ce qui semble être une palette, a une structure très complexe et n’est pas plane : 3 images à des focalisations différentes au X 40 : pièce décrite comme « portant une pince, une tenaille, une cisaille »

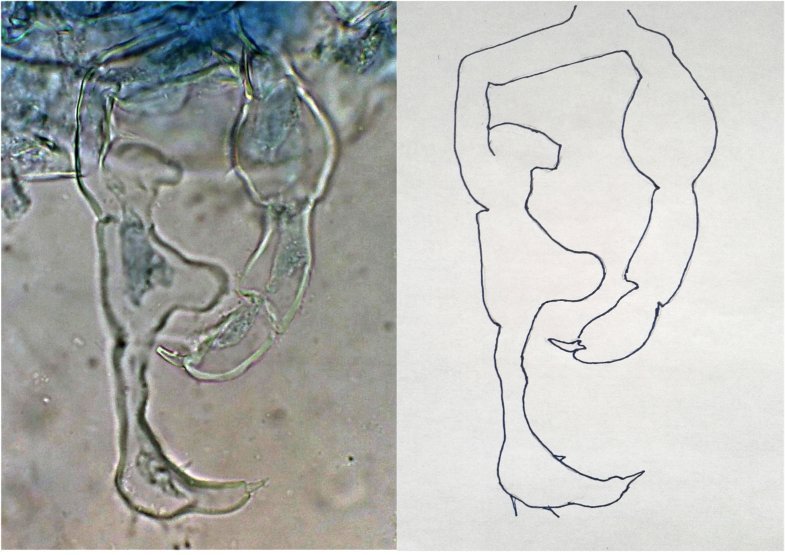
On retrouve aussi sur les planches, le dessin de l’antennule A1. Photo ci dessous au x 40 Elle est aussi décrite et l’on apprends que c’est une antennule géniculée, à cause de la forme de l’articulation rappelant celle du genou. (A) Image au X 40 ci dessous :
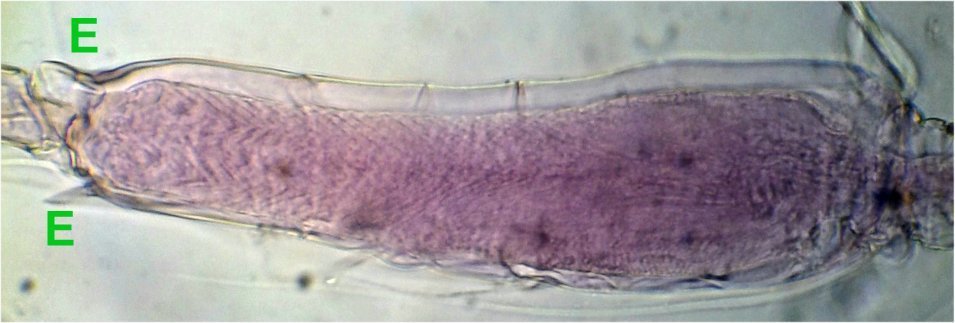
G : griffe terminale (fortement colorée naturellement), A articulation ‘genou’ , flèche : sens de la flexion
On voit mieux sur cette image la partie épaissie qui montre un motif en chevrons qui fait penser à une fonction anti dérapante: les épines E semblent limiter la flexion du 2eme segment ...

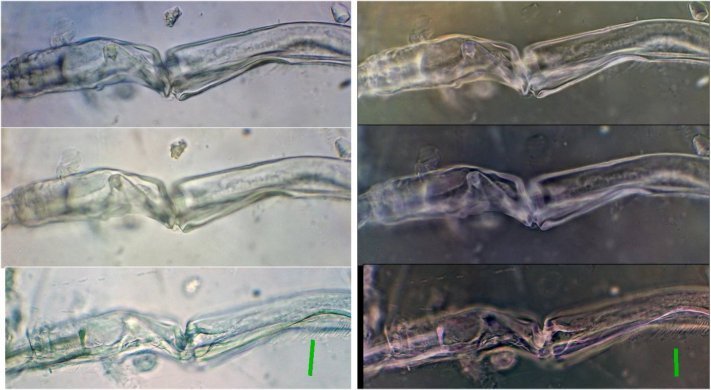
Voyons de plus près le genou (A) à plusieurs niveaux de focalisation (à droite en négatif : on voit mieux des poils sur le 2eme segment : flèche verte )

J’ai passé plusieurs heures sur cette lame à retrouver des détails dont je découvrais l’existence au fil de mes lectures … la présence de plusieurs spécimens dans des positions différentes a été d’une aide précieuse.
J’ai aussi appris que ce copépode, observé la première fois en Norvège, est apparu dans nos contrées méridionales vers 1998 probablement à l’ occasion de transferts de coquillages depuis les parcs conchylicoles atlantiques vers les parcs des lagunes de méditerranée.
https://copepodes.obs-banyuls.fr/en/fichesp.php?sp=70
Advances in MARINE BIOLOGY The Biology of Calanoid Copepods by J. MAUCHLINE Dunstaffnage Marine Research Laboratory, Oban, Scotland Series Editors J.H.S. BLAXTER
1998 - Academic press
M.ROSE(Faune de France 26)Copepodes-pelagiques - 1933
FÉDÉRATION FRANÇAISE DES SOCIÉTÉS DE SCIENCES NATURELLES
-
Bonjour
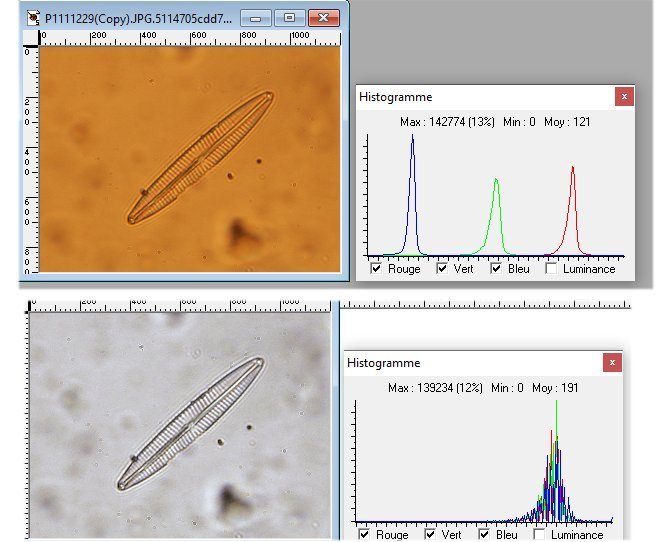
Pour la balance des blancs : si microscope avec lampe halogène régler l'appareil photo sur lumière artificielle. Le réglage du condenseur n'agit pas sur la balance. Par contre fermer le condenseur améliore la profondeur de champ. Pour régler l'intensité de la lumière utiliser le potentiomètre de la lampe. Par exemple avec l'objectif 100 pousser la lumière a fond et fermer le condenseur.
Mais les images sont récupérables ! voir ici :
Voici le résultat : en jouant sur l'ajustage des 3 canaux et l'étirement de l'histogramme :

Amitiés
JMC
-
Bonjour Dominique
Je suppose que les images sont faites au Tomlov. La coupe colorée à l'acridine est magnifique !
Amitiés
JMC
-
C'est le problème ! On n'a pas de référence pour déterminer la taille surtout dans les images sous marines . D’après la littérature, la plus longue chaine de zoïdes serait de l'ordre de 50 mètres...Je pensais aussi que la plupart des espèces étaient plus grandes mais sur des images scientifiques (avec échelle indiquée) on reste de l'ordre de 1 à 5 mm pour la taille des zoïdes, bien sûr la tige peut être bien plus longue...J' ai mis une échelle sur l'image de la cloche de muggiaea, les autres images sont à la même échelle. Les images partielles étaient faites à l'objectif X 6,3
Amitiés
JMC












Ce que mangent les hirondelles...
dans Jean Marie CAVANIHAC
Posté(e)
suite
des ailles
des enveloppes céphaliques / pièces buccales
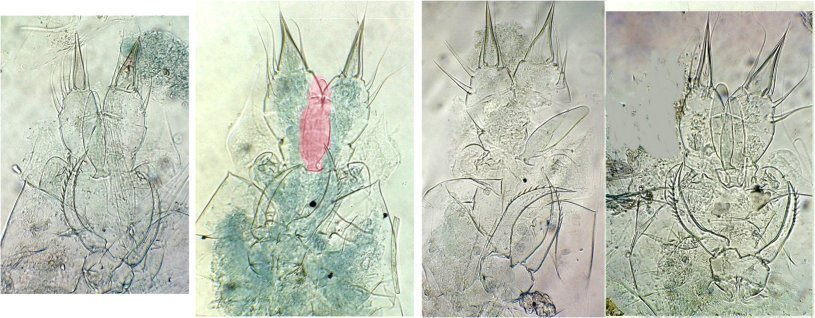
Un objet inattendu qui rappellerait un œuf
Sur des thèmes voisins de cette « coprologie aviaire » voir aussi :
https://forum.MikrOscOpia.com/topic/17024-fiente-de-pic-vert/#comment-67569
Amitiés
JMC