-
Compteur de contenus
8 530 -
Inscription
Tout ce qui a été posté par Tryphon M
-

La jarre de Coplin
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour, Personnellement je ne le sais pas. Est-ce l'inventeur qui dans ce cas devait être microscopiste ou chercheur ou est-ce un fabricant? En tout cas il n'a pas laissé de procédé de coloration. La question a déjà été posée sur Histonet, mais il n'y a pas eu de réponse non plus. Si quelqu'un a une idée, la question est intéressante. Cordialement. -
Bonjour Alain, Le sujet a disparu car la photo a déjà été publiée à plusieurs reprises dans MikrOscOpia et que la raison pour laquelle je l’avais ouvert a disparue également. En fait j’avais écris un sujet dans Futura-Sciences pour signaler une erreur et je n’arrivais pas à passer ma pièce jointe car le bouton le permettant n’était pas activé. J’avais mis à la place de ma pièce jointe un lien vers le sujet maintenant effacé pour que l’on puisse voir la photo. Comme le problème a été résolu, j’ai enlevé le sujet. Mon message est ici : http://forums.futura-sciences.com/thread215924.html. Je ne pense pas que ces « facettes » soient une grande découverte et que mon explication soit la seule, mais je me devais de répondre à ta question. Cordialement.
-
Bonsoir Alain, Excusez-moi du retard, votre message ne m’avait pas été signalé ! Bravo pour votre perspicacité, vous êtes le premier à l’avoir remarqué, en tout cas signalé. Les ommatidies sont bien « carrées » il n’y a aucun truquage et la mouche est tout à fait ordinaire. Simplement quand j’ai une lame sous la main (et les yeux) je remarque en premier ce qui me parait sortir de l’ordinaire alors que d’autres, éliminent tout ce qui leur parait atypique. Cette image est donc bien réelle et il faut faire avec. Je me suis posé la question et la réponse que je me suis donnée est la suivante. Certes, les facettes sont majoritairement hexagonales ce que l’on nous explique souvent comme un principe d’économie. Mais sur les bords de la « sphère » oculaire ? Il me parait plus simple que les facettes soient des carrés. Et c’est bien ce que l’on voit quand on se donne la peine de regarder jusqu’à bord de l’œil, un passage progressif d’une forme à l’autre. Je suis persuadé que beaucoup d’autres ont remarqué le phénomène, mais n’en ont pas beaucoup parlé. Vous avez vu l’image où ? Cordialement.
-

nouveau dans la microscopie
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonsoir Sébastien et Laure, Malheureusement la photo ne nous est pas parvenue. Il faudrait la reposter. Cordialement. -

recherche optique
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour, Désolé pour vos malheurs, mais je vous remercie de nous les avoir racontés. Je crois qu'entre microscopistes, nous pouvons nous réconforter. Aussi nous sommes à votre disposition pour vous donner plus de renseignements qui pourraient vous être utiles et de vous accueillir parmi nous si vous le désirez. Cordialement. -

recherche optique
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonsoir, Les optiques manquantes sont les oculaires. Ce n'est pas bien grave, cela doit se trouver facilement et pas trop cher. Je conseille d'aller demander conseil à un Opticien de votre ville. Si je peux me permettre un conseil. Ce microscope à l'air d'avoir souffert d'un long stockage à la poussière. Et comme les oculaires sont absents et que la sortie photographique est également ouverte à la poussière et aux "intempéries" un bon nettoyage est vraisemblablement indispensable ! Mais attention ! Je vous mets en garde contre un nettoyage intempestif avec une technique et des produits inappropriés ! Un microscope est un instrument de très grande précision et les optiques sont TRES fragiles et ne supportent pas n’importe quelle intervention. Là encore je vous recommande de demander conseil à votre Opticien qui saura le nettoyer. Cordialement. -

Recherche microscope pour étude d'alliage
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Pierre Merci pour votre demande. Pour ce que vous voulez faire, un microscope métallographique conviendrait bien sûr mais aussi n’importe quel microscope biologique équipé pour l’épiscopie (éclairage par l’objectif) et il y en a beaucoup même en occasion. Je voudrais vous signaler en outre que l’échantillon devra être préparé avant examen. Des coupes fines sont possibles très mais rarement utilisées puisqu’on arrive au même résultat en examinant les surfaces après polissage. Dans ce cas on peut être amené à les attaquer à l’acide. Malheureusement question relief, il ne faut pas trop y compter puisque ce sont des surfaces lisses et que la profondeur de champ du microscope est très faible. Il ne faut pas confondre les microscopes binoculaires métallographiques avec de simples microscopes stéréoscopiques (appelés aussi loupes binoculaires) qui n’ont que de faibles grossissements mais donnent du relief. Heureusement l’impression de relief en métallographie peut être accentuée par l’utilisation du contraste de phase en lumière réfléchie et le contraste interférentiel (toujours en lumière réfléchie) mais qui ne sont disponibles que sur de microscopes métallographiques de haut niveau et fort chers. Bien entendu, souvent, la résolution du microscope photonique est insuffisante et l’on doit utiliser le microscope électronique, mais cela dépasse le cadre du forum. Nous sommes à votre écoute pour d’autres questions. Cordialement. -

Utiliser un microscope pour lires des microfiches.
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Bruno, Un lecteur numériseur de microfiches est un appareil très onéreux, encore faut’ il s’entendre sur la définition d’un tel appareil. Certains lecteurs peuvent délivrer des photocopies extraites de la fiche mais dans ce cas on ne peut pas parler de véritable numérisation, c’est une simple photocopie. Si c’est pour consulter facilement les vues de la microfiche sans lecteur et les archiver, cela peut convenir parfaitement. Pour un traitement informatique du contenu de ces fiches, cela ne suffit pas. Il faut une véritable « numérisation » suivie d’une reconnaissance de caractères (OCR) et plus délicat, transformer les images et schémas en dessins vectoriels (vectorisation) ... Tout dépend donc de l’usage que l’on veut faire de ces fiches. Un scanner pourrait à la limite (voir exemple plus bas) convenir à une consultation et un archivage mais l’emploi d’un microscope me parait complètement inadapté. Cordialement. -

Matériel pour identification diatomées
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Stéphane, Je ne fais pas partie des « diatomistes » du forum, mais je peux commencer à vous répondre en attendant d’autres réponses de membres. Pour l’observation des diatomées, il suffit d’un microscope simple mais sérieux, pas besoin d’un très gros matériel, pourvu qu’il soit pourvu d’un objectif à immersion 100 X et d’un bon système d’éclairage. Qui dit étude des indices IBD, IPS, suppose donc un travail long et sérieux qui nécessite un microscope d’une bonne ergonomie. Voir ce lien * à titre d’exemple, ce n’est pas une publicité (!) et de nombreux microscopes de cette catégorie (microscopes pour « amateurs éclairés ») feraient l’affaire. Bien entendu il existe des microscopes des grandes marques de l’optique, cependant, ils coûtent généralement plus cher mais offrent des possibilités d’extension pour certains beaucoup plus grandes. N’hésitez pas à nous poser d’autres questions. Cordialement. * http://forum.MikrOscOpia.com/index.php?showtopic=3048 -

Recherche matériel
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Cher Visiteur, Merci de nous avoir choisis pour poser cette question. Mais elle en entraine d’autres de notre part. Celle du budget, car il y a des solutions très onéreuses. Et celles du type de défauts observés. - Une rupture peut se constater très facilement car il y a soit une solution de continuité soit une absence de matière. - Pour l’usure, c’est déjà plus difficile et tout dépend de tolérance que l’on s’impose. - Pour la fatigue, cela dépasse le cadre de l’examen microscopique classique à moins que les pièces soient transparentes. Les solutions peuvent donc passer par l’emploi d’une loupe binoculaire (stéréomicroscope) pour les ruptures de pièces, d’un microscope métallographique ou d’un projecteur de profil, pour l’usure, et la radiographie ou l’examen en microscopie électronique pour la fatigue. Attendez un peu pour avoir plus de réponses certains de nos membres sont en vacances. Cordialement. -

Utiliser un microscope pour lires des microfiches.
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonsoir Claude, Cela me parait tout à fait réalisable, mais je pense qu’il faudrait utiliser un pied photo ou rendre l’appareil fixe, régler la MAP et utiliser un déclencheur souple car s’il y a beaucoup de clichés à prendre, tenir l’appareil à la main doit être assez fastidieux de plus les vues risquent d’être mal cadrées et bougées. Cordialement. -

Utiliser un microscope pour lires des microfiches.
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Et je confirme que j'ai bien un éclairage dans le couvercle du scanner ! -
Bonjour Viviane, J'ai bien reçu votre demande et vous en remercie. Ca y est votre inscription est faite. Merci pour votre contribution dans cette partie du forum. A bientôt parmi nous.
-
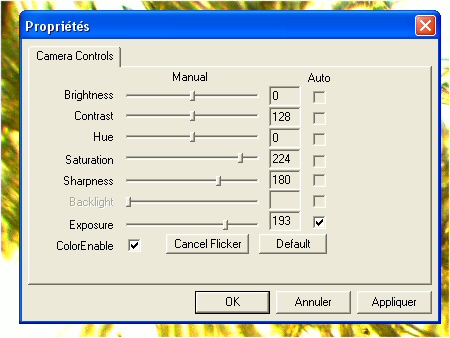
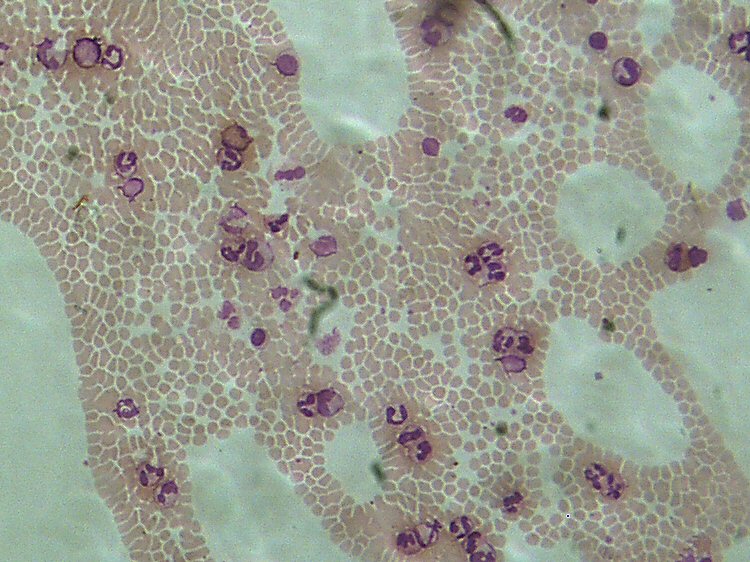
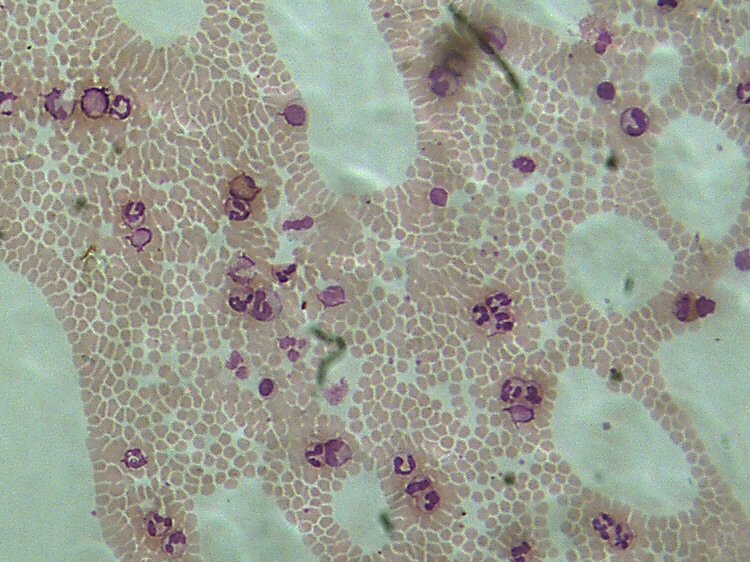
Voir les nouvelles photos dans la Galerie ! Vous verrez à la fois le Champ et la résolution à l'échelle UN. (Cliquez sur la loupe jusqu'à agrandissement maximum) Bonjour à tous, Je viens de recevoir de Jean Peynichou, une camera pour microscope, la Jincheng DM 300. (Jincheng DM 300 Electric Eyepice) Je n'ai pas pu résister à faire un test très rapide tellement elle est jolie (un beau bleu électrique) et qu'elle parait performante. Je l'ai donc montée sur le seul port compatible du microscope. (Réservé à la vidéo) .Malheureusement ce n'est pas le troisième œil d'une trino et il y aurait des adaptations mécaniques et optiques à faire. Si le câble USB avait été un peu plus long j'aurais pu la tester sur un microscope plus compatible. Le logiciel fourni , Artsoft, ne permet pas de tirer le meilleur parti de la camera, alors sous les conseils de Jean, j'ai utilisé le logiciel ScopePhoto fourni avec les DCM. Le résultat a été immédiatement satisfaisant les couleurs sont excellentes et l'image plein écran est très agréable à mettre au point pour la photo. Je n'ai fait aucun réglages et bien sûr l'image est brute ! Poils de Baie Argentée. Objectif 20 X. Le champ semble correspondre à la vision à l'oculaire. Vous trouverez la photo grandeur nature dans la Galerie du Forum (En période de test !!!) Dans la Galerie, n'oubliez pas de cliquer sur la photo 2 X pour la voir en entier. Le bord du champ est très irrégulier, ce qui est tout à fait normal à cause du montage mécanique qui a besoin d'un réglage. Mais surtout il est très étonnant quand on regarde la photo de voir que le bord chevauche par endroits l'image sans l'occulter.... ---- Merci Olivier, pour toutes ces informations. Je vois que tu es satisfait de ce produit, Je viens de regarder tes dernières photos, en effet l'image a l'air très fine. Je ne savais pas que les photosites (PS ) étaient de 3.16 µ et cela me réjouit. As-tu des informations sur le capteur ? En microscopie, c'est surtout la finesse des PS qui est importante. Quant à la sensibilité des petits PS tant de fois décriée surtout par les astronomes, n'a pas beaucoup d'importance pour nous. En astro, on ne peut jamais augmenter la lumière des étoiles qui est ce qu'elle est (a moins de prendre un télescope plus grand) par contre en micro, on peut toujours éclairer davantage le sujet, la lumière ne vient pas du sujet lui-même mais de l'éclairage. Bien sûr certains modulateurs absorbent beaucoup plus de lumière que d'autres, et dans ce cas la camera peut se trouver en difficultés. Dans ton cas 20 W c'est pas mal, mais on peut éclairer bien plus avec un microscope. Comme ta camera est vendue par Bresser, le logiciel de pilotage fourni est certainement différent du mien. Pour ma part j'ai abandonné ArcSoft Webcam Companion (en plus maintenant je ne peux même plus le lancer, il plante) Et j'utilise Scope Photo fourni avec les DCM et ça marche beaucoup mieux. Par contre le pilote fourni est ce qu'il y a de plus rustique. Le pilote est OmniVision SuperCam de OVT Voila l'interface: Pour le moment je n'arrive plus à le faire fonctionner, il refuse de démarrer (erreur 10) Peut-être le tien est-il meilleur ? Quel soft de capture utilises-tu ? (Le mien actuel ScopePhoto V3 ---- Cette camera à l’air très intéressante car elle correspond tout à fait à ce que tu recherches et que je recherche aussi, comme moyen de prise de vue. Malheureusement j’ai actuellement un petit souci informatique et je regrette de ne pas pouvoir aller au-delà pour l’expérimentation. Pour la présentation des images de test, il me parait également indispensable de donner l’image à l’échelle UN (Notion à laquelle je tiens beaucoup). C’est pour cela que j’ai donné l’image dans la galerie pour que l’on puisse la voir en 750 pixels de large, mais aussi en cliquant dessus (2X successivement) à l’échelle UN . L’image est BRUTE de traitement. Pour le champ, bien entendu il dépend du port du microscope pour ma part il s’agit d’un port cinéma (ou vidéo) et le champ me parait identique à celui vu à l’oculaire en 20 mm. ----- Bonne nouvelle, je viens après deux jours de « merdouillages » enfin de sortir de la malédiction du « Code 10 » En effet après ma première photo, j'ai laissé tomber ma caméra pour d'autres activités, mais ne voila t'il pas qu'en voulant la rallumer, je suis tombé sur le fameux Code 10. Désinstallation, réinstallation, changement de ports (j'en ai une dizaine) rien n'y a fait, toujours le même problème. Le problème venait du fait que bien que faisant tout pour installer le BON driver, Windows, de son côté allait chercher un autre driver. Le Bon driver est celui qui s'affiche sous le nom Jincheng MD 300 Electric Ecyepiece et non le Driver Omnivision SuperCam ! Merci à Jean Peynichou et à Mr Perrier de chez M42 Optics pour m'avoir aidé à régler ce problème. Je vais pouvoir continuer les tests ---- Voilà, entre deux labours, j’ai pu faire un essai un peu plus sérieux de la DM 300 Il s’agit, comme pour la Philips 1.3 Mo d’un frottis de sang au MGG conservé sous lamelle pour mes tests. Comme pour la Philips, j’ai utilisé un objectif Zeiss 10 X ON 0.25 infini. Bien entendu, il n’y a aucun traitement d’image et les réglages de la DM 300 sont ceux par défaut. Simple remarque, si je veux avoir une image pas trop claire, je dois dévolter la lampe du microscope au maximum. A l’oculaire, c’est très sombre. Autrement dit je trouve qu’elle a une sensibilité importante. Pour ceux qui connaissent l’hématologie, je trouve qu’avec un objectif de 10 X nous pouvons lire facilement la lame habituellement au labo nous utilisons un 40 X. Je n’ai pas pu avoir avec certitude le nom du capteur donc je ne peux pas donner ses caractéristiques. Le seul élément que l’on m’ait donné est que ce serait un OV9620 or ce capteur est un 1.3 MP . J’ai donc procédé à deux séries de photos, une en 2048 X 1536 et l’autre en 1280 X 1024 pour voir si on pouvait mettre en évidence une extrapolation de pixels. En fait en mode 1280 nous avons un champ d’image moins grand mais la même résolution qu’en 2048. Il faudra continuer dans cette voie pour comparer tous les modes de sortie. Ces tests ne font pas apparaître si le capteur est un 1.3MP ou un 3 MP. Pour la taille du PS (photo site) on m’a donné une valeur de 5.2 µ au carré. Ce que cela donne en images : A l’échelle UN : 2048 X 1536 1280 X 1024 Pour les images plein champ, voir dans la Galerie : N'oubliez pas d'utiliser le zoom! http://forum.MikrOscOpia.com/index.php?aut...eq=si&img=4 http://forum.MikrOscOpia.com/index.php?aut...eq=si&img=3 Note: Sur les photos de la galerie en Champ total, on remarque de grosses tâches claires qui font penser à des cratères. Il s’agit des traces d’huile à immersion collées sur la lamelle. Comme la profondeur de champ est relativement élevée avec cet objectif, elles apparaissent presque nettes. Bien entendu à plus fort grossissement ces taches nuisent comme les nombreuses poussières, à la qualité de l’image finale. Je trouve cette camera remarquable pour sa résolution et surtout son champ. D’autres tests suivront. Cordialement.
-

Demande d'identification
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour « Le Psammophile », Je voudrais d’abord préciser que je n’ai encore jamais observé de foraminifères. Sur ce plan là, je vous fais entièrement confiance. Ce qui m’a fait penser à des foraminifères est la présence de pores. C’est la seule information que je peux tirer du cliché , d’où mon hypothèse. Ces pores sont chez les foraminifères les lieux de passage des pseudopodes mais je suppose que d’autres matériaux d’origine marine comprennent également des pores. Il faudrait donc à mon avis se pencher sur la structure de ces pores. Savoir leur diamètre leur forme, mais aussi savoir où ils débouchent. Dans le cas des foraminifères, ils débouchent automatiquement dans des loges ou des logettes qui abritent à l’état vivant le cytoplasme. Il faudrait donc savoir ce qu’ il y a DANS ces objets, les voir en coupe. Un autre élément qui pourrait nous orienter est la nature de ces objets, leur composition chimique et leur structure. . Savoir s’il s’agit de calcaire ou de matériaux agglutinés liés par un ciment calcaire. J’ai le sentiment que seule la vue en coupe au microscope de ces éléments, pourra nous en dire plus que leur forme extérieure qui peut être remaniée par polissage naturel. Avez-vous suffisamment de ces objets pour espérer procéder à des coupes ? Cordialement. -

Demande de renseignements
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Laurent, Merci pour votre question. Pour les inscriptions, c’est possible. Pour cela, lire le message en tête du forum. Il s’suffit d’en faire la demande motivée. Pour les lames et lamelles plusieurs sociétés en vendent sur le Net. Pour les trouver, il suffit de taper « Lames et lamelles » dans un moteur de recherche comme Google. Voir par exemple ce lien il y en a beaucoup d’autres. http://www.materielmedical.fr/boutique/fic...ag=1&num=19 Pour le petit matériel, beaucoup d’outils ou de simples objets détournés de la vie courante peuvent faire l’affaire. Il n’y a pas beaucoup d’outils spécifiques à la microscopie, tout au moins pour débuter. A mon avis ce n’est pas la peine d’investir dans une trousse dédiée le plus souvent à la dissection. La question sur les réactifs est très intéressante ! 90 % des observations les plus courantes se font dans une simple goutte d’eau du robinet entre lame et lamelle. Par la suite on peut acheter au coup par coup quelques réactifs qu’il serait trop long de détailler ici mais que l’on trouve dans le Forum. Le premier conseil que je donnerais est d’abord d’acheter un petit livre d’initiation à la microscopie ou de lire les conseils que l’on peut trouver sur le site MicrOscOpieS.com y compris les liens pour trouver des livres. Bien sûr, je ne vous le cache pas, l’idéal serait de participer à notre forum. En tous cas bravo pour votre achat qui va vous ouvrir tout un univers insoupçonné. Bonnes observations. Cordialement. Michel. -

liquide immersion pour le sf10
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour à tous, Effectivement le SF10 est une référence de verre Schott. ( FD chez HOYA) indices 1.72825 (nd) et 1.73430 (ne). C'est un Flint Dense . Merci aux visiteurs de poser des questions en rapport avec le forum ou la microscopie mais aussi d’être plus complets dans leur formulation. Cordialement. -

liquide immersion pour le sf10
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Ludo, Merci d’avoir posé votre question dans MikrOscOpia. Je suis sûr que même si le produit miracle que vous cherchez n’existe pas, vous aurez au moins eu un certain nombre de réponses ou de pistes. Toutefois, pour augmenter les chances de réponses, il serait utile que vous apportiez un peu plus d’éléments pour nous mettre sur la bonne piste. Je suppose que le sf10 est un milieu de montage (pour diatomées ?) et le liquide que vous recherchez est un liquide d’immersion pour un objectif que je suppose très résolvant. Mais comme le diiodomethane est utilisé en joaillerie, peut-être que je me trompe ? Cordialement. Michel -

Microscope pour mycologie
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Patrice, Je vous remercie pour votre bon conseil, mais le but de notre forum, le seul consacré exclusivement à la microscopie, n’est pas d’envoyer nos lecteurs sur un site mycologique, aussi prestigieux soit-il, pour y apprendre le fonctionnement du microscope. Nous savons très bien le faire et justement ce forum Ouvert à tous, est là pour çà. Pour vous initier au microscope et à la microscopie, je vous recommande bien entendu le site MicrOscOpieS.com qui comprend les bases du microscope et de la microscopie, un µMagazine et bien d’autres services. Tout ce que vous ne trouvez pas dans ce site, vous pouvez le demander en vous inscrivant au Forum MikrOscOpia, En ce qui concerne eBay, je ne le conseillerai pas à un non initié. A votre service. -

Microscope pour mycologie
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Jean-Marie et tous, Après avoir entré le code postal de la ville sur le site Lidl, le navigateur me renvoie un Not Found systématiquement. C'est pour cela que j'avais mis la photo du microscope trouvée sur un autre site. Je suppose que je ne suis pas le seul dans ce cas. Je vais chercher une autre adresse pour ce microscope LCD dont le principe est tout à fait intéressant même s'il ne faut pas s'attendre à des miracles de résolution. Amitiés. -

Microscope pour mycologie
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Re bonsoir, Fougère, Pour des spores de champignons, les mycologues du forum le confirmeront, je pense qu’il faut utiliser un objectif 100 X à immersion à l’huile. Ce n’est pas tellement un problème de grossissement, mais surtout un problème de résolution (finesse) de l’objectif. Si c’est uniquement la qualité de l’image qui compte pour la détermination, on peut se contenter, pour un investissement minial, d’un bon microscope monoculaire (Type PCB : ancienne dénomination) à potence inclinable avec bien entendu un condenseur une surplatine (mouvements mécaniques en X et Y de la préparation) et vis micrométrique pour la mise au point. Les objectifs doivent être standard (Au pas RMS ) et interchangeables. A partir de là, il y a plusieurs « qualités » d’objectifs dont il faut tenir compte en fonction de l’usage (visuel ou photographie) .Ceci est le microscope minimum mais de très bonne qualité. Sa qualité dépend avant tout de son objectif. Pour le confort de l’observateur il existe des microscopes plus compliqués mais plus chers binoculaires ou trinoculaires. Comme l’examen des spores de champignons demandent un minimum de préparation du sujet, il faut prévoir avec le microscope des produits chimiques, (réactifs et colorants) mais aussi du petit matériel pas très onéreux. Mais surtout, chose à ne surtout pas négliger, c’est que pour faire de la microscopie il faut prévoir un minimum de place et surtout du temps. En principe on trouve de bons microscopes pas très chers dans les magazins d'Astronomie Je vous recommanderais avant tout de consulter le site de notre ami et collaborateur Marcel Lecomte Champignons Passion. Cordialement. -

Microscope pour mycologie
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Fougère, Malheureusement le site Lidl n’est pas accessible et il m’est impossible de connaître le modèle du microscope proposé. Par contre j’ai trouvé ceci sur le web. Microscope biolux al Oculaire pour connexion PC. Oculaire 5x WF et 16x WF. Lentille Barlow, rallonge oculaire. Tourelle d’objectif 4x, 10x, 40x. Eclairage LED. Logiciel Arc Soft Photoimpression. Nous avons testé un de ces appareils, et les avis sont partagés. Pour ma part je pense que ce n’est pas un jouet comme on en trouve tant, mais ce n’est pas non plus un microscope d’entrée de gamme pour faire de la microscopie. Juste entre les deux, il peut convenir pour faire une première approche de la microscopie, mais tout en sachant que l’on obtient de bien meilleurs résultats en payant un peu plus cher. Pour des études de champignons sérieuses c’est à mon avis insuffisant. D’autant plus qu’il ne faut pas compter sur les grossissements annoncés 1280 X c’est totalement erroné ! Tout au plus on peut espérer un grossissement correct jusqu’à 400 fois. En fait 200 fois (40 X 5) Car un oculaire de 15 fois avec un objectif de 40 X ( de cette qualité) qui donnerait un grossissement de 600 fois n’est pas raisonnable et encore moins avec ce qu’ils appellent une Barlow. D’un autre côté la camera fournie avec est de qualité inférieure à une WebCam correcte qui coûte déjà 50 € chez Philips. Il faut quand même considérer le rapport qualité prix. Même si ce microscope ne permet pas de faire de la microscopie d’un bon niveau, vu le prix et si l’on ne force pas sur le grossissement, il demeure quand même un bonne affaire pour une initiation au monde microscopique. Mais le jour où vous serez atteint par ce virus, il vous faudra certainement investir davantage. Cordialement. -

Demande d'identification
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Cher Visiteur, Nous allons ouvrir une rubrique consacrée au sable considéré du point de vue de son étude microscopique. Sable roche, sable contenant des restes de la vie animale actuelle, sable fossilifère, mais aussi sable biotope. Tous ces aspects seront envisagés. Vous pourrez donc nous y rejoindre pour y participer. Cordialement. mPx PS: J'ai l'impression que l'on peut apercevoir de tous petits trous sur pratiquement toute la surface de ces éléments. Ne pourrait-il pas s’agir de foraminifères ? -

Utiliser un microscope pour lires des microfiches.
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour à tous, Daniel, En fait tu as raison pour la deuxième partie de tes hypothèses. Ce n’est pas un problème de couvercle mais un problème de reconnaissance de caches. En effet pour aller plus vite, j’avais enlevé le cache pour les diapos et posé la fiche directement sur la vitre. Il fallait mettre le cache pour microfiches. Le scanner faisant la différence entre les caches et se configure en fonction d’eux. C’est beau le progrès. Comme les clichés sont en niveaux de gris, le scann est beaucoup plus rapide qu’en couleurs. Voilà donc en images. Une partie de la microfiche. Je n’ai pas trop poussé le grossissement, les données étant confidentielles. Un extrait à l’échelle 1 Cordialement. -

Utiliser un microscope pour lires des microfiches.
Tryphon M a répondu à un sujet dans QUESTIONS POSEES PAR LES VISITEURS A MIKOSCOPIA
Bonjour Jean-Marie et tous, Oui comme je l'ai dit il scanne les diapos, négatifs et tutti quanti mais pour les microfiches, rien ne sort ! Peut être un problème de réflexion ? Donc il vaut mieux, avant de recommander un scanner, le tester avant, c’est ce que j’ai essayé de faire sans succès. Cordialement.