-
Compteur de contenus
8 287 -
Inscription
Messages posté(e)s par Tryphon T
-
-
Bonjour Patrick,
Je ne met pas en cause tes efforts et ta persévérance, au contraire, je suis admiratif pour ta patience !
Ce qui me gêne, c'est ton protocole !
Donc voici ce que j'ai fait ce soir :
- AFA 8 min
- Rinçage
- Dakin 8min
- Rinçage
- Eau acétique 5% 2 min
- Safranine diluée 1/40 gouttes 3 min
- Rinçage
- Bleu Astra dilué 1/10 gouttes 30 sec
- Rinçage
Montage glycérine
Dans les coupes végétales, ce qui compte, ce sont les membranes et non le contenu cellulaire qui est un handicap.
On élimine donc le contenu cellulaire (Javel : le Dakin, c'est du javel) et éventuellement après rinçage on fixe, mais à mon avis cela ne sert à rien de fixer.
L'AFA , c'est un fixateur !
Donc commencer à fixer le contenu cellulaire 8mn avant de vouloir l'éliminer au javel , n'est pas du tout logique.
***
Amicalement.
-
Me voilà donc revenu,
La microscopie couvre un large champ de disciplines.
Si l'on recherche des "colorants pour microscopie" on trouvera des choses bien différentes car elles s'appliquent à des domaines différents.
Exemple: je ne vais pas utiliser le May-Grunwald-Giemsa pour colorer des pelures d'oignons.
C'est totalement illogique , et coûteux.
Cependant, si par curiosité, vous voulez essayer, c'est une démarche compréhensible, qui peut faire partie de l'esprit de curiosité.
Par contre si vous voulez débuter dans les colorations ; COMMENCEZ PAR LE DEBUT, c'est à dire entrainez vous sur des techniques classiques certifiées, pas sur des "bricolages" trouvés n'importe où.
Quoi qu'il en soit, les techniques de colorations sont si nombreuses que la methode empirique n'est pas une bonne école.
Aucune recette, aucun protocole, aucun algorithme de dispense de réfléchir!
Qu'est ce qu'il faut dire au sujet de la fixation?
Et d'abord, il faut se poser la question : pourquoi fixer?
La chair animale est composée de cellules animales qui , à la milli seconde où elles ont perdues leur vie, commencent à se décomposer sous l'action des milliers d'enzymes qu'elles comportent.
Si on veut examiner au microscope des cellules animales, il faut le plus rapidement possible (maximum quelques secondes) les plonger dans un fixateur adéquat.
Parallèlement à la lyse enzymatique, la prolifération bactérienne dégrade totalement la cellule.
Les végétaux ne sont pas soumis à ce type de phénomène de décomposition, car la rigidité de la plante est due à leur paroi cellulosique rigide et à leur organisation en "nid d'abeille".
D'autre part, l'étude microscopique des végétaux est orientée vers la mise en évidence des différentes structures de ces membranes organisée en tissus et de composition différentes.
On parle de xylème, ou de phloème par exemple.
Les colorations de parties de végétaux est donc orientée sur la détermination de structures membranaires et dans ce cas, le contenu cellulaire intramembranaire, n'est pas utile et même gênant.
Si dans le cas d'histologie animale, il est urgent de fixer, dans le cas de l'histologie végétale, il faut en premier vider le contenu cellulaire et ne conserver que les membranes! (Javel)
Alors se pose la question de fixer ensuite ou pas les membranes.
Voir ce lien : https://www.microscopies.com/DOSSIERS/Magazine/Articles/MLecomte-Fixation/Mlecomte-Fixations.htm
Amicalement.
-
Bonjour Patrick, tous,
Ah, j'ai trouvé pour la fixation :
Non !
Excuses moi, d'être aussi agressif dans ma réponse, mais ceci est faux.
Tu te poses une fausse question , ou plutôt tu choisis dans l un QCM inadapté à ton problème, la mauvaise réponse.
Pour comprendre, il faut que je m'expliques et cela peut être assez dense.
Donc, à tout de suite. (J'ai quelques trucs à faire.)
Amicalement.
-
Bonjour les coloristes, :)
Si je peux me permettre? Le Carmin aluné, comme tous les colorants alunés, veut dire qu'il contient de l' alun !
Donc quel intérêt de préparer de l'eau alunée pour ensuite faire une coloration au carmin aluné, même si l'alun semble avoir perdu de l'efficacité, ce qui reste à prouver.
Alors, je mettrais l'alun directement dans le carmin en espérant que ce n'est pas le carmin lui même qui est périmé.
Amicalement.
-
La réponse ici :
-
Bonjour,
Je voudrais préciser mon point de vue sur les colorations en microscopie.
La coloration est une des bases de la microscopie qualitative.
C'est même la discipline la plus volumineuse.
De très nombreuses recherches, ouvrages, manuels ont été publiés depuis le début du XX ème siècle.
C'est le rayon le plus fourni de nos bibliothèques.
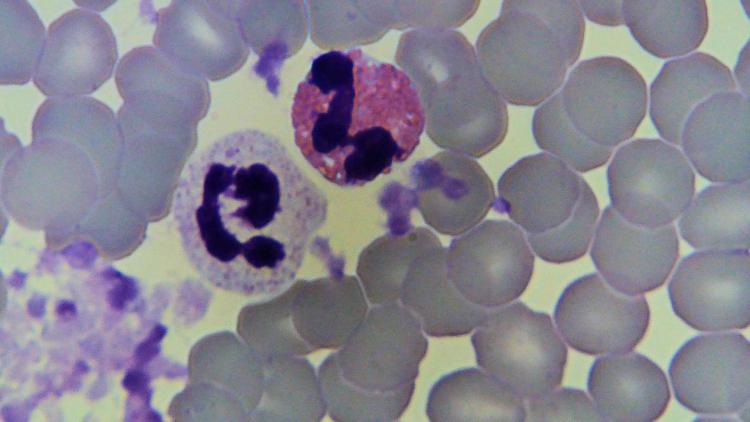
Je donnerais un exemple parlant .Cliquez sur la vignette pour voir la photo à l'échelle UN (G = 10 000 X).
Il s'agit d'une très petite portion d'un frottis sanguin coloré au 555 dans le but d'établir une FS ( Formule Sanguine).
Une FS est le pourcentage des éléments figurés du sang.
Ici nous voyons, bien entendu les GR en gris (Globules rouges) un amas de plaquettes, des plaquettes isolées un PN neutro (Polynucléaire neutrophile; la grosse cellule de gauche) et un PN éosino (Polynucléaire éosinophile à droite)
Cette photo est ciblée sur un éosino, il manque bien entendu d'autres éléments importants du sang!Le grand intérêt de cette analyse est de déterminer les proportions des différentes cellules du sang afin de diagnostiquer une pathologie sanguine ou de confirmer un état de santé.
L'avantage de la coloration est de différencier les populations de cellules grâce à leur morphologie et aussi à leur affinité tinctoriale.
Dans cet exemple parlant, l'accent est mis sur l'affinité des Eosinophiles pour l' éosine ! Leurs granulations les plus nombreuses se colorent en rouge.Alors quoi de plus facile pour le chercheur (ou la laborantine d'autrefois) de compter sur 200 cellules, le pourcentage des unes et des autres.
L'avantage est évident , cela accroit la sélectivité et la reproductivité de l'analyse, sa fiabilité, et sa vitesse d'exécution. (1)Maintenant je peux affirmer qu'il est tout à fait possible de reconnaitre ces différents éléments figurés du sang sans coloration.
C'est un excellent exercice, mais qui ferait partie d'une sorte de quête de l'inutile, car épuisante par rapport à la lecture d'un frottis coloré.Amicalement.
(1) Ces formules sanguines, ne sont plus utilisées que pour la recherche ou la confirmation d'une analyse automatique par robots qui semblerait sortir des clous.
On utilise actuellement en routine la photométrie de flux bien plus rapide et complète.
Je peux vous en parler à la demande.
. -
Bonjour Patrick,
C'est Lapalisse qui peut répondre à cette question.
Un filet à plancton agit comme tous les filtres, toutes les passoires au monde.
Il retiendra les objets qui sont plus gros que la maille et laissera passer tous les objets plus petits que la maille.
Tout dépend donc de ce que tu veux retenir dans ton filet.
Amicalement.
-
Bonjour,
On ne peut pas parler de la pelure d'oignon sans parler de l'article mythique de Walter Dioni
https://www.mik-mag.fr/2003/10/hommage-a-une-pelure-doignon-larticle-6/
N'oubliez pas la galerie et le supplément !
Bonnes manips.
-
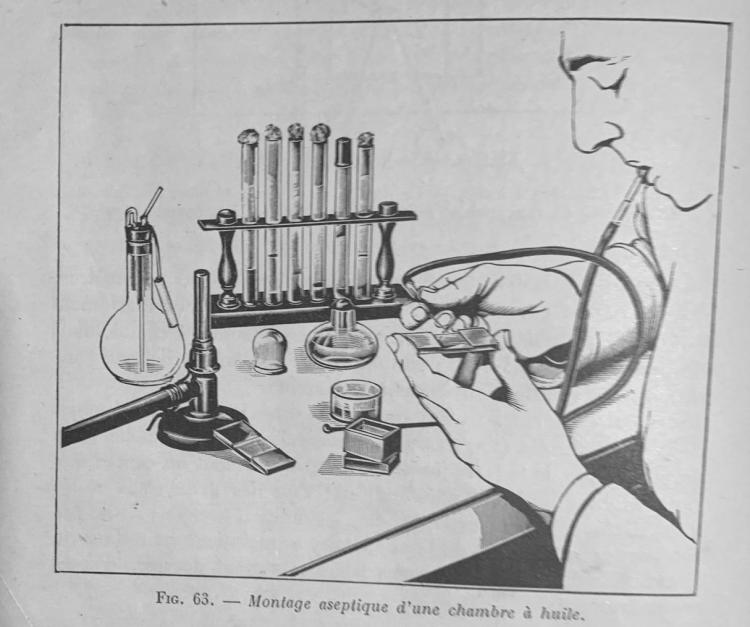
C'est là tout le problème du pipetage.
dès qu'on met une pipette à la bouche, il faut penser ASEPSIE = danger = microbes.
Ici, on ne voit pas très bien, mais la pipette Pasteur est stérile et munie d'un filtre et reliée à la bouche avec un long tuyau + un embout lui aussi avec filtre.
Extrait de Techniques de Micromanipulation (Pierre de Fonbrune.
Les quantités manipulées sont très faibles et ne risquent pas de remonter très haut dans le tuyau, mais imaginez que vous manipuliez du VIH !
Ici, on voit la faille !
Ce sont les doigts !!! Ils peuvent toucher un objet contaminé, puis attraper l'embout buccal pour le mettre à la bouche !!!
Et Hop c'est foutu.
-
C'est une excellente question !
Quand on travaille avec des pipettes Pasteur, plutôt qu'avec des pipettes en plastique du super marché, on se place dans un certain état d'esprit (disons pastorien) .
On travaille avec du matériel stérile et on fait attention à l'asepsie. C'est déjà un bon exercice mental et expérimental.
On fait attention à ne pas contaminer le milieu et attention à ne pas se contaminer.
Cela oblige à réfléchir à ce qu'on fait.
Ce n'est pas indispensable en microscopie amateur de base, mais dans ce cas, on risque, par mauvaise habitude à faire rapidement n'importe quoi car on oublie les dangers potentiels.
Amicalement.
Ce modèle quoique un peu cher, conviendrait parfaitement.
-
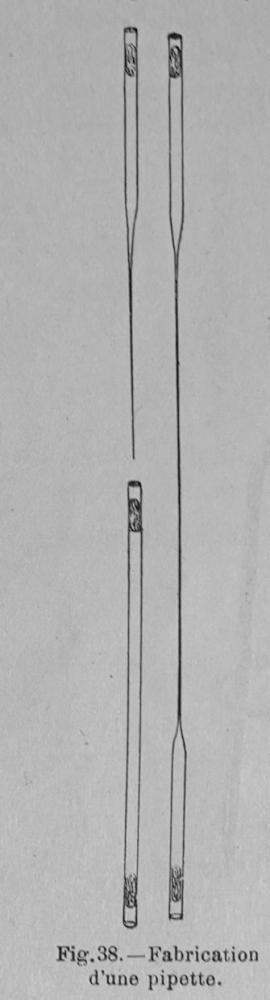
Bonjour,
Les pipettes Pasteur sont des instruments indispensables pour la manipulation de toutes petites quantités de liquides .
C'est un classique en microscopie car il est tès aisé d'en fabriquer à la demande et de la taille désirée.
Le plus difficile en ces temps modernes, de se procurer les cannes (tubes) de verre à étirer!
Prendre de la canne de 5 mm de diamètre et couper des morceaux de 30 cm environ avec une scie à ampoules ou une petite lime.
(Autrefois dans toutes les boites de médicaments sous forme d'ampoules, devenues de plus en plus rares car les ampoules sont pré sciées)
Mettre du coton à chaque extrémité des tubes et autoclaver (à défaut avec une cocotte minute)
Vous avez alors un stock de base de pipettes.
Au moment de s'en servir, il ne reste plus qu'à étirer à la flamme en chauffant en son milieu la canne.
(Attention, plus le tube devient fin et plus il faut s'éloigner de la flamme).
Vous obtenez deux pipettes du diamètre désiré.
Il y a même moyen de fabriquer des micropipettes pour la micromanipulation.
Amicalement.
-
Bonjour Zacharie,
Une pipette Pasteur est un outil de base en bactériologie et donc en microscopie.
Je fais un sujet sur leur fabrication.
Amicalement.
-
Bonjour,
Bien évidemment, je me suis empressé d'acheter " UN Manuel de microscopie Microscopioo" cité ici https://forum.MikrOscOpia.com/topic/19465-où-trouver-les-principaux-colorants-pour-microscopie/?p=80724
Ne faites pas comme moi, vous en serez pour votre argent !
Cela m'arrache le coeur de le dire car la "dame" a l'air sympathique et c'est pour la bonne cause, mais tout cela est trop décevant.
Quasiment aucune figure à part cela :
La conclusion
La table des matières:
Amicalement.
-
Bonjour Dominique,
Ce que tu dis n'est pas faux, mais dans le Langeron qui date c'est vrai, il y a toutes les techniques de bases de la microscopie et c'est un véritable catalogue de ce qui est observable.
Le Locquin, plus récent est lui aussi un véritable livre de chevet pour ne pas dire une Bible pour le microscopiste.
Ce qui fait l'intérêt de ces ouvrages, si on veut colorer, c'est que toutes les colorations de bases y sont décrites et les formules sont données.
Toutes les colorations de base, en anapath, en bactériologie ou en hématologie et pas que, sont restées les mêmes depuis cet âge d'or de la microscopie et si on ne trouve plus de produits chimiques en vente libre (de nos jours, tout est contrôlé voire interdit ) ce sont les mêmes formules qui sont vendues toutes faites par les laboratoires spécialisés pour d'autres laboratoires spécialisés.
L'amateur n'a plus droit au chapitre, si ce n'est juste pour le superficiel et l'inutile.
On trouvera certaines de ces formules dans le Site Microscopies.com et chez Marcel Leconte.
Dommage que tout cela se perde !
Heureusement, il reste encore quelques acharnés, mais il se dessine une société ou même les curieux n'auront plus droit à s'informer sérieusement et produire de la recherche par eux-mêmes.
Amicalement.
-
il y a peut-être une rubrique livres sur le forum.
Oui, tout à fait !
Il faut aller dans Mik-Mag MikrOscOpia-Magazine (Mik-Mag) En haut de page du forum à gauche
Ensuite dans le site MicrOscOpies.com Idem en tête de page de MIK-Mag (Voir le site)
Ensuite dans Documentation
Je n'ai pas mis les liens directs pour avoir la surprise de la découverte.
-
Bonjour Patrick,
Il n'existe pas une liste de colorants ou bien un kit qui recouvrerait toutes les activités, ou même les activités de base du microscopiste, cela dépend comme le dit Jean-Luc de tes préférences.
La seule chose que l'on puisse recommander pour un débutant qui n'a pas d'idée précise de ce qu'il veut faire, c'est de commencer par le plus classiques.
Sachant qu'il faut d'abord FIXER (!) avant de colorer, il faut se renseigner sur les processus de fixation et les fixateurs. (voir dans le forum)
Ensuite comme il existe deux réactions chimiques principales de coloration, basophilie et acidophilie, il faut avant tout se procurer un colorant acide et un colorant basique soit le couple EOSINE/ BLEU DE METYLENE . Avec l' ALCOOL pour la fixation, on peut commencer.
Amicalement.
-
Bonjour Patrick,
D'abord redisons que l'on peut se passer de colorants, mais aussi, qu'il est tout à fait légitime d'en utiliser.
De nombreux colorants pour microscopie se trouvent chez les fournisseurs pour laboratoires de bactériologie, hématologie, mais malheureusement réservés aux professionnels.
Une astuce est de demander à un vétérinaire. On peut commander directement sur internet et ensuite il faut aller chercher le produit chez le vétérinaire (clinique particulièrement)
On aussi peut se rapprocher de clubs de mycologie.
Ensuite on peut aller chercher dans la liste des colorants alimentaires, les E-quelque chose, il y a pas mal de choix.
La dernière solution, encore plus écolo, c'est de s'en fabriquer . Il y a pas mal de plantes "colorantes" mais souvent les couleurs sont un peu pâlottes, il faut rajouter des "mordants" mais c'est déjà de la chimie.
Si on se lance dans les colorations, il faut à tout prix se procurer le Manuel de Microscopie de Marcel Locquin chez Masson (d'occasion)
Amicalement.
-
Bonjour JM, tous,
Aspirer le sang d'un malade à la pipette à la bouche est bien plus rapide qu'avec une pipette munie d'une poire en caoutchouc avec une vis de réglage , la précision étant la même.
Mais pour une fois la sécurité passe avant la rentabilité et tout le monde est d'accord.
En microscopie, si on oppose la précision de la pipette à bouche à celle d'une pipette en plastique munie d'une poire, c'est certainement une question de choix et d'adresse, mais dans le premier cas, le danger est toujours le même.
Une bactérie, ce n'est pas gros, et un virus, encore plus petit. Il peut y avoir un milliard de virus dans une pipetée et on ne peut pas jouer avec le hasard en croyant qu'on est chanceux, qu'il ne peut rien nous arriver.
C'est interdit et non négociable.
Maintenant pinaillons un peu.
Est ce qu'un long tuyau peut nous isoler bactériologiquement ? Non.
A moins que la pipette soit à usage unique, ou correctement stérilisée à chaque fois, le liquide peut déposer des bactéries et virus sur les parois et aspirés dans la bouche lors d'un pipetage ultérieur. Je répète qu'une bactérie ou un virus, c'est vraiment petit.
Pour comprendre ce qui se passe dans un long tuyau, il faut s'en référer aux expériences de Pasteur concernant les ballons à col de cygne.
Dans un premier temps, si on casse l'extrémité du col de cygne, l'air qui pénètre dans le ballon ne contamine pas le bouillon de culture.
C'est normal, les spores et bactéries se déposent sur les parois du col.
Mais si on met le bouillon de culture en contact avec l'intérieur du col, le bouillon se trouble, preuve qu'il y a des germes.
Je sais par expérience que la pipette à bouche a des avantages dans la capture de Ciliés, alors, si on y tient vraiment, il faut être plus intelligent que les microbes que l'on veut éviter.
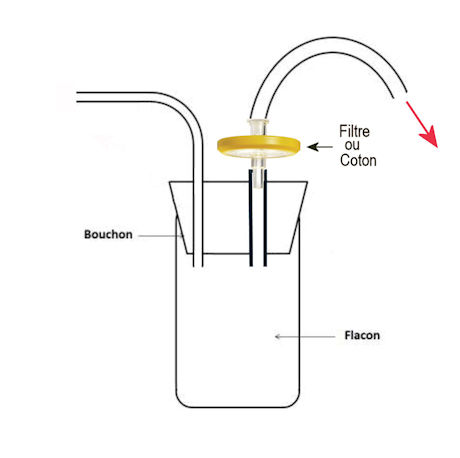
Le minimum vital est la pipette Pasteur reliée à un tube en caoutchouc .(1)
La manière la plus sûre est de fabriquer une pipette à bouche sécurisée sur le modèle des aspirateurs à insectes, mais avec en sortie, soit un filtre Pasteur soit une capsule Millipore.
Amicalement.
(1) C'est une canne de verre fermée par du coton aux extrémités, stérilisée puis étirée à la dimension voulue.
En le cassant par le milieu on obtient deux pipettes Pasteur.
-
Suivez ce lien vous aurez l'embarras du choix!
-
Bonjour,
A l'âge d'or de la microbiologie, on apprenait ceci :
Extrait du Précis de microbiologie clinique par Fernand Brezançon Masson et Cie 1920 894 pages.
Les pipettes étaient stérilisées et contenait un filtre en coton hydrophile , mais les microbes manipulés étaient d'une très grande dangerosité.
A priori, quand on manipule des micro-organismes prélevés dans la nature, pour les observer au microscope, sans tomber dans la paranoïa, il vaut mieux ne pas mettre les objets manipulés à la bouche.
En chimie, on pipetait aussi directement à la bouche. En mettant le pouce à l'extrémité de la pipette, on pouvait transvaser des produits chimiques .
Bien évidemment ces techniques ont été interdites et il existe des pipettes avec poires intégrées ainsi que des dispositifs automatiques de prélèvement.
Amicalement.
-
Bonjour,
La poussière sur les lentilles du microscope ou sur le capteur, c'est comme la poussière ou la crasse sur les lunettes, c'est une affaire personnelle chacun fait comme il veut.
En microscopie, cela ne coute rien de l'enlever, mais beaucoup ne le font pas, faute de savoir le faire, alors on invente des prétexte.
Cela n'a rien à voir avec l'effacement systématique sous logiciel, de tout ce qui n'est pas l'objet observé .
Pour ce qui est de l'utilisation des pipettes à bouche, je suis totalement opposé à leur usage.
C'est une pratique totalement interdite dans tous les laboratoires et établissements d'enseignement !
Je sais dont je parle par expérience.
Jeune étudiant, il était coutume de "monter des VS" en aspirant avec la bouche.
J'étais assez fier de ma maitrise de l'opération, jusqu'au jour, où le sang ayant coagulé, je dus aspirer plus fort que d'habitude et ce qui devait arriver, arriva, l'obstacle levé par la force d'aspiration, le caillot et tout le contenu du tube à hémolyse se retrouva dans ma bouche!
Il s'est avéré par la suite que le patient avait un BW positif. Heureusement, je n'ai pas été contaminé.
Si vous voulez faire pareil avec une eau au contenu inconnu, vous vos exposez connement à des tas d'ennuis.
Amicalement.
-
Nauplius
dans - Crustacés
Je suis étonné de la notion anglaise de '"egg-nauplius" !
J'ai suffisamment élevé d'artémia pour avoir vu des centaines de nauplies sortir de leur œuf .
Comme toute reproduction par œuf, la poule en est un bon exemple, le poussin (la nauplie dans notre exemple) sort sous forme de poussin bien constitué au moment où il brise la coquille.
Cela veut dire que juste avant la naissance, le poussin était complètement formé.
il ne viendrait à l'idée de personne, de ce côté de la manche, d'appeler un poussin , même jeune, œuf-poussin.
Je suppose que quand les Anglais parlent de '"egg-nauplius" ils parlent de l'embryon presque formé quand il est encore dans l'œuf?
Ici, nous avons une nauplie qui nage, ce n'est pas un œuf.
Amicalement.
Une recherche sur Google confirme cette hypothèse:
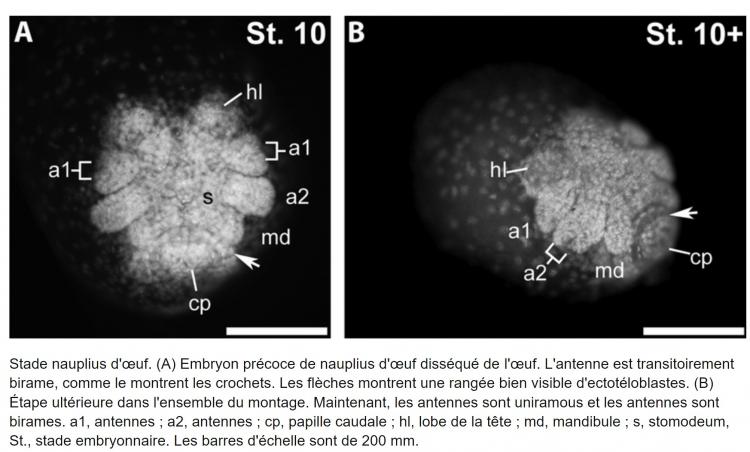
Texte original en anglais ;
Egg nauplius stage. (A) Early egg nauplius embryo dissected from the egg. The antennula is transiently biramous, as shown by the brackets. The arrows show one conspicuous row of ectoteloblasts. ( B) Later stage in whole mount. Now the antennulae are uniramous, and the antennae are biramous. a1, antennulae; a2, antennae; cp, caudal papilla; hl, head lobe; md, mandible; s, stomodeum, St., embryo stage. Scale bars are 200 mm.
-
Nauplius
dans - Crustacés
Bonjour,
Je crois qu'il y a une confusion.
Un Nauplius n'est pas une espèce animale !!!
Le nauplius ou Nauplie, est un stade (le premier) dans développement des crustacés .
Un œuf de Nauplius, ça n'existe pas.
Le nauplius ne pond pas d'œuf, mais est issu d'un œuf de crustacé.
On parle du stade nauplius, parce que le développement des larves de crustacés passent par ce stade.
A ce stade, les nauplies de nombreux crustacés se ressemblent conformément à la théorie de la récapitulation de Haeckel "l'ontogenèse retrace la phylogénie" complétée par la loi de von Baer.
Par exemple, en aquariophilie, on utilise les nauplies d'Artémia salina (les fameux Pifises !) pour nourrir les jeunes alevins.
https://www.aquaportail.com/definition-14389-nauplie-d-artemia.html
Amicalement.
-
Bonjour,
C'est sur le protocole que je peux aider.
Pour les interprétations, c'est du domaine de l'opinion.
Pour que ce genre d'expérience soit reproductible, il faut un certain nombre de précautions de base.
En premier je pense au volume de la goutte, il faut qu'il soit le plus identique possible d'une goutte à l'autre.
Les compte-gouttes fantaisistes qu'on voit sur la photo ne sont pas recommandables.
Il existe des normes pharmacopée qui définissent un compte goutte, il doit fournir 1/20 de gramme d'eau pure et pour cela il doit avoir un diamètre de trou donné et un diamètre de verre donné et surtout tenu à la verticale. (sans trembler)
Pour faire plus simple, je recommande des pipettes automatiques avec embouts calibrés.
En ce qui concerne le verre qui va recevoir la goutte, il doit être neutre et surtout lavé de manière rigoureuse en évitant les détergents qui se déposent en couche moléculaire. A ce niveau d'expérimentation, si on veut être sérieux, il faut bien connaitre le nettoyage moléculaire (comme on le pratique en microscopie électronique)
Après, au niveau du froid, à mon avis, cela n'a pas beaucoup d'importance.
Amicalement.







Technique de préparation Dakin versus eau de javel
dans Dominique
Posté(e)
Bonjour Dominique,
Tes expériences sont concluantes.
Ce qu'il faut retenir dans l'histoire, c'est que c'est le chlore (l'ion Ch- ) qui oxyde la matière vivante en cassant les liaisons dans les protéines.
Que ce soit du Dakin ou une autre solution de Chlore ce qui compte dans notre histoire, c'est la concentration en chlore.
Elle s'exprime en ppm (partie par million) 1 ppm = 1mg/L
5 000 ppm pour le Dakin 26 000 ppm pour l'eau de Javel
Dakin :
Concentration 0.5%
ppm 5 000
Eau de Javel :
Concentration 2.6%
ppm 26 000
L'eau de Javel est donc 5.2 fois plus concentrée que le Dakin. (2.6/0.5)
Donc:
260 000 ppm pendant 1 mn = 5 000 ppm pendant 5.2 mn
Il faut laisser 5.2 fois plus longtemps la coupe dans le Dakin que dans l'eau de Javel.
S'il faut 20 mn avec du Javel, il faudra 1h 44 mn avec du Dakin.
Attention, le chlore s'évapore et donc les solutions perdent de l'efficacité avec le temps. (18 mois pour la Javel)
Pour que les durées des bains soient comparables, il faut évacuer les résidus cellulaires plus souvent quand la concentration est plus élevée.
Si il y a beaucoup de résidus, le chlore n'agit plus.
Je recommande donc de changer le bain éclaircissant plusieurs fois pendant le traitement de la coupe.(ou bien sûr mettre une grande quantité de javel en agitant la solution (et la coupe) fréquemment)
Amicalement.