-
Compteur de contenus
8 287 -
Inscription
Messages posté(e)s par Tryphon T
-
-
Ce message, comme les autres messages de ce membre, tous en anglais, ne sont pas vraiment dans l'esprit du forum.
Je ne vois pas qui ici, peut récupérer autant de produits toxiques , certains interdits.
Merci d'arrêter.
Le sujet est fermé.
-
Eh bien, j'ai encore au moins un tambour de 25 litres de xylène (Baker, pour l'histologie) et au moins 6 fûts de 25 litres de cellosolve (2-étoxy-éthanol, Baker, pour l'histologie).
L'enlèvement par une entreprise accréditée d'enlèvement de produits chimiques coûtera plus de 1 000 euros, j'ai donc ce lot (et quelques autres) disponible gratuitement, pour quiconque est en mesure de le retirer avant la mi-février 2020.
-
Bonjour Jocelyn,
La photographie est un bon moyen de conserver trace de nos observations, mais la photographie n'est pas l'aussi fidèle reflet de la réalité que l'on croit , surtout après manipulations.
La dimension éthique de la photographie n'est pas toujours garantie.
Il est donc important, si le sujet n'est pas banal de vouloir le conserver.
Les préparations définitives ne sont pas toutes compliquées, il y en a de fort simples.
C'est même un des piliers de la microscopie et une justification du forum.
Amicalement.
-
Bonjour,
Excellent travail !
on imagine la difficulté de réalisation des coupes !
Le foie se coupe très bien.
Amicalement.
-
Bonjour,
Je viens de faire le tour dans nos sujets sans le retrouver
Oui jean-Luc, le sujet a été déjà traité , voici un résultat de recherche avec carboxyméthylcellulose
http://forum.MikrOscOpia.com/index.php?app=core&module=search&do=search&fromMainBar=1
Le gel pour ultrasons, n'est pas adapté à la microscopie, sa composition est trop diverse selon les marques et contient de nombreux agents dont je doute qu'ils soient appréciés par nos chers protistes.
Déjà à l'odeur et aux résidus, on peut en douter
Voici une composition :
Eau, triethanolamine, carboner, glycole propylène, methychloroisothiazoline, methylisoth iazoline, essence de parfum d'alcool, C142090
Et un autre :
Polymère, substance humidifiante et eau d'osmose inverse. Conservateur: Parahydroxybenzoates propylique et méthylique en concentration bactériostatique.
On peut toujours essayer !
Amicalement.
-
Bonjour et encore bravo !
Éternel râleur, je ne peux m’empêcher d'apporter mon grain de sel ( Mille pardon !)
En fait la plume utilise le système du Velcro
A mon avis, la Marque déposée Velcro, ne fait que reprendre ce qui existe dans la nature depuis pas mal de temps ( principe d'antériorité :) ).
A l'époque, javais beaucoup été gêné par la poudre de plume.
Ici , je n'en vois pas beaucoup, quelle espèce as-tu étudiée ?
Bonnet d’âne, : la réponse est dans le titre !
Amicalement.
-
Bonjour,
Encore une excellente étude !
Pour ma part, je fais souvent des "études" uniquement en pensée.
Je retiens des phénomènes curieux et parfois, d'autres phénomènes curieux se rattachent aux premiers et des debuts d'explications s'installent, contredites ou confirmées parfois par les suivantes.
J'avais remarqué que certaines branches de mes chênes, restaient vertes, alors que toutes les autres feuilles commençaient à jaunir et à tomber.
Mon idée était que la chute des feuilles était génétiquement programmée et que l'arbre ne pouvait pas exercer cette programmation sur des branches qui ne pouvaient pas recevoir la sève contenant des "signaux" pour cette chute.
J'avais d'ailleurs écrit ceci en 2015 :
Il y a quelques années j'avais fait une observation inattendue .
Au printemps, de nouvelles feuilles apparaissent sur les branches de mes chênes, qui sont dépouillées depuis l'automne du vieux feuillage.
Or certaines rares branches, portent des feuilles séchées de l'an passé, toujours en place.
De plus les couleurs sont plus "fraîches" que celle des feuilles tombées au sol !
Donc la question : pourquoi certaines feuilles sont tombées (peut-être 99,9%) et que certaines autres sont restées intactes, sèches mais toujours en place ?
Toutes les feuilles devraient rester intactes ou être tombées.
L'explication ne demande pas beaucoup de réflexion.
Normalement les feuilles de ces chènes, leur rôle terminé, sont programmées pour tomber.
Les feuilles restées sur la branche sont des feuilles qui n'ont plus été alimentées par l'arbre, la branche est cassée ou les canaux conducteurs de sève bouchés par des champignons.
Ces feuilles sont mortes jeunes, accidentellement et n'ont pas l'occasion de séparer activement de l'arbre.
L'arbre a appris, au cours des millénaires à se débarrasser de toutes ses feuilles devenues inutiles et même encombrantes, avant que les vents d'hiver et les intempéries (neige, givre) ne risquent de casser les branches....
Dans l'idée de la programmation, une nouvelle information est venue s'ajouter à mes réflexions sur la chute des feuilles d'arbres.
Il existe un bambou, (Phyllostachys bambusoides) qui ne fleurit que tous les 120 ans, mais surtout au même moment partout dans le monde.
(pas par télépathie !)
Je suppose que tous ces bambous sont issus d'une même souche chinoise et qu'à partir de là, c'est la même horloge génétiquement programmée qui le fait fleurir quelle que soit l'endroit où il a été implanté dans le monde..
De la même manière, le "cactus de Noël" (Schlumbergera x buckleyi) fleurit au début de l' hivers sous nos climats, car il est originaire du Brésil, décalage horaire oblige.
http://forum.MikrOscOpia.com/topic/3473-schlumbergera-x-buckleyi/?hl=schlumbergera
Un peu comme la migration des oiseaux, le comportement des plantes, prend son origine dans les temps "géologiques".
Il doit falloir une sélection naturelle + une programmation génétique acquise pour en arriver à ce résultat.
On suppose que les grandes migrations (oiseaux mais aussi mammifères africains) ont une origine dans des modifications climatiques régulières et de grande amplitude.
De même les arbres perdraient leurs feuilles en prévision des grands vents d'hivers afin de ne pas casser sous les raffles...
Amicalement.
-
-
D'accord avec toi Jérôme ( je te salue en passant) .
Ce sont des "coutumes" (comme la corrida de toros) et bien d'autres choses qui se transmettent depuis des siècles de génération en génération jusqu'à ce qu'il y ait prise de conscience.
Amicalement.
-
Bonjour,
HS,
Mais quand même , ça me hérisse !
Publié le 08/10/2019 à 14:40 , mis à jour à 14:41Lundi soir, sur la commune de Lescure d’Albigeois dans le Tarn, des individus ont été repérés en train de chasser des hérissons à l’aide d’un chien. Aussitôt prévenue, police secours est intervenue.
Les policiers ont procédé à l’interpellation de deux personnes, appartenant à la communauté des gens du voyage, en possession de sept hérissons. Les animaux rescapés, ont été conduits au commissariat pour être remisés en lieu sûr dans l’attente de l’intervention des agents de l’ONCFS. Ces derniers doivent procéder à leur réintroduction dans leur milieu naturel.
Les deux quadragénaires incriminés encourent les sanctions applicables au braconnage d’une espèce protégée : deux ans de prison et 150 000 € d’amende.
La rédaction de Ladépêche.
-
Bonjour Dominique, tous,
Magnifique comme d'habitude et plein d'astuces.
Amicalement.
-
Bonjour Pierre,
Sujet un peu ancien qui n'a pas eu de réponse définitive!
si vous pouviez y jeter un coup d'oeil?Tryphon nous a promis un protocole,Oui, il y a pas mal de chose que j'ai promises et comme cette remarque m'a particulièrement piquée, j'ai pas mal cherché pour me mettre dans le contexte de 2016, il y a trois ans.
Ce qui est certain, c'est que le protocole en question ne s'applique qu'à une seule espèce de diatomée.
La question d'un protocole est partie de là : http://forum.MikrOscOpia.com/topic/16144-du-micron-au-pixel-expos%C3%A9/?hl=protocole&do=findComment&comment=62625
et une suite a été donnée là :http://forum.MikrOscOpia.com/topic/16200-du-micron-au-pixel-discussions/?p=62706
Quelques extraits :
P.S....Ah, le cours de seconde sur les balances qui pouvaient être... justes, fidèles et précises... :rolleyes:
Sauf que pour moi, les balances, et la métrologie, c'était bien avant le certificat d'études !
Il me semble que les connaissances étaient moins nombreuses et beaucoup plus solides.
Pour ce qui est du matériel.
Il faut une diatomée du même modèle que celui qui est utilisé au dessus.
Un micromètre objectif.
Un objectif de 40 X et son ON marquée dessus.
Un capteur numérique et ses caractéristiques.
Un logiciel de retouche et son ordinateur.
Accessoirement un microscope.
Amicalement.
Tryphon : Le but n'était pas de créer un test "officiel" avec une diatomée déterminée, mais de montrer ce qui se passe dans nos microscopes quand on photographie un sujet comme une diatomée.
Pour cela, une diatomée déjà présentée ici dans des conditions voisines de mon protocole.
Ensuite, le forum est vaste pour ouvrir d'autres sujet sur d'autres diatomées, d'autres tests, d'autres protocoles...
Jérôme : Mais je suis tout ouïe et s'il y a des propositions (le "protocole") je les prendrai en considération.Le protocole :
On commence donc,
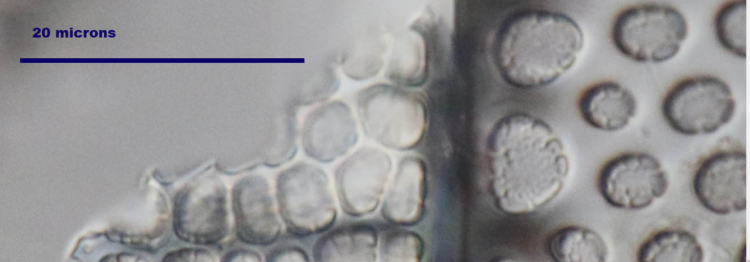
La Diatomée,
Elle s'appelle Actinoptychus heliopelta A confirmer par un diatomiste.Bien entendu ce choix est arbitraire, mais nous sommes plusieurs ici à l'avoir montrée et en plus en "grande résolution" Elle s'y prête bien .Voir les 3 liens ci dessus.
Et en particulier Claude qui a plusieurs cameras.
Préparation Dominique Prades pour ma part.
Elle se reconnait facilement, mais il existe des variantes à nombre de secteurs différents (sont-ce la même?) et différentes tailles selon l'âge (?)
D'après ce que j'ai compris, les parois des diatomées comprennent plusieurs couches perforées et la taille des perforations est différente.
Ici, apparemment on peut facilement mesurer les perforations. Cela nous donne une série de valeurs.
Et on peut facilement aussi si l'éclairage est correct s'il n'y a pas d'artefacts.
J'ai donné quelques exemples des trois grilles (couches) d'autres diatomées utilisées à d'autres fins . Chez A. heliopelta, deux sont nettement visibles et mesurables.
Ta diatomée me parait être un bon test mais le but n'est pas de faire un concours de résolution de diatomées avec les plus petits trous possibles, ou de mesurer un contraste (FTM )
mais d'essayer de comprendre comment, à la limite de résolution, un capteur nous transmet les informations de l'objectif.
L'objectif :
40 X à sec me parait plus courant que des 50 X, 60 X ou 63 X et suffisant pour Actinoptychus heliopelta.Comme ce sont des dimensions chiffrées que l'on recherche , il faut étalonner toutes les photos avec un micromètre objectif (à partir de 8 € )
Il faut connaitre également les caractéristiques du capteur et en premier la taille du photo-site et accessoirement leur nombre.
L'expérience acquise avec ce protocole servira bien entendu à d'autres diatomées ou objets et je l'espère, à aller plus loinP.S....Ah, le cours de seconde sur les balances qui pouvaient être... justes, fidèles et précises... :rolleyes:
Sauf que pour moi, les balances, et la métrologie, c'était bien avant le certificat d'études !
Il me semble que les connaissances étaient moins nombreuses et beaucoup plus solides.
Pour ce qui est du matériel.
Il faut une diatomée du même modèle que celui qui est utilisé au dessus.
Un micromètre objectif.
Un objectif de 40 X et son ON marquée dessus.
Un capteur numérique et ses caractéristiques.
Un logiciel de retouche et son ordinateur.
Accessoirement un microscope.
Amicalement.
Ce qui n'est pas dit mais semble évident.
Mettre une échelle de la manière suivante :
Photographier le micromètre .
Avec le logiciel de retouche extraire une partie du micromètre et l'ajouter à la photo de la diatomée sans jamais modifier l'échelle des photos du micromètre et de la diatomée.
Les traits dessinés sur la photo originale avec une mention de la taille en micron ne sont pas fiables . Chacun pourra chez lui à partir de cette échelle photographiée dessiner tous les traits dont il aura besoin...
Présentation des photos sur le forum :
Aucune réduction de l'image : une réduction de taille d'une image fait disparaître à jamais des détails (informations) ; ce n'est pas de la photo d'Art !
Vous pouvez par-contre augmenter la taille de l'image en l'indiquant : cela n'apporte aucune information supplémentaire mais peut faciliter l'interprétation.
Ensuite il faut indiquer les caractéristiques du matériel comme il est indiqué en début de l'exposé :
Microscope : Zeiss Photomicroscope III (Phase DIC Epi-Fluo)
Eclairage : Kolher Halogène 100W
Condenseur: PLAN-APO ON 1.40
Objectif : No name 40 X ON 0.65 soit une résolution théorique de 0. 525 µ (1/2 µ)
Oculaires : Zeiss Kpl-W 10 X/18
Champ : 20 mm
Camera : DFK 23UP031 (The Imaging Source)- Capteur CMOS 1/2.5" ( APTINA MT9P031) (Aptina Imaging Corp (US) Associé à SONY )
- Capteur : 5.76 mm X 4.29 mm
- Photo-site de 2.2 µ
- Taille numérique de l'image : 2592 X 1944 Pixels soit 5 MP
Adaptateur : Mécanique ; Maison
Optique : Réducteur de champ 0.5 X
Champ couvert par l'objectif : (40 X) : 340 µ.
Champ couvert par la camera : (2592 X 1944 Pixels ) 220 X 170 µEn résumé :
Une même diatomée pour tous Actinoptychus heliopelta (undulatus ?) A confirmer par un spécialiste.
Ne pas changer d’objectif : 40 X (on ne teste pas l'objectif! mais l'échantillonnage de la camera)
Ne pas changer la zone photographiée si on change de camera. Ne jamais déplacer le sujet une fois que le premier cliché est pris.
Mettre une échelle "directe" sur la photo.
Ne pas changer les réglages du microscope après le premier cliché sauf la MAP.
Refaire éventuellement la MAP sur le même détail que l'on aura noté.
Le mieux est de faire la MAP sur l'écran vidéo en mode monitoring.
S'il y a des questions , je préciserais.
Amicalement.
-
Bonjour Pierre,
Au sujet du protocole, il n'était pas explicitement formulé, mais contenu dans ce message
Je recherche également un autre message qui en parle, je le rajouterai ici.
Tryphon nous a promis un protocole, en attendant
Amicalement.
-
Bonjour,
Si vous disposez d'une pièce dédiée, du temps, des connaissances en optique, électronique, informatique, et si vous rêvez d'un microscope confocal pratiquement gratuit, je peux vous donner un très bon filon!
Me contacter.
Amicalement.
-
Bonjour JPM76,
Je ne crois pas aux indices du verre optique négatifs.
En mathématique tout est possible, mais dans la réalité, je n'en suis pas si sûr.
L'indice de réfraction d'un verre est toujours supérieur à 1 .
(1 est l'indice de réfraction du vide). La célérité de la lumière dans le vide est c.
Dans le verre dont l'indice de réfraction est supérieur à 1 la vitesse de la lumière est inférieure à c.
Plus l'indice de réfraction est élevé et plus la lumière met de temps à ressortir du matériaux.
Un indice de réfraction négatif voudrait dire que la lumière dans ce milieu voyagerait plus vite que c.
Cela me parait incongru.
Pour le satellite USA-224 on peut facilement calculer le diamètre de son miroir connaissant sa distance au sujet photographié et sa résolution estimée à 10 cm
Je n'ai pas fait le calcul, mes neurones sont aussi fatigués que les tiens, mais cela ne me parait pas incompatible avec la technologie optique actuelle, sans faire appel à des calculs "imaginaires".
Vous pouvez cliquer pour plus de détails...
Amicalement.
-
Bonjour à tous,
C'est tout à fait exact, la microscopie confocale ne se limite pas à la fluorescence .
Ce sont quand même ces derniers microscopes (confocaux en fluo ) qui sont les plus utilisés en routine médicale et non expérimentalement.
MCBL travaillant en fluorescence.
MCBL pour les matériaux.
Pour ce qui est de la limite d' Abbe, en effet, elle est infranchissable par définition puisque c'est une limite comme aurait pu dire Lapalisse.
Le problème est d'abord de savoir ce qu'elle est réellement. (Où se situe-t'elle).
Quand je dis qu'elle peut être dépassée c'est que le procédé qui permet cela utilise un autre cadre que celui dans lequel cette limite a été établie.
La limite n'est pas dépassée mais l'image est mieux résolue .
En science il est très difficile de s'entendre sur les mots car ils viennent d'humains et sont interprétés par d'autres humains.
Mais à la limite les mots sont moins importants que les intentions .
Amicalement.
-
Le sujet n'est pas clos, il y a encore beaucoup à dire.
Ce qu'il faut dire, et cela n'a pas vraiment été dit avec suffisamment de force, c'est que la limite de Abbe peut être facilement dépassée en utilisant la fluorescence.
Seulement on n'est plus dans la microscopie mais dans l' ultramicroscopie (ou mésoscopie).
On ne voit plus directement la "surface" d'un objet, mais la lumière qu'il émet, comme la lumière d'une étoile lointaine.
Une molécule fluorescente (ou non, dans le cas de l'ultramicroscope) invisible au microscope, peut être détectée et située dans l'espace (microscopie confocale à balayage laser) pour reconstituer l'image d'un objet microscopique..
Amicalement.
-
Bonjour Dudulle,
Cela ne veut pas dire que tout est dit, il y a encore du grain à moudre.
Amicalement.
-
Bonjour Dudule,
Sujet fort intéressant dont nous avons débattu d'innombrables fois.
Pour les réseaux 1000 traits, par exemple voir ce sujet http://forum.MikrOscOpia.com/topic/14722-test-simple-et-pas-cher-de-r%C3%A9solution-pour-les-objectifs-moyens-et-forts/?hl=r%C3%A9seau
Amicalement.
-
Bonjour Pierre,
Comme d'habitude tes photos sont sublimes. Tu dois avoir quelques secrets pour arriver à ce niveau.
Que dire d'autre ?
Au sujet du protocole, je crois qu'on en a pas mal parlé.
De toute façon, il faut avoir un type précis de diatomée dont j'ai donné l'exemple, il y a longtemps.
A partir de là, on pourra comparer les clichés.
Si chacun a une diatomée différente, pas de comparaison possible.
Dans la mesure bien sûr où toutes les diatomées de la même espèce ont des détails de même dimensions.
Amicalement. -
A moins de posséder un laboratoire équipé pour la culture et des connaissances qui vont avec, ce n'est pas possible pour un amateur.
Ce n'est pas possible et pas nécessaire.
Il suffit de prélever de l'eau qui contienne des euglènes et de les conserver le plus longtemps possible.
Une piste pour cultiver des euglènes :
SORDALAB vend du milieu de culture pour euglènes .
https://www.sordalab.com/FR/catalogue/svt/milieux,MEUG,MEUG-00,MCLO,.php
Le milieu de culture MEUG contient de l’acide lactique, il est utilisé pour obtenir une croissance rapide des euglènes. (Les euglènes respirent au début de la croissance puis photosynthétisent en fin de culture)
Le milieu de culture MEUG.00 ne contient pas d’acide lactique (les euglènes photosynthétisent).Amicalement.
-
Bonjour Klaus,
Tes colorations sont merveilleuses.
Je ne peux pas en faire, mais je suis certain que d'autres que moi seraient intéressés par tes colorants.
Ne sois pas gêné de publier dans le forum la liste des colorants que tu as à ta disposition avec les prix.
C'est de l'entre-aide entre microscopistes.
Amicalement.
-
Je verrai cela, car la plupart de mes images font environs 3000 pixels de coté.
Je ne peux pas donner la solution, je ne la connais pas, mais Pierre y arrive très bien.
Pour le bois fossilisé, c'est IMPRESSIONNANT , et Pierre, encore lui, ( :) ) nous en a montré ici même.
Attendons de voir.
Amicalement.
-
Pour l'araignée, il faut demander à pablito son secret pour nous montrer des photos de très grande résolution avec un tout petit poids.
Les détails y sont époustouflants tout en gardant un poids tout à fait raisonnable.
NB: Il faut "Ajouter dans le message " les photos.
Amicalement.





Pomme de terre germination 1
dans [VEGETAUX]
Posté(e)
Bonjour Dominique,
Comme toujours, voici un nouveau et excellent article.
Le CIPC est en principe déjà interdit pour les particuliers (jardiniers amateurs) mais pour les autres :
"Le 26 juin dernier, la Commission Européenne a décidé le non-renouvellement de l’approbation de la substance active chlorprophame (règlement d’exécution UE n°2019/989). Cette molécule, appelée aussi CIPC, est jusqu'alors utilisée dans les produits phytosanitaires comme inhibiteur de la germination des pommes de terre. En application, les États membres ont au plus tard jusqu'au 8 octobre 2020 pour retirer leurs autorisations nationales des produits en contenant. A l’heure actuelle, le chlorprophame dispose d’autorisations en France pour les pommes de terre, les oignons et les racines de chicorée."
https://www.eurofins.fr/agroalimentaire/actualit%C3%A9s/actualit%C3%A9s/chlorprophame-cipc-interdiction-de-cet-antigerminatif-dici-octobre-2020-pommes-de-terre-oignons-racines-de-chicor%C3%A9e/
Ce n'est pas plus mal, mais il me tarde de goûter des frittes à la menthe ! :)
Amicalement.