-
Compteur de contenus
870 -
Inscription
-
Dernière visite
Messages posté(e)s par Olivier Messmer
-
-
Bonjour le Forum,
Je vous poste ici, ce sujet très détaillé pour observer et identifier un Rotifère, selon le trophi. Michel Champipi est passé dans l'art de nous montrer de superbes trophis, éléments primordiaux pour faciliter les identifications des Rotifères.
Mais comment fait-il cette manipulation ? On tentera de comprendre ce qui suit.
PROTOCOLE POUR OBSERVATION D’UN ROTIFERE (Phase 1)
ET DISSECTION D’UN ROTIFERE EN VUE D’EXTRAIRE LE TROPHI (Phase 2)
POUR PERMETTRE UNE BONNE IDENTIFICATION DE L’ESPECE.
Des échantillons d'eau contenant des Rotifères et d'autres organismes vivants (c'est-à-dire copépodes, cladocères ) ou contenant des micros-algues sont des excellents sujets d’études microscopiques , et qui sont facilement isolables à l’aide d’une pipette aspirante munie d’une pointe très fine, et/ou d’un micromanipulateur (cela fera l’objet d’un sujet à paraître ultérieurement.)
A. Placer une quantité d'eau contenant des rotifères dans une petite boîte de Pétri, ou un verre de montre. Un spécimen simple peut être choisi et transféré sur une lame avec un peu d’eau douce. On devra veiller à ne mettre que la quantité juste nécessaire d'eau pour permettre la mise en place d'une lamelle couvre objet pour éviter d'écraser le spécimen par le poids du verre de couverture ou son évasion à l'extérieur du verre de couverture.
B. Noter ou enregistrer sa façon de se déplacer, étudier sa façon de se nourrir, bref, prendre des notes d'observations concernant cette spécie à étudier.
C. Dessinez la forme du rotifère et essayez de reconnaître les parties principales d'un rotifère, photographiez ou filmez certains détails, présence d'yeux, ses couleurs, etc
Étiquetez votre dessin.
D. Faites le même pour d'autres types différents de rotifères différents et comparez ces rotifères.
L'ISOLEMENT DU TROPHI
Une fois que vous avez fini l'observation sur la forme de corps rotifer et le comportement nageant (incluant un dessin), vous peut continuer à disséquer le trophée (voir l'image a)
A. La procédure exige que vous placiez votre unique spécimen sur une lame avec l'eau juste suffisante et le couvriez soigneusement d'une lamelle.
B. Ajoutez alors qu'une seule goutte d' hypochlorite (eau de Javel) avec une pipette en plastique au bord de la lamelle.
C. Si vous observez que la lamelle se déplace en raison de l'excès d'eau, réduisez-le donc en appliquant soigneusement un morceau de buvard à un côté de la lamelle. Observez votre spécimen à très faible grossissement afin de ne pas le perdre de vue.
D. L' hypochlorite de sodium détruit les tissus des animaux et laissera seulement que le trophi . Si la structure n'est pas dans la position idéale pour prises de vues photographiques ou dessins, vous pouvez soigneusement tapoter très légèrement avec une aiguille à coudre emmanchée dans un crayon par exemple, sur la lamelle, tout en observant votre trophi.
E. Dessinez (tirez) autant de détails que vous pouvez observer (étiqueter les parties) et essayez de classifier dans une catégorie de trophée et spéculer sur sa fonction.
F. Ne pas oublier de le monter en montage définitif, après observations, ce qui permettra de se constituer une "trophithèque" pour comparaisons ultérieures avec d'autres trophis.
Voilà !
-----------------------------------------=o :o o=-----------------------------------------
-
Re,
Bonjour Florent,
Tu soulèves là, une très bonne question, qui réveille en moi, quelques souvenirs quand j'étais stagiaire à un laboratoire d'histologie de Paris.
Pour commencer, je ne saurais que te conseiller de lire l'excellent site (merci Google) suivant:
http://www.snv.jussieu.fr/bmedia/ATP/histo.htm
En règle générale, quand je faisais mes coupes histologiques d'organes animales, tels que rate, pancréas ou de souris, cet organe préalablement déshydraté et paraffinée à chaud. Après utilisation du microtome, l'on obtient un long ruban de paraffine, avec la coupe de tissu, il suffissait de placer ce ruban délicatement à la surface d'une eau chaude d'un bain marie, la paraffine flotte à la surface, avec la coupe, cette paraffine fondant presque. Il faut introduire une lame en verre, obliquement, sous la coupe à récupérer et retirer doucement cette lame, la coupe vient avec la lame. Puis ensuite, faire sécher la lame, et procéder aux différents traitements pour éliminer la paraffine et de réhydrater le tissu avant coloration.
Le site donné ci dessus résume bien ce protocole.
A plus ! -------------------------------=o ;) o=-------------------------------------------
-
Bonjour le Forum,
Hello François,
L'allure générale de cette spécie me fait évoquer un Trichotria, voir ici:
http://forum.MikrOscOpia.com/index.php?sho...5&hl=trichotria
Pour l'instant, Trichotria sp. je suis à mon travail, et n'ayant pas mes documentations à ma portée. (Walter Koste)
A bientôt !
--------------------------------------=o :rolleyes: o=------------------------------------
-
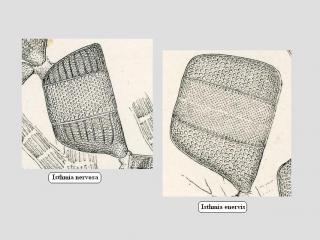
Pour bien comprendre les différences entre Isthmia nervosa et enervis, je te joins un petit montage avec un représentant de chaque, la différence saute aux yeux !
Pourrais tu nous dire comment tu as récolté cette espèce ? En grattant la surface des algues marines ? C'est très intéressant à connaître. On pourrait essayer de trouver cette algue avec ses arborescences, ce qui seraît génial pour illustrer la base de données du Forum.
--------------------------------------------=o :o o=--------------------------------------
-
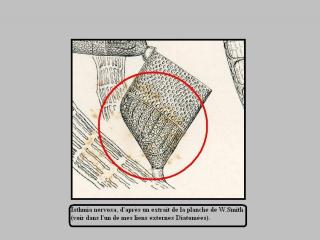
Pour t'aider, je joins un extrait d'une planche de Diatomées de W.Smith, afin de pouvoir comparer avec ta superbe diatomée ! Il y a bien des similitudes ! Si tu pouvais nous chercher et nous montrer cette spécie en sa totalité, c'est pour effectivement confirmer la dissymétrie qu'il existe en cette belle espèce !
La partie encerclée en rouge (incluse dans la nouvelle norme du Forum) correspondrait à ta prise de vue !
Donc, Isthmia nervosa est le nom donné à ta spécie.
--------------------------------------=o ;) o=--------------------------------------------
-
Re-bonjour à tous !
Je viens ici, vous exposer certaines remarques concernant l'art et la manière de nettoyer et de préparer les Diatomées, en vue de les enrichir et de se débarasser de tous débris pouvant nuire à une bonne observation.
Primo, avec mon flacon à prélèvement
(voir ici, http://forum.MikrOscOpia.com/index.php?showtopic=2346 )
je récoltais cette espèce de croûte végétale qui poussait sur la digue de cette plage. Après avoir sommairement observé une goutte de ce prélèvement à travers mon Swift FM-31, pour trouver de grosses quantités de diatomées centriques, et des Pennées.
Afin de préserver la totalité de mon prélèvement, et après lecture et re-lecture de l'excellent article de notre ami Jean,
voir ici : http://www.microscopies.com/DOSSIERS/Magaz..._traitement.htm
Secundo, Je me décidais de ne prélever que l'équivalent de 3ml de cette récolte, le reste ne sera bien entendu traité ultérieurement en cas de succès d'une nouvelle méthodologie que j'ai mis au point, tout en copiant avec celle de Jean.
Donc, après étude de la méthodologie de Jean, et ayant compris ce qui s'ensuivait, que la première sédimentation de cette récolte était à rejeter, les Diatomées, étant nettement plus légères, flottant encore dans le surnageant.
Je faisais passer cette récolte sur une passoire du laboratoire, avec un tamis de 80µm, puis ensuite, avec un autre tamis de 40µm. Bien entendu, je récupère ces deux passages dans deux tubes étiquettés comme suit :
tube n° 1, passage 80µ, et tube n° 2, passage 40µ.
Avec cette trituration, il reste encore pas mal de débris, nettement plus lourds que les Diatomées ! Il ne me reste plus qu'à effectuer une légère centrifugation avec une petite centrifugeuse manuelle - oui, vous avez bien lu ! - de récupération ...
qui marche avec une manivelle, cette petite centrifugeuse à deux branches de la marque WM BOEKEL & CO.Inc, Phila PA (Philadelphia ???) [photo à venir]
Ceci afin de précipiter les 'gros' minuscules débris au fond de mon tube cônique, je reprélève le SURNAGEANT qui contient encore des Diatomées en suspension .
Donc, je rejette le premier culot, et je reprocède à une deuxième centrifugation douce, pour refaire la même manipulation que précédemment ! je récupère le surnageant, et hop, cette fois ci, les choses deviennent sérieuses !
Donc, troisième et dernière centrifugation, histoire de faire un petit culot de "sédiment" au fond de mon tube. Là, je rejette le surnageant, pour ne garder que ce petit culot qui se présente sous une très fine couche lactescente .
Et je fais le traitement à l'eau de Javel, à chaud, à 56° dans un bain marie régulé, avec agitation rotatif, et ce pendant trois bonnes heures. Puis, trois lavages - rinçages, toujours avec la petite centrifugeuse manuelle, et ensuite un bon bain d'acide chlorhydrique, juste le temps de voir une fugace formation d'une petite effervescence, et c'est tout, trois lavages- rinçages et toujours avec la petite centrifugation.
Résultat : J'obtenais de superbes concentrations de Diatomées, vides, intactes à 95%, et pratiquement sans débris organiques et / ou minérales...
Un chose me chagrine, je n'arrive pas à identifier cette Centrique, vue en très grosse quantités, mais, rien, pas de striures, ni de ponctuations ! rien de tout cela !
Sinon, quand je faisais bouger la lamelle avec une aiguille emmanchée, pour voir que ces boîtes se retournaient et que je pouvais les voir en vue connective, sur la tranche ! le fond de la boîte, son couvercle, mais aucune ornementation !
Des photos vont bientôt suivre ! avec ces centriques Avant et Après traitement ...
Ouff ! je prends la peine de souffler un petit coup là !
A bientôt ! --------------------------=o :o o=-------------------------------------------
-
Le Peroxyde d'Hydrogène ou Eau Oxygénée.
Formule chimique : H2O2
Liquide mobile, clair, eau de roche, présentant une odeur légèrement piquante dûe à l'oxygène gazeuse.
Son pH est compris entre 2 à 4, donc un acide.
Généralement, l'eau oxygénée est vendue en pharmacie sous forme d'une solution à 10%. Pour les hautes concentrations, c'est pratiquement introuvable, en raison de sa dangerosité.
Conditions à éviter : Chauffage. Provoque un dégagement massif d'oxygène, lui même toxique à haute concentration dans l'air.
Matières à éviter : métaux alcalins, sels alcalins, hydroxydes alcalins, métaux alcalino-terreux, métaux, métaux en poudre, oxydes de métaux, sel de métaux, non-métaux, oxydes non métalliques, aldéhydes, alcools, amines, ammoniac, hydrazine et dérivés, hydrures, substances combustibles, éther, acides, anhydrides, oxydant, substances organiques, peroxydes, impuretés/poussière, KMnO4 , solvants organiques, composés nitrés organiques, laiton.
Stabilisant : Acide pyridine-2,6 dicarboxylique (acide dipicolinique)
Sensible à la lumière , donc conserver en flacons teintés. et à température ambiante
1. Identification des dangers
Provoque des brûlures.
2. Informations toxicologiques
Toxicité aiguë : DL50 ( voie orale , souris ) = 2000 mg/kg ; DL50 ( , rat ) = 4060 mg/kg ; CL50
( par inhalation , rat ) = 2000 mg/m3 / 4 h .
Autres informations toxicologiques :
En cas d’apparition de vapeurs/aérosols : irritation sur les voies respiratoires, yeux, estomac. Brûlures des yeux, peau, muqueuse.
En cas d’ingestion : malaises et vomissements. brûlures de l’œsophage et de l’estomac
En cas d’ingestion de quantités élevées : Danger de perforation pour l’œsophage et l’estomac.
Autres données : IARC : groupe 3 (l’effet cancérogène chez l’homme ne peut pas être évalué).
03. Premiers secours
En cas d’inhalation : faire respirer de l’air frais. Consulter un médecin.
En cas de contact avec la peau : laver abondamment à l’eau. Tamponner au polyéthylèneglycol 400. Enlever immédiatement tout vêtement souillé.
En cas de contact avec les yeux : rincer abondamment à l’eau durant 10 minutes au moins, en maintenant les paupières bien écartées. Consulter immédiatement un ophtalmologiste.
En cas d’ingestion : faire boire beaucoup d’eau, ne pas tenter de faire vomir
(danger de perforation !). Consulter immédiatement un médecin. Ne pas essayer de neutraliser.
4. Mesures de lutte contre l’incendie
Moyens d’extinction appropriés : eau
Moyens d’extinction déconseillés : CO2, mousse, poudre
Dangers spécifiques : Effet comburant par libération d’oxygène.
Autres informations : Non combustible.
-----------------------------------------=o :ph34r: o=------------------------------------
-
Re !
Ayant mon Swift FM-31 avec moi, dans une petite valise contenant des pots à prélèvements (flacon en plastique transparent avec bouchon à vis rouge, comme je vous l'avais indiqué dans ma proposition de vous les mettre à disposition voir ici http://forum.MikrOscOpia.com/index.php?showtopic=222Pour vous mettre à la piste de "l'acquisition de ce Swift-FM-31, je vous suggère d'aller ici : http://forum.MikrOscOpia.com/index.php?showtopic=2560&hl= où il était question que notre ami Gyrosigma désirait posséder un microscope inversé pour regarder la formation d'auxospores de Melosira . Bien ! Etant moi-même possesseur d'un microscope inversé en "rab" puisque mon patron m'avait demandé si cela m'intéressait de l'avoir avant de le jeter à la casse, je lui avais répondu par Oui ! Donc, je m'étais souvenu des désidératas de Gyrosigma et je lui avais dit que j'avais un Microscope inversé à sa disposition (Invertoscope Zeiss comme vous pouvez le voir ici : http://forum.MikrOscOpia.com/index.php?showtopic=2376 )
Là, il m'avait dit en MP qu'il était très intéressé par ce microscope, et sachant qu'IL avait fait l'achat d'un nouveau Swift, je lui demandais son prix et nous avons pu nous convenir de faire l'échange !!! Donc Dominique, étant venu à St Aygulf, était reparti avec mon microscope Invertoscope D de Zeiss et moi-même, de retour vers Nice avec son Swift-FM 31, voilà que notre échange a été fort intéressante ! Dominique s'étant retrouvé avec son microscope inversé et moi-même avec mon Swift-FM31, tout le monde était content !
Donc, désormais, je ne me déplaces plus jamais sans mon Swift-FM31 et que Dominique pourra alors surveiller l'évolution des sporulations ou évolutions des phénomènes alguales sous son nouveau microscope inversé !
Voilà cette mémorable histoire qui valait la peine d'être racontée ici !
A plus ! -------------------------------=o :D o=-------------------------------------------
Et je réitère ici un très grand merci à Dominique pour cette échange !
-
Bonsoir le Forum,
Je viens ici vous exposer sur une "nouvelle" technique de prélèvement pour étude de Diatomées que j'ai effectuée hier après midi. Ayant mon Swift FM-31 avec moi, dans une petite valise contenant des pots à prélèvements (flacon en plastique transparent avec bouchon à vis rouge, comme je vous l'avais indiqué dans ma proposition de vous les mettre à disposition voir ici http://forum.MikrOscOpia.com/index.php?showtopic=222
sinon que ces pots sont nettement plus gros.
J'étais donc dans la plage du Larvotto à Monaco, avec mon masque et tuba, mon pot à la main, et le long de la digue immergée parfaitement lisse et verticale, j'ouvres mon pot sous l'eau, le couvercle à la main droite, mon pot à la main gauche, j'applique l'ouverture du pot bien à plat sur la surface de la digue immergée et je nage vers l'avant tout en tenant le pot bien appuyé sur la digue, immédiatement, et au fur et à mesure que j'avançais en nageant, je voyais mon pot se troubler de plus en plus, en se chargeant de tous débris raclés sur cette digue... Puis, je m'arrêtais, j'attendais un petit moment, pour décoller le pot de la surface de cette digue pour mettre en place le couvercle pour le visser sur mon pot . Avec une pipette, je prélève une goutte du culot de mon pot, pour l'examiner sous mon Swift, pour constater une forte concentration en Diatomées centriques, toutes bourrées en Plastes, ainsi que quelques diatomées pennées, avec de long et fins prolongements que je pourrais attribuer à Nitszchia acicularis ?
Vous devriez pouvoir réussir à râcler toutes surfaces de cette façon, à récolter un maximum de cette petite croûte "mousseuse", qui recouvre ainsi les rochers et autres supports. Bien entendu, j'ai fixé mon prélèvement avec du formaldéhyde, en attendant de trouver le meilleur protocole pour nettoyer et purifier les Diatomées récoltées !
A bientôt ! ----------------------------=o ;) o=-------------------------------------------
-
Re !
Je crois qu'il aurait été plus utile de "pondre" ce sujet précisément dans le topic :
Poussières sur le capteur ( et lentilles ) voir ici :
http://forum.MikrOscOpia.com/index.php?showtopic=2628&hl=
C'est aussi une autre alternative intéressante, à essayer et à comparer tant de systèmes nous soient proposés actuellement !
-----------------------------------------=o ;) o=----------------------------------------
Sujet à regrouper !
-
Le Formol ou Aldéhyde Formique ou Formaldéhyde
Ce que l'on appelle communément " formol " est en réalité une solution concentrée d'un gaz : le méthanal, ou aldéhyde formique, ou encore formaldéhyde
C'est une solution aqueuse à base d'aldéhyde formique (liquide volatil formulé H-CHO), antiseptique parfois employée dans le domaine des arts plastiques comme agent conservateur pour éviter l'apparition d'éléments vivants indésirables dans les pots de peintures synthétiques etc., mais aussi, notamment en décoration, pour solidifier, durcir et imperméabiliser les surfaces peintes avec des produits contenant des éléments protéiques. Le formol aurait en effet le pouvoir de durcir les liants et les colles à base de protéines. Il pourrait cependant rendre les gélatines friables.
Le formol peut être ajouté au liant ou pulvérisé sur la peinture protéique absolument sèche, dilué dans l'eau (une part pour neuf d'eau, sur la base d'une solution classique de formol déjà diluée, comprenant moins de 50% d'aldéhyde formique). Attention : les "formaldéhydes" proposés dans le commerce sont généralement déjà dilués. Il faut faire un calcul pour respecter la proportion énoncée ci-dessus.
Pour réaliser certaines préparations ou expériences, plus généralement lorsqu'il s'agit de provoquer certaines réactions où la nécessité de recourir à des aldéhydes est modérée et ne nécessite pas spécifiquement du formol, on peut utiliser avantageusement du vinaigre car ce produit contient également un aldéhyde sans arborer autant d'inconvénients.Signalons la possibilité de mêler formol et caséine. Voir galatithe.
Le formaldéhyde est inflammable par réchauffement. Éviter le contact avec la peau et surtout avec les yeux : c'est un puissant irritant pouvant occasionner des réactions allergiques. Aérer le plus possible le local. Ne pas manger, boire ni fumer : l'ingestion produit des effets graves. Le formaldéhyde traverse le placenta et se retrouve dans le lait maternel. Il est fortement soupçonné d'être cancérigène.
NDLR
Le formol, est un produit très largement utilisé pour la conservation d’organes humains ou animales tels que cerveaux, cœurs, foies, et autres organes, qui se trouvent dans de vastes récipients fermés et exposés au public dans des musées, comme le Palais de la Découverte à Paris ou au Muséum d’Histoire Naturelle de Paris …
Une anecdote : un cerveau humain exposé au Palais de la Découverte, dans les années 1970, lors d’une visite faite avec ma classe d’école, je m’en allais soulever un couvercle d’un bocal contenant un cerveau humain, pour respirer l’air contenant ce bocal, immédiatement, je sentais comme mon cerveau souffrir et se rapetisser qu’immédiatement je le refermais aussitôt… l’odeur du formol m’avait fait comprendre que j’avais fait quelque chose d’interdit ! Epouvantable !
Heureusement que ce produit ne soit plus présent dans les coffrets du petit chimiste 2005 !
Je m’étais amusé à cette époque là à faire un filet de bakélite avec le Phénol, ce filet de plastique de couleur blanche qui filait au bout de ma baguette de verre !
On voit bien que les années passant, les conseils de sécurité ayant fait son chemin, on ne trouvera plus jamais de tels produits chimiques dans les coffrets du parfait petit chimiste 2005 !
Dernières informations, à traiter avec prudence ! ***
"Des milliers de G.I.'s, pendant la guerre du Golfe (et non de l'Irak), ont été victimes d'intoxications dues au Coca-Cola light. Les Coca-Cola light sont édulcorés à l'aspartame. Pendant les hostilités, les palettes de canettes étaient entreposées au soleil, chaud dans ces régions.
A partir de 33°C, l'aspartame devient du méthanol (alcool à brûler) très toxique, qui, ensuite, se dégrade en formaldéhyde (formol) encore plus toxique. Et que se passe-t-il dans l'estomac, à 37°C bien tassés ?
Bizarre, bizarre, l'aspartame a été inventé par... Monsanto, dans le cadre de la guerre chimique (acésulfamine de potassium). Depuis deux ans, des scientifiques et des médecins dénoncent sa dangerosité (diabètes graves et cancers du cerveau, Journal of Neurology and Experimental Neurology, 1996). Ils réclament son interdiction.
Et, cependant, il est toujours largement consommé dans 90 pays, et notamment par les jeunes par souci (erroné) de mincir. "
A voir plus tard ce qu'il en est !
*** ajout de l'information de ce soir .
Pour de plus amples renseignements sur le "formol" :
http://fr.wikipedia.org/wiki/Formol
--------------------------------------------=o :ph34r: o=---------------------------------
Prochain article : l'Eau Oxygénée ... (merci SpiroNucleus)
-
PHENOL ou Acide phénolique
Le phénol est corrosif et toxique. Pur, c'est un produit dangereux dont il faut se méfier. En solution à 3 %, les dangers sont plus réduits, mais il est cependant préférable d'éviter tout contact avec la peau (il l'attaque rapidement en formant des taches blanches) ou les yeux, et d'éviter de respirer les vapeurs.
NDLR : Autrefois, dans les jouets du petit chimiste, on trouvait un flacon de cristaux de Phénol, avec ces cristaux, l’on pouvait obtenir une Bakélite après polymérisation avec du Formol ou formaldéhyde. Depuis, ces composants sont retirés des boîtes du petit chimiste distribué aux enfants en raison de la dangerosité du produit en cause !
Le Phénol se répand, lors de l’ouverture du flacon, une odeur très caractéristique et très pénétrante, puisqu’il ne suffit que l’ouvrir et fermer aussitôt après pour sentir tout de suite après une très forte odeur « aromatique » se répandre dans toute la pièce !
Ce produit est fortement corrosif sur la peau, et toutes muqueuses !
Pour travailler avec ce produit, on ne saurait que conseiller de le faire sous hotte aspirante à flux vertical . et avec des blouses et gants de protections, des lunettes, tellement ce produit est très dangereux à manipuler !
Je crois qu’à ce jour, il sera très difficile de se procurer du Phénol à l’heure actuelle !
----------------------------------------------=o :ph34r: o=-------------------------------
Prochain article : Le Formol ou formaldéhyde ...
-
Eau de Javel ou Hypochlorite de Soude
L’hypochlorite de Na pur est un puissant agent corrosif ; La dose létale est de 8,2 g par kg, soit environ 60 g pour une personne de 75 kgs … très dangereux pour les muqueuses et les yeux ; à manipuler avec beaucoup de précautions (les gants sont conseillés et même porter des lunettes de protection !) En cas de contact, rincer abondamment et consulter un médecin .
Sa durée d’utilisation, en solution aqueuse, est de 6 mois maximum ; pur, il reste actif durant 18 à 24 mois
Rappel : Il est IMPERATIF de ne jamais mélanger avec l’acide chlorhydrique ou tout autre acide à cause des risques de dégagements gazeux de Chlore.
Rappel 2 : L’eau de Javel est un puissant décolorant de tissus (jeans, tee shirts, polos, etc.…) donc, toujours porter une vieille blouse étanche (en toile cirée de préférence…)
---------------------------------------------=o :ph34r: o=--------------------------------
Prochain article : l'Acide Phénique ou Phénol
-
L'ACIDE CHLORHYDRIQUE PUR ou CHLORURE D'HYDROGENE (HCL)
Le chlorure d’hydrogène est composé en parties égales de chlore et d’hydrogène. Le chlore est un gaz dangereux car il irrite les bronches (provoque la toux), détruit les tissus des alvéoles pulmonaires (crachements de sang) et provoque une broncho-pneumonie.
Le contact respiratoire avec une atmosphère contenant 750 mg de chlore/m³ d’air (soit 0,25 L/m³) est mortel en 10 minutes ; c’est le premier gaz de combat qui a été utilisé durant la guerre 1914-1918.
Le chlorure d’hydrogène est un gaz plus lourd que l’air, incolore, à odeur piquante.
En solution aqueuse concentrée, il est moins dangereux mais doit être manipulé avec précaution, dans des locaux bien ventilés et de préférence sous hotte ; il reste très irritant pour les poumons.
NDLR (Note De La Rédaction du Forum):
Il est question d'utiliser de l'acide chlorhydrique pour le nettoyage et préparation des Diatomées. En effet, cet acide va faire dissoudre les impuretés minérales et organiques, d'un prélèvement contenant des Diatomées traité à l'eau de Javel.
Donc, l'eau de Javel (voir plus loin) va permettre aux frustules de s'ouvrir et ainsi, le contenu des diatomées va s'échapper. Avant d'ajouter l'acide chlorhydrique, il est formellement impératif de très bien rincer le prélèvement ayant contenu l’eau de Javel avec beaucoup d’eau de telle façon qu’il ne reste plus aucune molécule d’eau de Javel.
Sinon, l’ajout d’acide chlorhydrique va provoquer en présence d’eau de Javel, un dégagement gazeux de Chlore.
Autres remarques, très bien fermer la bouteille d’acide chlorhydrique, sinon, des vapeurs acides vont s’échapper hors de la bouteille et contaminer la pièce de ‘travail’, le lendemain, vous risqueriez de trouver vos objets ferreux rouillés ! (aventure de Chris) et de Gyrosigma.
Secundo, pour diluer l’acide chlorhydrique, toujours respecter la règle d’or :
Verser goutte à goutte l’acide à diluer dans l’eau …
Jamais l’inverse !
---------------------------------------=o :blink: o=---------------------------------------
Prochain sujet : l'Eau de Javel ou Hypochlorite de Soude
-
Bonjour le Forum,
Etant moi-même technicien de laboratoire et travaillant par conséquent avec des produits chimiques qualifiés d'extrêmement dangeureux (bromure d'éthidium, etc...)
Et avec force lecture au sein de ce Forum, pour constater l'existence de formulations pour des colorants et réactifs utilisés pour la Microscopie en général.
Je me vois donc, professionnellement parlant, obligé d'ouvrir un topic où il sera justement question de traiter chaque réactif et de noter la dangerosité d'un réactif et surtout, de bien se rappeler certaines notes inhérentes à chaque réactif et à chaque cas particulier dans le domaine Microscopique et environnemental.
Je tiens à vous rappeler l'excellent site de notre collaborateur Marcel "Lactarius" qui donne un exposé complet pour chaque réactif, avec les remarques très pertinentes.
http://users.skynet.be/Champignons_passion/main.htm
section Chimie et ensuite Fiches techniques ...
A bientôt !
----------------------------------------=o :ph34r: o=-------------------------------------
-
d'où raison de plus de bien observer et d 'annoter les croquis que l'on peut faire et plusieurs de nos amis du forum sont exemplaires à ce titre
A la veille des vacances : prenons de bonnes résolutions: au moins un croquis annoté par sujet observé et nous pourrons comparer nos carnets de notes (scientifiques! ) à la rentrée !
Excellente initiative ! De cette manière là, on finira par faire progresser notre Forum à un niveau jamais parvenu !
Et de faire progresser petit à petit notre tâche de démêler les fils que nous cache Dame Nature ! Nous en sommes loin d'avoir la connaissance universelle , mais petit à petit, nous ferons de ce forum, un très grand forum qui sera suivi par les plus grandes entités scientifiques de notre monde ! Et que nous contribuerons à parfaire à combler les mystères de Dame Nature qui nous cache encore bien de toutes ces mystères encore restant à découvrir et à nommer !
Voilà ce que j'ai du moins à souligner jusqu'à présent !
Tout noter, tout comparer et discuter ! Même s'il faudra qu'un jour, nous puissions interpeller un éminent spécialiste pour faire valoir nos découvertes ! Il nous reste plus qu'à connaître plus de cette Nature à nous faire pondre nos constatations, nos découvertes, et cela nous fera contribuer à faire avancer d'un grand pas à la compréhension de la Nature qui nous enveloppe et qui nous cache encore bien, même beaucoup de choses à découvrir par nous mêmes !
Nous n'avons certes pas la Connaissance Universelle, mais petit à petit, nous nous approchons des secrets de Dame Nature ! Pas vrai les microscopistes que nous sommes ? Allons, allons y pour mieux aller en avant, pour aller encore plus loin dans la compréhension de cette Nature qui nous entoure et que nous devrions chercher encore plus à la préserver plus ! Que toutes nos découvertes soient et seront profitables pour nos futures générations ! Qu'on se le dise partout !
La Nature est fragile, A nous de la préserver et de la conserver !
----------------------------------------=o ;) o=--------------------------------------------
-
Bonjour à tous, anciens comme aux débutants !
C'est un bien difficile sujet de discussion que je vous pose aujourd'hui !
Comment vais je aborder ce sujet ?
Je vais rappeler les principes de base que l’on m’a inculqué pendant mes études scientifiques :
Quand je suis devant mon microscope, je prends mon temps de tout voir et de tout noter, et comme je suis toujours curieux de tout savoir et de tout connaître sur un sujet, Si je vois un objet inconnu, je m’attarde sur ce sujet, je le « teste », je note tout ce qui s’y rapporte, si le sujet bouge ou reste immobile, si on a affaire à un sujet immobile, attendre une éventuelle réaction ou un éventuel mouvement. Dessiner, photographier sur toutes les faces, essayer de faire bouger l’objet en tapotant très légèrement sur un coin de la lamelle.
Prendre une ou des photos en contraste de phase si vous soupçonnez la présence de flagelles, ou de cils, ou de poils, ou d’axopodes, Le contraste de phase peut mettre en évidence des cytoplasmes transparents comme les Amibes, les organisations géographiques de certains tests de Thécamibiens, à user avec modération.
Penser aussi à prendre des clichés en lumière normale, car le contraste de phase peut modifier les couleurs naturelles de certains objets (amibes, euglènes, rotifères etc.) car il existe des spécies qui sont totalement transparentes, hyalines, ou d’autres qui contiennent des chloroplastes , zoochlorelles, pyrénoïdes, .
Noter aussi les grossissements utilisés, objectifs 4x, 10x, 20x etc.
Noter aussi les dispositifs de prises de vues (appareils numériques, argentiques, ou webcams)
Noter également les lieux de prélèvements.
Je sais, tout ce que j’ai dit ci dessus est contraignant, mais, avec ceci, tous les renseignements transcrits dans notre forum nous sont fort précieux pour la suite ! Pourquoi ? Cela nous éviterait d’avoir à poser ultérieurement les questions suivantes : « D’autres photos seraient les bienvenues », « Une photo en lumière normale serait bien » etc.
Personnellement, des fois, quand je suis sur une lame d’une goutte d’eau venant d’un endroit inconnu, si je reconnais un objet comme une spécie parfaitement identifiée et connue de moi-même, je passe mon chemin, SAUF, s’il y a vraiment une belle opportunité de faire une photo, si je trouve une spécie totalement inconnue, là, je suis capable de passer une heure là dessus, à noter, à dessiner, à photographier, à la faire bouger, bref, à m’intéresser uniquement à cette spécie, pour mieux la noter, connaître, et l’identifier .
Des fois, je me surprends à passer trois heures sur une seule lame !
Et il y a encore tant de nouvelles espèces inconnues à découvrir et à exposer à une communauté scientifique ! Imaginez de voir votre nom passer à la postérité ?
Floscularia veroletus ? Cosmarium praxtensis ? Euglypha avocatus ? Micrasterias voisinus ? etc...
Les deuxièmes noms de ces sujets sont imaginaires, mais facilement reconaissables pour les forumistes d'ici !
Voilà, que le virus de la curiosité vous attrape pour aller plus loin dans l'art et la manière de connaître et de percer encore mieux les mystères de Dame Nature !
------------------------------------------=o :D o=-----------------------------------------
Voilà ! :ph34r: :blink: :ph34r:
-----------------------------------------=o ;) o=------------------------------------------
-
Re !
Hello André, une petite précision, cette Grassette est Pinguicula vulgaris.
De plus, elle figure dans la liste des fleurs protégées.
Merci pour tes descriptions florales et pollinistiques .
---------------------------------------=o ;) o=--------------------------------------------
-
Hello Michel !
Apparemment, c'est bien Beauchampia crucigera (ancien nom de Cephalosiphon cruciger ou Melicerta cephalosiphon )
Dorsal antenna very long. Corona of two distinct lobes. Tube irregular, translucent, and gelatinous. One rare species up to 500 um longAntenne dorsale très long. Corona en deux lobes disctintes. Tube irrégulier, translucide et gélatineux. Une des rares spécies mesurant plus de 500µm de long.
Il se pourrait que cela soit un 'jeune' !
----------------------------------------=o :o o=-------------------------------------------
-
Hello Albertus !
Non un problema! Se hai trovato Surirella spiralis, ne troverai altri!
Pour les francophones : Pas de problème, si tu as trouvé un Surirella spiralis, tu en trouveras d'autres !
On va attendre tranquillement tes futures photos !
Cordialement !
------------------------------------------=o ;) o=-----------------------------------------
-
Bonjour le Forum,
Voilà une piste fort intéressante à exploiter, comme l'a justement mentionné Florent, repérer une "vieille pharmacie" de campagne, de préférence.
Une petite recommandation s'impose (qui va d'ailleurs être notifiée dans mon prochain post concernant les manipulations et dangers des produits chimiques)
Ces colorants, sont généralement vendus en poudres très, voire même extrêmement fines. Penser à travailler avec des gants (de latex) ou autres matières (MAPA), et de porter une blouse.
Pourquoi ? Etant donné la finesse de ces poudres, l'on aura vite fait de s'en répandre un peu partout, même par l'invisible courant de votre propre respiration !
Sans blouses, vos vêtements seraient immanquablement tachées de petits points de couleur. Attention à l'electricité statique si vous manipulez ces poudres avec une petite cuillère en plastique, ces particules auraient vite fait de se répandre à l'extérieur. Donc, prendre le temps, sans précipitations, calmement, et juste une toute petite 'pincée' de cette poudre est très largement suffissant pour faire un bon flacon de solution colorante qui va durer.. mais qui va durer longtemps !
Voilà, ce qui est dit !
-------------------------------------------=o ;) o=----------------------------------------
-
Bonjour le Forum,
Hello Adeline,
Pour tenter de répondre à ta question concernant les colorations différentielles pour mettre en évidence les cils et flagelles des Invertébrés.
Une première approche a été faite par notre ami Dominique I, avec l'utilisation du contraste de phase qui peut se faire in vivo...
Pour les colorations des cils et flagelles, il y a deux méthodes :
La première, méthode de Leifson
...a) Réactifs :
.......Préparer trois solutions :
.............Solution à 3% de tanin à l'éther ou à l'alcool en eau distillée
.............Solution à 1.5% de NaCl en eau distillée (Chlorure de Sodium)
.............Solution alcoolique de fuschine à 5% dans l'alcool à 95%
-------------Les mélanger à parties égales. Ce colorant se conserve quelques jours
................à température ambiante, plusieurs semaines en glacière.
...B) Technique :
.......Recouvrir la lame de colorant de Leifson versé avec une pipette dont on place
.......l'extrémité au contact de la lame pendant l'écoulement.
Laisser agir 10 minutes environ.
Laver directement à l'eau sans rejeter au préalable le colorant.
Sécher
Les cellules apparaissent en rouge vif, les cils et flagelles en rouge ou rose vif.
Une autre méthode : méthode de Cazarès Gil. Je n'ai pas la formulation de cette technique...
------------------------------------------=o ;) o=---------------------------------------
-
Bonsoir le Forum,
Hello Philippe !
Certainement, tu as bien trouvé ! Il s'agissait d'un Testudinella, peut-être patina...
Si tu pouvais nous décrire l'endroit de ton prélèvement ? ce serait très instructif !
A bientôt !
--------------------------------------------=o ;) o=--------------------------------------
-
Re !
Hello André !
Que ces fleurs sont jolies !
Mais permets moi d'ajouter, quel est l'orthographie exacte de cette spécie ?
En effet, en recherchant dans le Web le mot "legouzia", je tombe sur une proposition de Google : "Essayez avec cette orthographe : Legousia " !
Le mot LegouZia comporte tout au plus 22 sites, alors que le mot LegouSia en comporte plus de 350 !
Simple curiosité de ma part !
Et encore un très grand merci à André qui a pris le relai de notre Ami StentorBleu, pour nous présenter toujours de si belles photos des fleurs de nos régions, les caractéristiques et les morphologies pollinistiques ! :rolleyes:
-----------------------------------------=o ;) o=------------------------------------------



Montage de diatomées dans le style Victorien
dans DIATOMEES
Posté(e)
Là, je suis vraiment sans voix, béat d'admiration pour la précision de la mise en place des différents diatomées, ce magnifique travail, certainement pensé et tracé d'avance sur papier par Dominique PRADES, le choix des diatomées, puis la mise en place des différentes pièces de ce minuscule puzzle !
Quelle symétrie dans les formes, régularité et disposition, il est clair que Dominique PRADES a acquis là, un savoir faire indubitable à exprimer la réalisation de ce tel chef d'oeuvre ... Pensez donc, sur une lame de verre, ce tableau ne représente qu'un millimètre de diamètre (voire moins) !
Bravo Dominique PRADES, tu continues à nous faire pousser des cris d'admiration d'envie de posséder de telles lames !
Bravo et merci de nous faire partager tes travaux minutieux pour nous faire sortir des tableaux invraisemblables !
Olivier . . . :o
------------------------------------------------=oO :rolleyes: Oo=-------------------------------------------------------