-
Compteur de contenus
4 181 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Jean Marie Cavanihac a gagné pour la dernière fois le 4 septembre 2024
Jean Marie Cavanihac a eu le contenu le plus aimé !
À propos de Jean Marie Cavanihac

Contact Methods
-
ICQ
0
-
Yahoo
Micromars2001
-
Website URL
http://
Visiteurs récents du profil
Jean Marie Cavanihac's Achievements
-
Jean Marie Cavanihac a commencé à suivre copépode calanus.jpg
-

Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
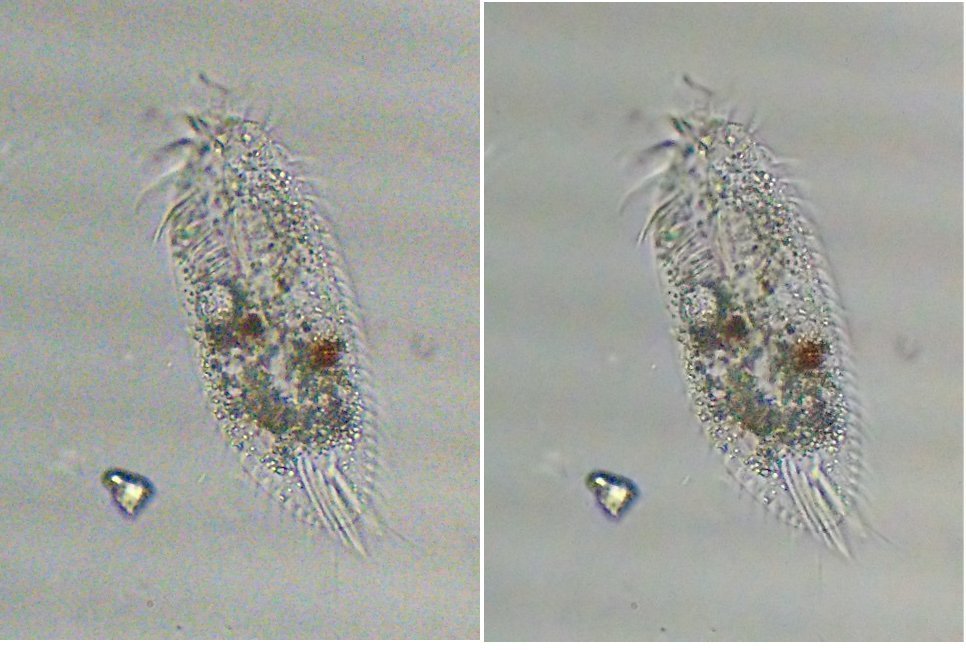
Bonjour Dominique Bonne question ! Les copépodes sont ubiquistes; on les trouve dans tous les milieux aquatiques voire des flaques d'eau, eaux saumâtres etc . Il n'y a pas de différences morphologiques entre espèce marine et eau douce. Dans mes observations j'ai trouvé des cyclopoïdes (le plus commun étant le cyclops) dans l'eau douce et aussi en eau de mer, mais pas de calanoïdes ni harpaticoïdes dans l'eau douce (encore que je n'ai pas beaucoup de choix pour les sites en eau douce !) . Je pense que la densité des espèces est beaucoup plus grande en eau de mer ce qui facilite la capture en nombre. Ce qui m'a étonné c'est de rencontrer Tigriopus qui n'est pas référencé en Méditerranée . Merci pour ton appréciation sur la dernière image "live" (: on voit le flou des maxillipédes qui s'agitent) , mais il faut être rapide pour la prise de vue. ! Amitiés JMC -

Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
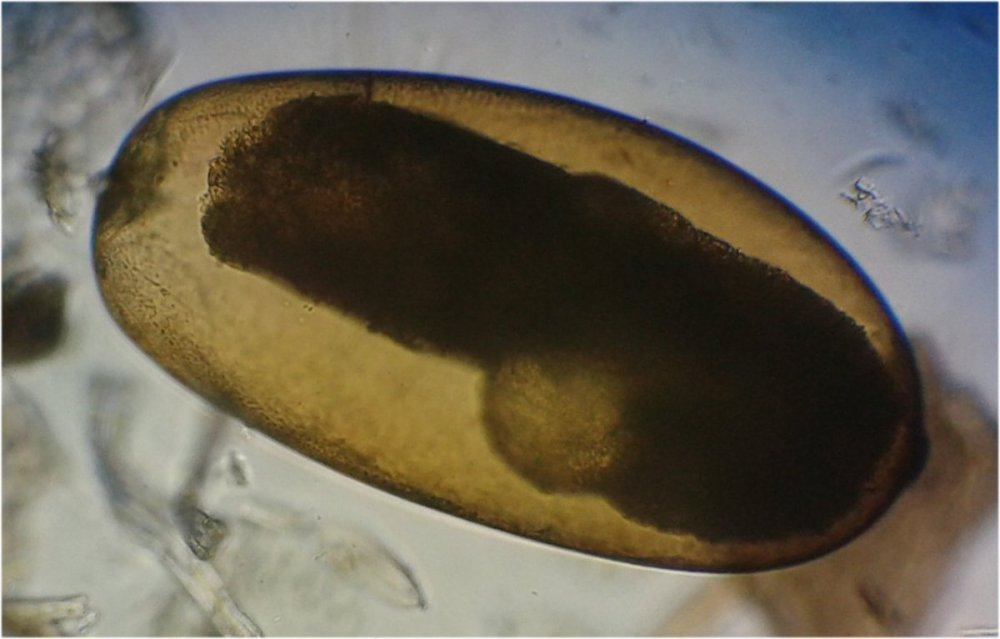
Suite ... Quatrième espèce : cette fois ordre des Harpaticoïdes : euterpina acufrontis : deux antennules courtes géniculées* sur le mâle à droite , rostre* bien visible sur la femelle mage de gauche détail d’une antennule mâle pliée et étendue et image à droite : P5 de la femelle très semblable à celle du mâle. Sur ce spécimen mâle on distingue un spermatophore* qui n’a pas encore été transféré sur la femelle détail au x 40 Cinquième espèce : harpaticoïde qui m’ a été difficile à identifier : Tigriopus. (Tig pods) Il en existe une quinzaine d’espèces. Leur couleur jaune est due à un pigment orange (astaxanthine) qui est synthétisé pour les protéger des rayons UVA et UVB du soleil, car les zones à faible profondeur (flaques) où ils vivent sont soumises aux rayons solaires. Les antennules, qui possèdent des détecteurs chimiques, permettent au mâle de reconnaître les propriétés chimiques d’une femelle en période de reproduction. On remarque les antennules du mâle de forme très caractéristique qui aident à l’accouplement et aussi la présence de maxillipèdes* chez les deux sexes. On voit bien le sac ovigène chez la femelle . Détail des antennules du mâle image de gauche (on y distingue des poils sensitifs ) et à droite un des deux maxillipèdes objectif x 40 Il semble que cette espèce soit plus rare en Méditerranée : je ne l’ai pas trouvée dans « Faune de France biblio Ref 3 ni sur Ref 4 (base de donnée française importante )» mais seulement chez « G.O. Sars – Ref2 ». L ‘espèce est sensée se trouver sur la cote Ouest de l’Europe mais ces spécimens ont bien été recueillis en Méditerranée ! Lexique : Antennule : Le plus antérieur des appendices pairs des crustacés, formé d'une base contenant un statocyste et de deux fouets, aux fonctions tactiles. L'une des fonctions de l'antennule est la détection de la nourriture, des mouvements de l'eau, des prédateurs Géniculée : avec une articulation rappelant celle du genou Spermatophore : une capsule contenant des spermatozoïdes créée par les mâles de diverses espèces , et transférée dans ou a proximité de l'ovipore de la femelle pendant l’accouplement Ovipore : organe sexuel femelle en forme de pore qui est inséminé par le spermatophore déposé par le mâle Maxillipède : Le maxillipède (littéralement « pied-mâchoire ») est un appendice du péréion (ou thorax) modifié chez certains crustacés et impliqué dans la nutrition. Le maxillipède est une sorte de « patte » thoracique qui a été transformée et qui sert à la mastication . Rostre : Prolongement pointu, vers l'avant du corps chez les insectes et crustacés Pour terminer et montrer la beauté d’un copépode vivant voici une image en fond noir pour s’exercer à la détermination : quel ordre, mâle ou femelle, espèce ?? Les indices sont ci dessus ! JMC -
Jean Marie Cavanihac a commencé à suivre Ce que mangent les hirondelles... et Petite collection de copépodes marins
-

Petite collection de copépodes marins
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
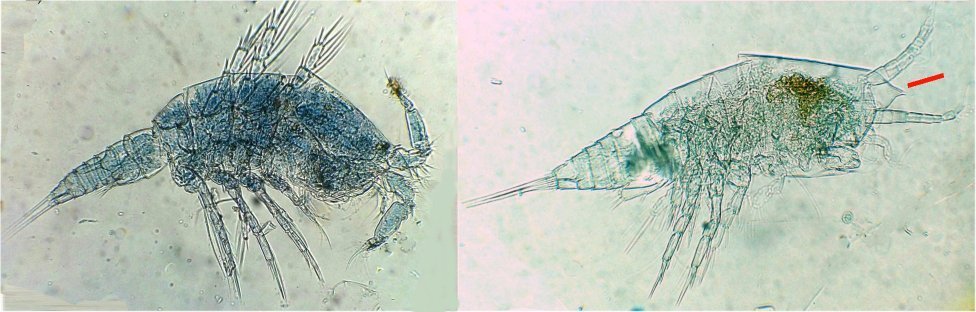
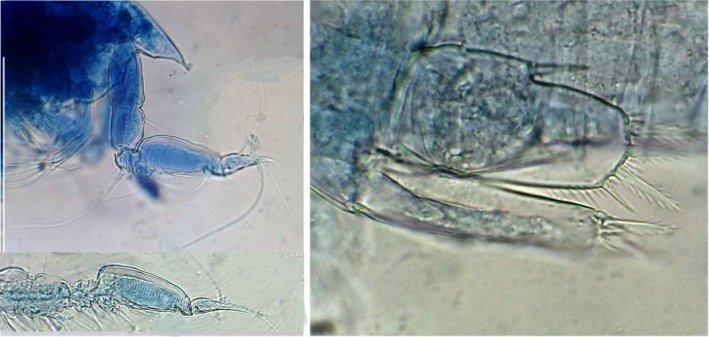
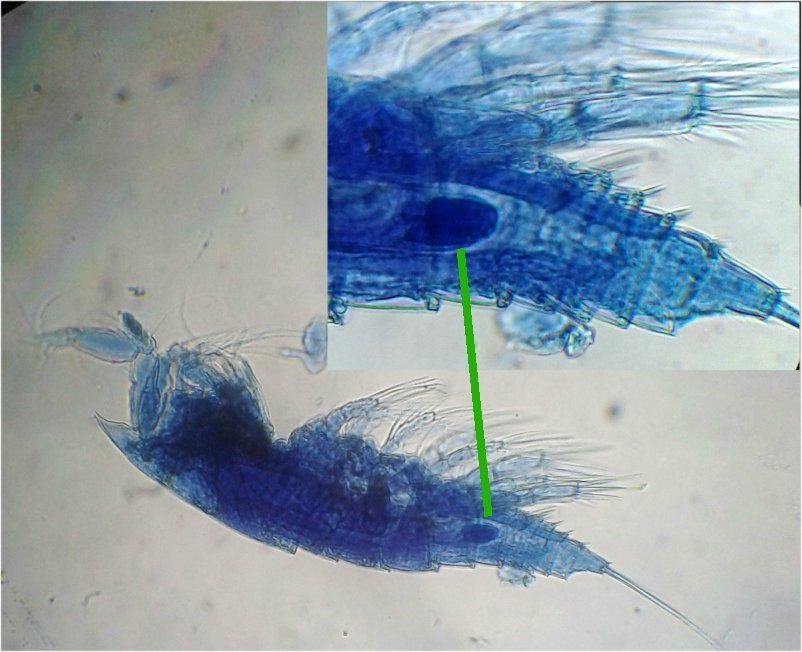
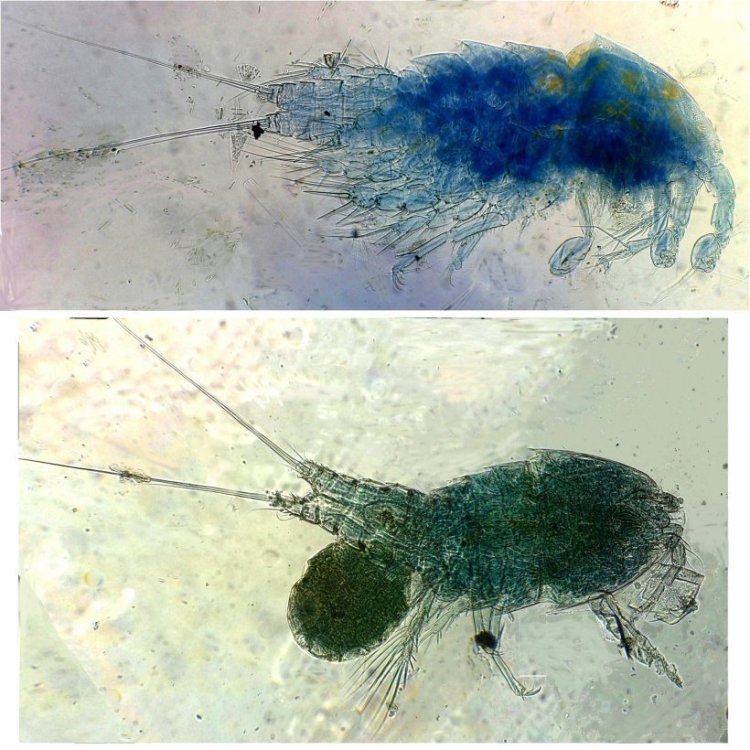
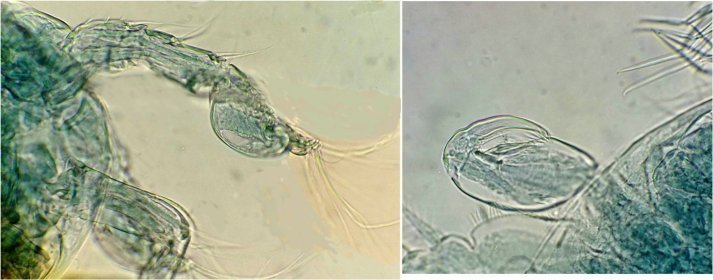
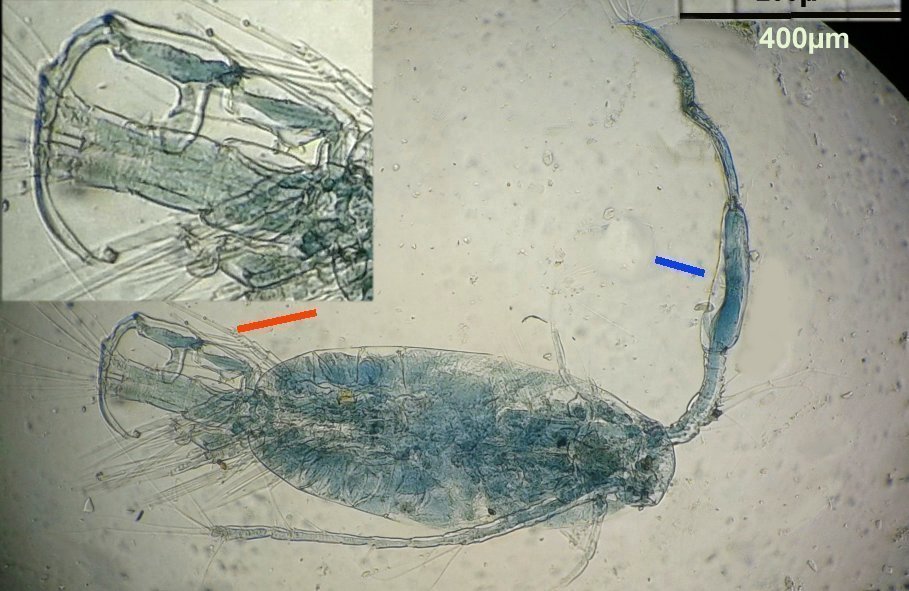
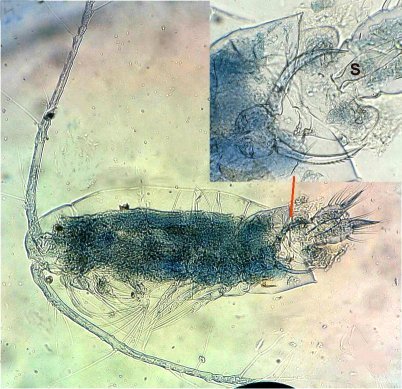
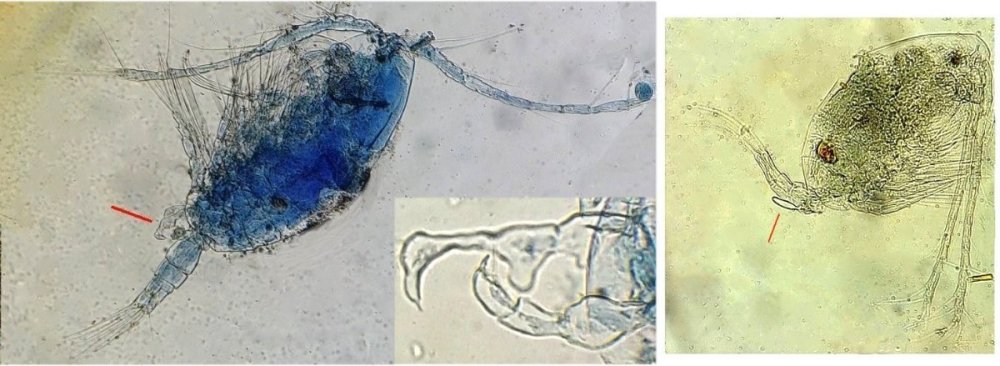
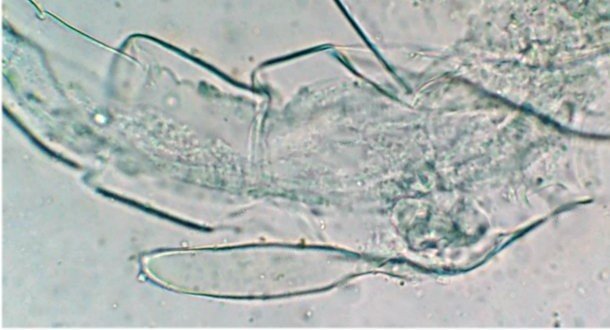
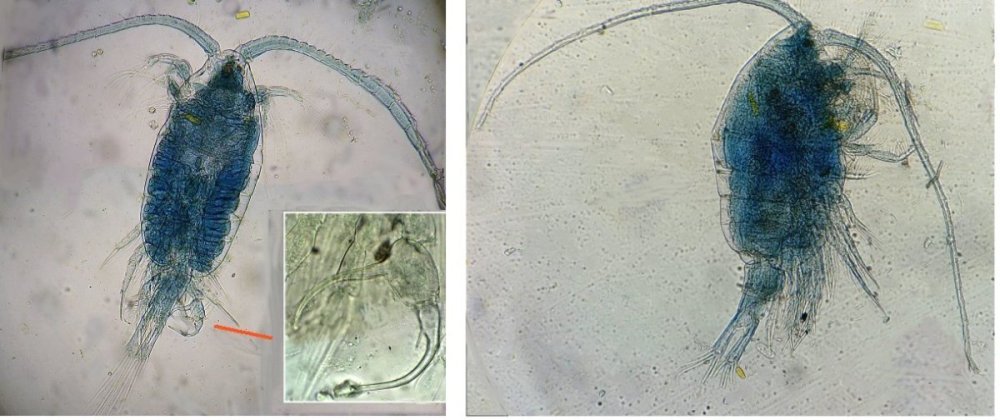
Les copépodes, sont de petits crustacés, qui constituent une grande partie du zooplancton ; ils représentent 12000 espèces où l’on distingue 10 ordres . Dans les prélèvements au filet à plancton (ici maille de 200 µm), le nombre de copépodes recueillis est très important en particulier les mois d’été. En prenant quelques précautions : conservation au frais de l’échantillon et observation rapide (entre 2 et 3 heures après prélèvement), de nombreux spécimens peuvent être observés vivants. Cependant en raison de leur nombre élevé, la concentration en oxygène baisse rapidement dans le flacon et vient ralentir leurs mouvements : il tombent au fond en constituant une « soupe » de copépodes et le prélèvement d’une seule goutte de ce dépôt ramène plus d’une dizaine de spécimens sur la lame. Dans l’image ci dessous , il faut donc diluer ! Ce grand nombre de spécimens va permettre de les figer en diverses positions et sur la quantité présente on peut trouver le mâle et la femelle . Pour les conserver : fixation au picroformol de Bouin directement sur lame, coloration par le vert de bromocrésol (pas vraiment un colorant mais un indicateur de pH) et montage à la gélatine glycérinée. J’ai ainsi réalisé plusieurs lames sur plusieurs années successives . Ceci fait je remets les reste du flacon à l’eau pour nourrir les alevins de poissons ... J’ai un peu négligé de m’intéresser plus tôt aux copépodes car je recherchais des sujets plus rares. En reprenant 6 ou 7 lames, dont certaines datent de 20 ans, j’ai pu identifier plusieurs espèces homogènes en quantité dans les échantillons. Voici quelques définitions de la morphologie des copépodes qui vont être utiles pour la suite : de plus , dans le texte, les mots repérés par « * » renvoient au lexique en fin d’article L’une des lames observées montrait un spécimen de l’ordre des calanoïdes, reconnaissables à leurs longues antennules* ; dont une des pattes de la dernière paire (P5) était largement modifiée en forme de pince : Ce dimorphisme sexuel est adapté à leur reproduction. La flèche rouge montre P5 modifiée et la flèche bleue une autre caractéristique du spécimen mâle : la présence d’une antennule géniculée* utilisée dans l’accouplement. La femelle ne possède pas d’antennule modifiée, les 2 sont identiques . P5 en forme de pince différente de celle du mâle :voici la femelle et la pince en détail : (S : spermatophore * ) Il est recommandé de lire ces liens pour voir plus en détail les modalités d’accouplement. https://forum.MikrOscOpia.com/topic/20108-reproduction-du-cop%C3%A9pode-paracartia-grani/#comment-83424 https://forum.MikrOscOpia.com/topic/20116-copépode-calanus-arcatia-arcaturia-clausi/#comment-83460 Les deux autres spécimens ci dessous sont de l espèce acartia grani (Male à gauche et femelle à droite). La pince du male est similaire à celle de pacartia grani mais semble moins sophistiquée. (détail à l’ objectif x40) La femelle n’a pas de pince à la différence de celle de paracartia on voit sur l’image à droite le spermatophore * collé sur l ‘ urosome de la femelle (flèche rouge) avec détail ci dessous à l’objectif x 40 Troisième espèce : Centropages ordre des calanoïdes aussi . La pince du male (photo de droite) est plus fine. On remarque aussi l’antennule géniculée * sur la droite du mâle une épine asymétrique sur la femelle (flèche bleue) orienterait vers centropages hamatu ; noter l’ovipore * (flèche verte) -

Ce que mangent les hirondelles...
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
suite des ailles des enveloppes céphaliques / pièces buccales Un objet inattendu qui rappellerait un œuf Sur des thèmes voisins de cette « coprologie aviaire » voir aussi : https://forum.MikrOscOpia.com/topic/17024-fiente-de-pic-vert/#comment-67569 Amitiés JMC -
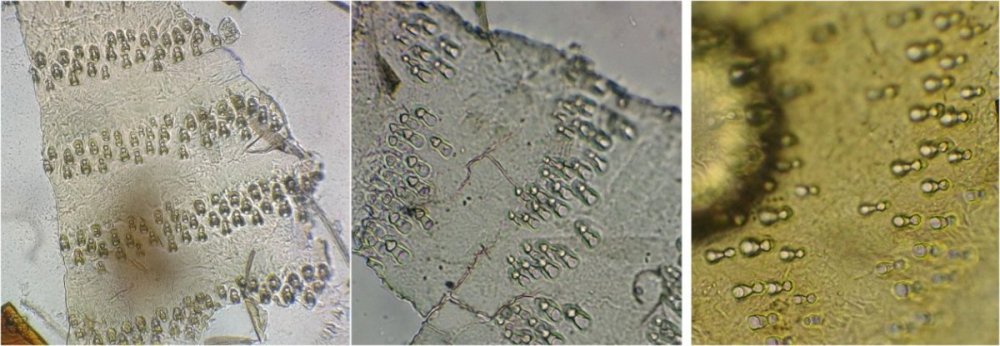
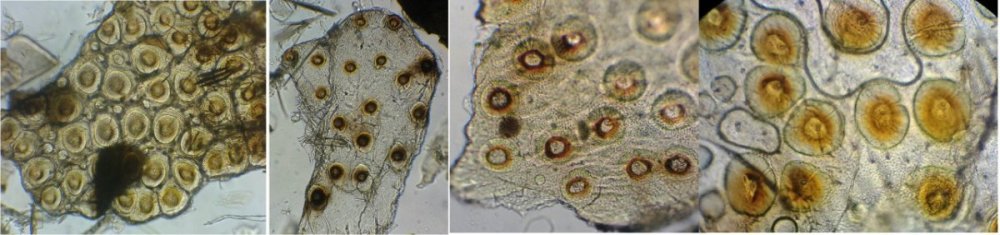
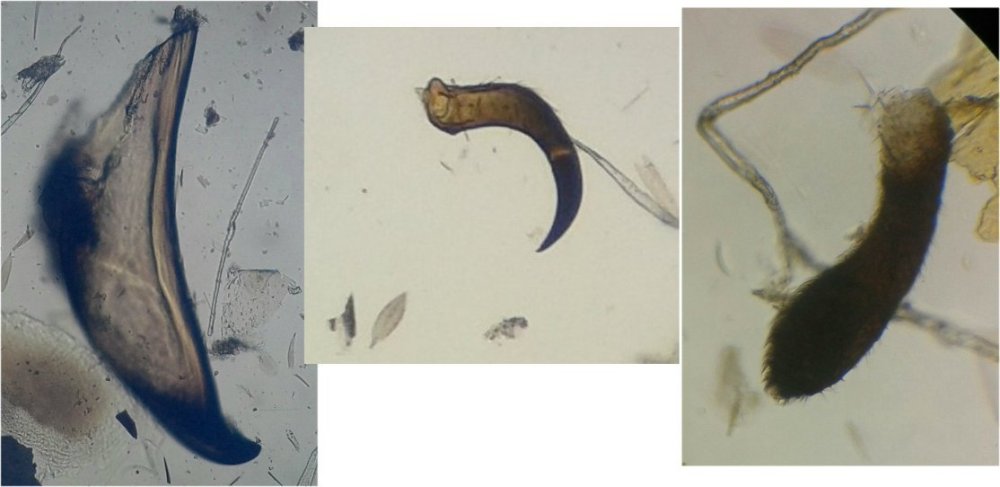
Il fait trop chaud pour aller chercher des échantillons, mais parfois ceux ci tombent littéralement du ciel ! En effet tous les matins des hirondelles tournent dans ma cour, se posent sur les fils à linge, gazouillent à tue tête, et parfois, en s’envolant, laissent un petit cadeau : Voici donc sur une feuille du figuier une fiente qui mesure environ 1,5 cm. En la diluant dans de l’eau , surtout la zone foncée, révèle un grand nombre de parties d’insectes. Sachant que les oiseaux n’ont pas de dents on peut s’interroger sur ce qui permet d’obtenir de si petits morceaux. Je pense que leur gésier doit contenir des particules de sable qui permettent la mastication. N’étant pas entomologiste pour deux sous, je ne m’avancerai pas sur l’identification des insectes ingérés, mais contrairement à ce qu’on pense ce ne sont pas que des moustiques ! Il peut être utile d’utiliser une mini goutte de liquide vaisselle pour aider à mouiller les morceaux de kératine . A défaut d’identification on peut toutefois regrouper les structures par fonctions . Sauf mention contraire les images sont faites au x 15 : Les écailles d’ailes : on remarque la présence d’écailles longues et fines provenant certainement d’ailes de moustiques mais aussi d’autres types d’écailles : Des fragments d’ailes où l’on distingue les pédicelles d’attache des écailles Voir ici : https://forum.MikrOscOpia.com/topic/19533-%C3%A9caille-des-papillons/#comment-81091 Des pattes difficiles à identifier car très morcelées des cornées faciles à reconnaître par leurs éléments hexagonaux des fragments d’épiderme ou d’élytres avec des ornementations circulaires et des poils aux centre de chacune des griffes / mandibules / palpes
-

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour à tous Jean Marc , on peut utiliser le LM338 qui va à 3 A ce qui est largement suffisant pour des Leds . Pour calculer le courant dans R1 la formule est 1,25/R1. (R1 en ohms). L'inconvénient est que toute l'intensité va passer par le rhéostat R1 qui doit tenir le coup... ça se trouve des rhéostats 2 W mais c'est un peu cher.Je préconiserait un commutateur 6 positions commutant des résistances de puissance (entre 1 et 2 w) sachant que c'est rare qu'on ait besoin d'un réglage très fin de la lumière...* Je peux faire un schéma si besoin Amitiés JMC * J'ai une alim simplifiée pour led 1 W avec 2 positions : Normal et Boost cette dernière position n'étant utilisée que pour le X 40 -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour En analogique il y a le LM338 K qui peut aller jusqu'à 5 ampères (3 A pour 338 sans K) et son montage en générateur de courant ci dessous.. On doit pouvoir remplacer R1 par un commutateur de plusieurs résistance supportant les intensités demandée; on n'a pas forcément besoin d'un réglage fin... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour vu sur ce site plusieurs types de radiateurs et même certains ventilés de petite taille . pour une LED 3 watts que l'on n'utilise pas toujours à pleine puissance cela doit suffire...Pour l'alimenter en courant continu c'est moins évident, les drivers "tout fait" sortent en courant alternatif.... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Je voudrais attirer l'attention sur le fait que ces petits modules d'alimentation ne sont pas des générateurs de courant . Une faible variation du réglage de la tension peut faire varier dans de grandes proportions le courant dans la led . voir ici https://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-LEDS-2/LEDS2.htm A défaut un fusible en série avec la LED me parait indispensable : par exemple pour LED 3 watts fusible 1,5 A, pour 10 watts 3,15 A ou 4 A etc... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Jean Luc Moi c'est Jean-Marie (pas Jean Marc ! ) Le problème principal pour la LED c'est de pouvoir la positionner à la place de l'ampoule actuelle. Bien que la LED soit plus petite , il faut aussi loger son radiateur indispensable. Pour une remplacer une ampoule de 30 w on peut estimer qu'une LED 3 W (qui consomme 1 ampère) est suffisante. Les alims pour LEDS disponibles travaillent en courant constant mais en alternatif ! Il faut concevoir une alimentation filtrée en courant continu ou utiliser une alimentation de laboratoire réglable en courant. Il faudrait avoir une photo de l'ampoule en place pour voir si la transformation (réversible) est possible Pour Neat Image le principe est de prendre un échantillon de bruit seul sur une zone unie de l'image et de faire son spectre en fréquence puis le soustraire de l'Image. Probablement en utilisant la transformée de Fourier. Mais si on peut d'emblée obtenir une bonne image le post processing est inutile. AMitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Jean Luc Vraiment intéressante ta démarche , que l'on pourrait aussi appliquer au zooplancton vivant et qui m'intéresse à ce titre !. Pour le scintillement (et les barres sur les images) la solution serait de passer en éclairage LED alimenté en courant continu filtré , il pourrait être même possible au moment de la prise de vue de suralimenter brièvement la LED pour faire un pseudo flash (comme sur les téléphones) . Pour le bruit on peut utiliser Neat image dont voici le résultat avec la version gratuite et en prenant comme échantillon un rectangle en haut à droite de l'image: Amitiés JMC -

Exploration d'un bac extérieur rempli d' eau
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique L'algue filamenteuse n'est pas une cyanobactérie... Je pense à Geminella peut être , mais je ne suis pas très riche en algues d'eau douce ! Amitiés JMC -

Population de l'estran de la plage du Havre
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique Voisin dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique Bonne initiative ! c'est intéressant de pouvoir suivre les populations au cours de l'année . On dirait que les premières images de la série sont en contraste de phase ? avec une certaine perte de résolution par rapport au fond clair me semble-t-il ... En parlant d'estran cela m'a rappelé ce site qui décrit pas mal d'espèces : https://nature22.com/estran22/estran.html Amitiés JMC -

Piles coulées
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Il me semble que les diodes laser rouges sont alimentés en 2,2 volts et environ 30 mA.. Elle sont chatouilleuses sur la régulation/limitation du courant (risque d'emballement thermique) . Démonte la platine et vois le cheminement du PCB ... peut être y a t il juste une résistance entre le laser et la pile ? A moins qu'il y ait du monde en CMS du coté cuivre ! D'ailleurs on ne voit pas d'où vient l'alimentation de cette platine... AMitiés JMC











.jpg.b10e939d859152a3e8b4e84a1184543e.jpg)