Toute l’activité
- La dernière semaine
-

tremelle_x100_z2_germination copie.jpg
Jean-Luc Bethmont (Picroformol) a posté une image de la galerie dans Galerie Mikroscopia
-

IMG_0529 copie.jpg
Jean-Luc Bethmont (Picroformol) a posté une image de la galerie dans Galerie Mikroscopia
-
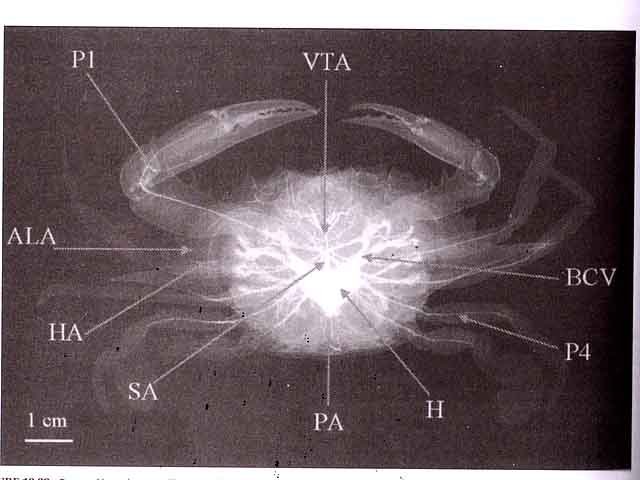
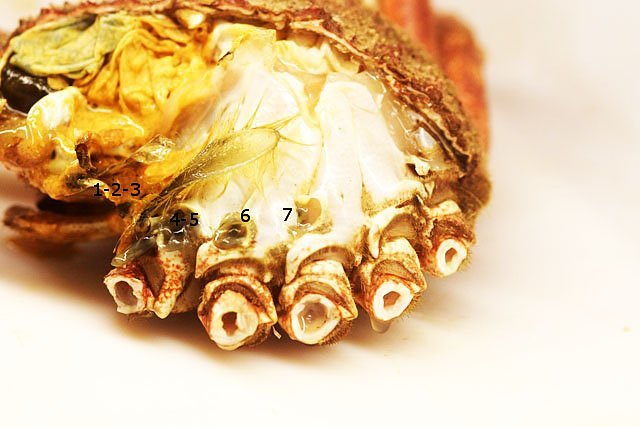
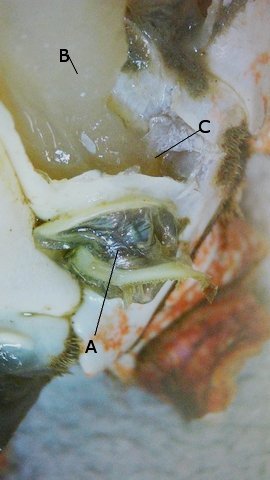
Crabe échanges gazeux dans les branchies . Dans le premier article le cœur du crabe a été décrit - dans le second article été exposé le système branchial du point de vue anatomique ,dans le troisième l’ organisation cellulaire a été présentée . Il reste à étudier la physiologie. Il avait été remarqué qu' étant donné la faiblesse du muscle cardiaque ll ne pouvait pas assuré la circulation jusqu' aux bouts des pattes Donc il doit exister un autre système de propulsion. Le système de la circulation n’ est pas semblable à celui des mammifères : la succession cœur artères artérioles capillaires organes périphériques et retour dans par le système veineux veinule - veine et grosses veines de drainage ramenant le sang vers la cœur. Chez le crabe l’organisation est différente puisque ‘il s’agit d’un système ouvert - sans présence de capillaire. Les artères dirigent le sang vers les organes périphériques et s’ ouvrent près des organes à irriguer dans l’ hémocœle (qui est la cavité interne contenant l'hémolymphe dans laquelle baignent les organes de l'organisme ). Image du système circulatoire après injection dans la cavité péricardique de sulfate de baryum . PA Posterieur aorta – VTA ventral thoracic artery – ALA Anterior latérale artéries – BCV bronchopericadia veins – H heart – HA hepatic arteries – P1 chelipéde arteries – P4 pereopod 4 artery – PA Posterieur aorta – DA sternal artery – VTA ventral thoracic artery. Sur cette photo on constate que l’irrigation du système branchial n’apparaît pas à hauteur des branchies . Pourquoi ? Pour répondre à cette question reprenons les éléments anatomiques : Côté branchies les deux vaisseaux sont bouchés à leur extrémité distale .: Base de la branchie : A-- zone de collection et d’expulsion de l’hemolymphe. vers le manchon de liaison. Les vaisseaux de la face antérieure et postérieure d’ un élément branchique se jettent dans le même endroit à la base dans un organe en forme de manchon qui va se fixer sur le massif .« cartilagineux » et penetrer dans l’hémocœle et transférer l’ hemolymphe... Image de ce massif de séparation eau de mer/hemolymphe: I La logette des muscles des branchies 1-2-3 n’ est pas visible ( ce sont les muscles qui servent à la mise en fonction des scaphognathites de la bouche). les logettes suivantes: la 1ère patte branchies 4 et 5 qui ont un manchon de raccordement commun. la 2 éme patte branchie 6 . La 3 éme patte branchie 7 .. La 4 et 5 éme patte n' ont pas de branchie associée. Si on ouvre les logettes la masse musculaire le contenu est mise en évidence: A -- Paroi osseuse formant la logette contenant le muscle. B—Muscle tracteur de la partir initiale des pattes (Coxa) . L’examen de la base de ces logettes musculaires met en évidence la présence, ( si le muscle est relâché) d’une cavité qui devient virtuelle si le muscle se contracte. A – Chemise de communication imperméable .Entre les systèmes contenant l' eau de mer ( chambre branchiale ) et le système contenant l' hemolymphe (l l’hémocœle ). il ne doit pas y avoir de communication - Donc pour passer des vaisseaux branchiaux vers l' l’hémocœle la communication doit être etanche - ce qu 'assure ce manchon . B—Muscle tracteur de la partir initiale des pattes (Coxa) et par sa position propulseur de l' hemolymphe . B -- Paroi osseuse formant la logette contenant le muscle. Il existe donc entre l’arrivée de l’hemolymphe ( A ) venant des vaisseaux des branchies et ' hemolymphe contenue dans l’hémocœle une cavite limitée par le muscle ( B ) et la paroi ( C ) . Cette cavité va se relâcher et se rétrécir en fonction des contractions du muscle . Elle a le même rôle qu’un ventricule dans le cœur des mammifères. Les vaisseaux branchiques vont donc avoir un courant qui s’inverse à chaque contraction du muscle ( un peu comme notre respiration mais ici du côté hemolymphe). En conclusion : Le circuit de l’ hemolymphe se fait vers la périphérie grâce au cœur et vers la zone centrale ( une fois oxygénée) grâce aux pompes musculaires périphériques Il y a ainsi 7 cœurs périphériques de chaque côté du crabe – Cela fait que l’efficacité de ce système est proportionnée aux efforts du crabe: Au repos les branchies 1 2 et 3 sont dépendantes du mouvement des 2 scaphognathites Quand le crabe est dans l’ eau on note que ces deux organes sont toujours en mouvements Il a deux rôles d’abord mettre en activité les branches rameuses qui modifient le flux de l’ eau de mer dans la cavité brachiale et ensuite parce qu’ils font marcher les pompes musculaire permettre l’oxygénation permanente du milieu intérieur . Les 4 autres branchies sont asservies au mouvement des 3 pattes antérieures d’où une augmentation de l oxygénation de ‘ hemolymphe au moment des déplacements à l’instant où il y en a besoin. ******************************* Pour la petite histoire le même système existe chez l’ homme - Pour un homme debout le cœur n’ a pas assez de force pour faire remonter le sang des pieds et des jambes - Pour corriger cette défaillance il existe sous les pieds une sole veineuse importante qui permet de remonter ce sang au cours de la marche. La station immobile prolongée va déclencher l’ apparition d’un œdème des jambes :le sang arrive bien et ne pouvant repartir avec le même débit le plasma sort de la veine et fait gonfler les tissus. Retour veineux Le système veineux est un système ouvert directement dans la cavité de l’hémocœle . - par des orifices nommés sinus -L’ ensemble de l’ hemolymphe collectée oxygénée ou non va utiliser les veines Brachipericardiaques .Elles vont ramener l' hemolymphe dans la cavité pericardique puis la dirigé vers le coeur y pénétrant par les ostiums latérales. Résumé L hemolymphe est mise en mouvement dans l l’hémocœle ’ par le cœur qui le pompe par ses ostioles latérales à partir de la cavité péricardique . Cette hemolymphe est répartie aux divers organes grâce au système artériel Par ailleurs l’activité musculaire a deux rôles --créer un courant interne de brassage . --créer le moteur du flux /reflux dans le systéme branchique . L hemolymphe quitte l’hémocœle .grâce aux sinus veineux pericardiques puis collectée par les veines Brachipericardiaques qui se jettent dans la cavité pericardique. Et le cycle recommence …… Article réalisé avec le microscope à écran Tomlov Référence photo La photo est extraite de Invetebrate Zoology de Edward E Rppert –Richard S Fox – RobertD Barnes Dominique
- Avant
-
Tryphon T a commencé à suivre Molluscum pendulum Acrochordon et Crabe Branchies histologie
-
Bonsoir Thyphon Merci pour tes remarques en encourageantes - La dernière partie est en cours de realisation et curieusement je ne trouve pas de littérature confirmant mes constatations mais je ne pense pas me tromper . A bientôt Amicalement Dominique
-
Bonjour Dominique, La Vie déploie des merveilles de technologie et tu nous présente cela de manière tout aussi merveilleuse. Chapeau l'artiste ! Amicalement.
-
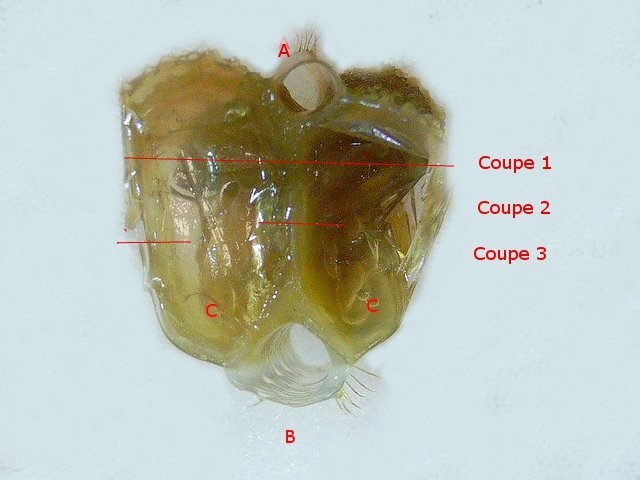
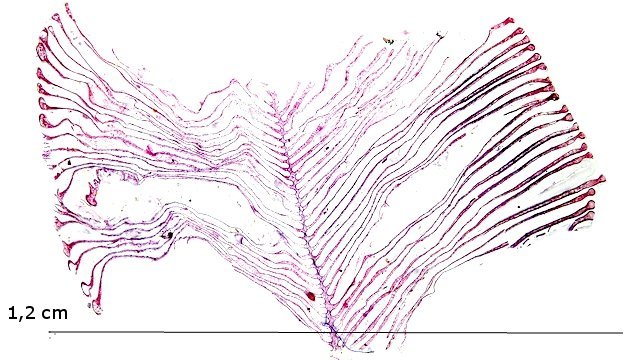
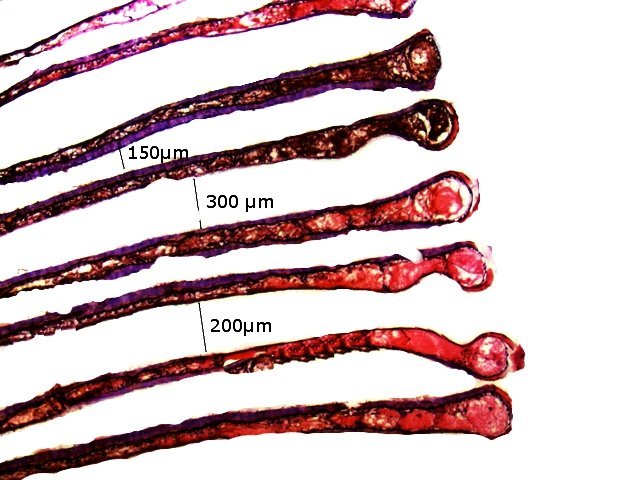
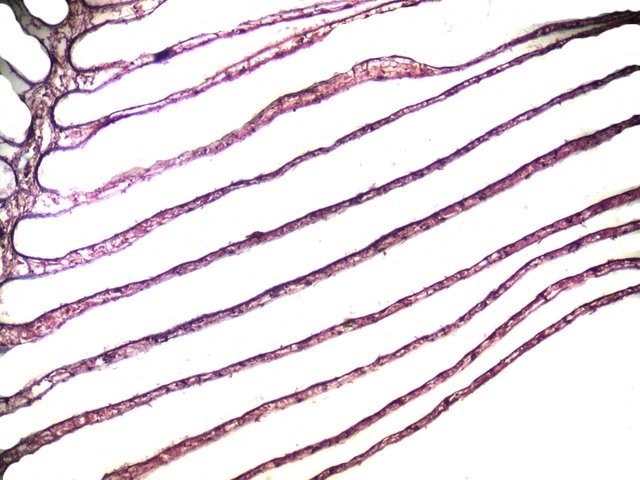
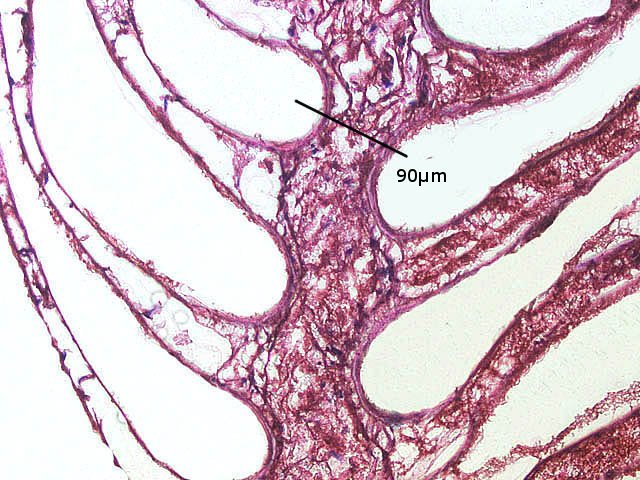
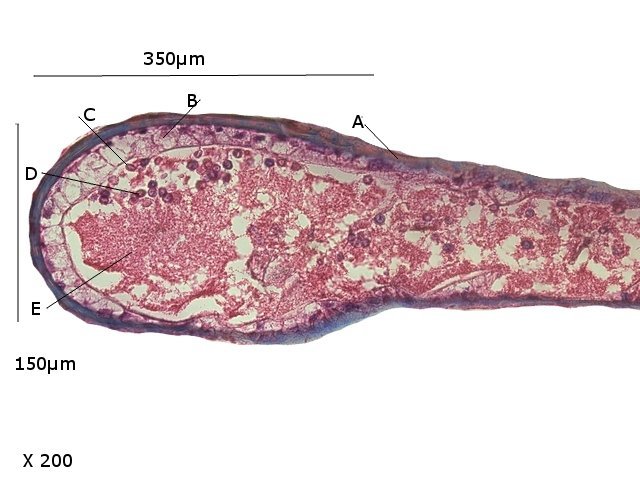
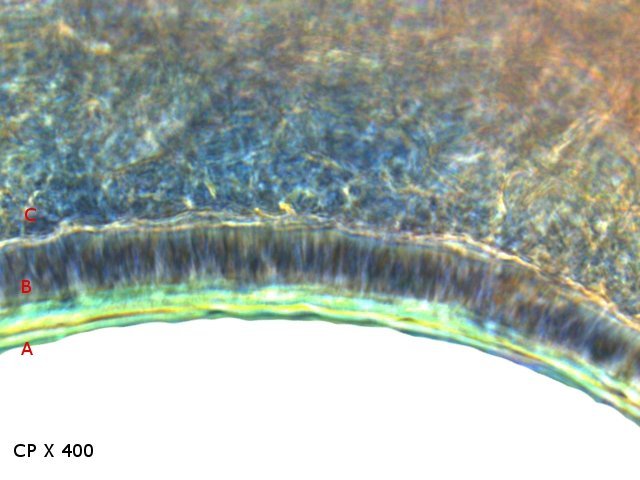
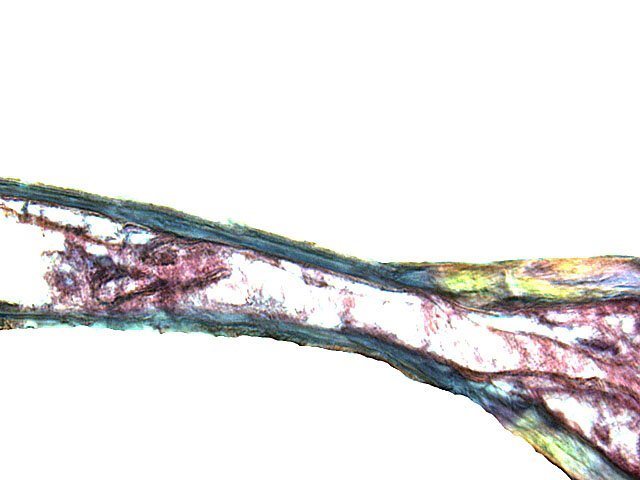
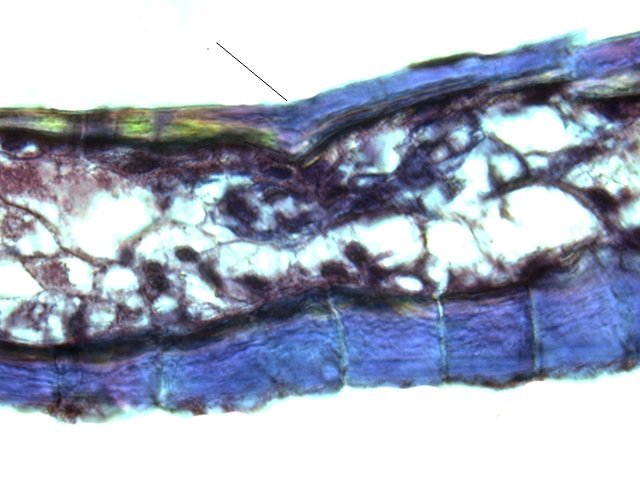
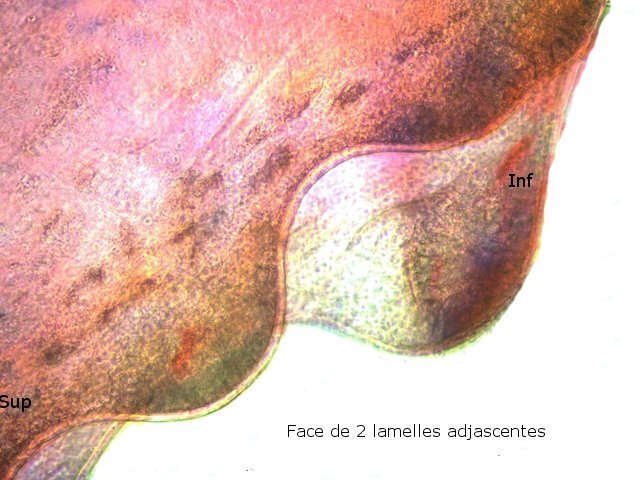
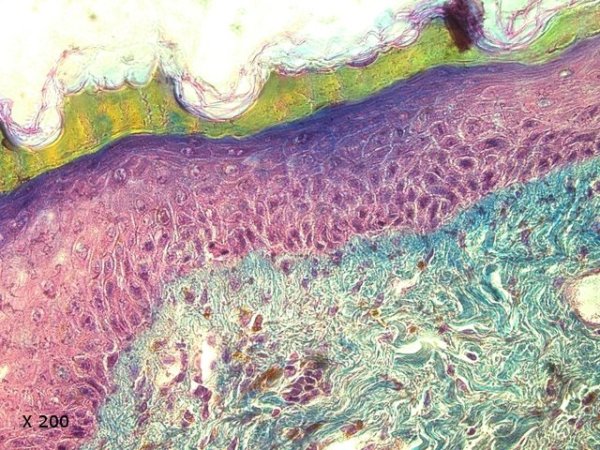
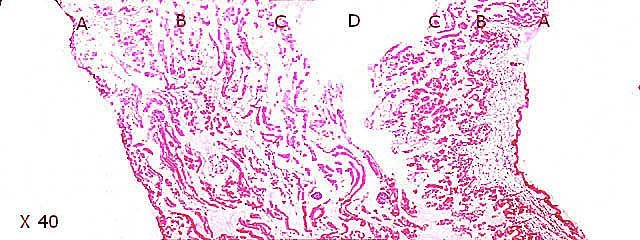
Crabe Branchies Histologie Le premier article nous a fait découvrir l’organisation du massif branchiale et des éléments de ce massif .Il est intéressant de découvrir l’organisation cellulaire de cet organe . Une branchie est organisée par l’assemblage de deux demies lamelles sur un axe médian ;avec la présence d’un vaisseau collecteur sur les deux faces de l’ empilement . Ces colonnes qui forment les branchies sont constituées par l’ entassement d’ une centaine de lamelles –Chaque lamelle est divisée en deux par la présence d’une paroi collectrice de l’ hemolymphe . Coupe suivant le trait 1 ( Coloration trichrome de Masson ): Partie médiane Coupe partie médiane : L’ insertion des deux moitiés de lamelle se fait en alternance. L’ hemolymphe oxygénée au travers de la paroi des lamelles est donc collectée par un canal central qui se vide dans l’hémocœle puis les deux veines périphériques bronchopéricardiaque et leur systéme collecteur. Ce n’est pas un circuit fermé Coupe extrémité distale A Couche de mucus protecteur B Couche faite de cellules pavimenteuses cubiques formant une seule couche cellulaire C Membrane basale D Hemocytes E Protéines coagulées de l ‘hémolymphe La paroi des lamelles Vue de dessus de deux lamelles voisines. Cette paroi est caractérisée par une différence de constitution de la paroi suivant la localisation ( coloration bleu de Toluidine ) En périphérie - donc au contact direct avec le courant d’ eau de mer il existe un épithélium monocouche cubique épais.. Coloration au Bleu de toluidine En utilisant le contraste de phase il est mis en évidence : Par contre dans la partie centrale des lamelles, ce qui représente la majeure partie de la surface d’ échange, la couche cellulaire est faite de cellules très aplaties Elle est organisée en une couche de mucus externe et une membrane basale interne séparant les deux milieux. Cette zone se caractérise par une protection vis-à-vis du flux de l’ eau de mer régnant dans la cavité branchiale c’est-à-dire une circulation plus calme qui va permettre des échanges gazeux tranquilles . Dans ce cas l’espace entre l’eau de mer et l’ hemolymphe est inférieur à 5 µm : la diffusion est donc extrêmement facile. ******************************************************************************************************************* Comment se font les échanges gazeux ? On vient de voir que la paroi des lamelles est d’une très grande finesse puisqu’ elle n’ est faite d’ une couche cellulaire 2. Mécanisme des échanges gazeux L’eau, riche en O₂ dissous, passe entre les lamelles. L’O₂ diffuse passivement (sans dépense d’énergie) à travers cette fine paroi des lamelles, depuis l’eau (où sa concentration est élevée) vers l’ hemolymphe (où sa concentration est plus faible). b. Élimination du dioxyde de carbone (CO₂) L’ hémolymphe arrive aux lamelles chargé en CO₂, produit du métabolisme cellulaire. Le CO₂ diffuse passivement vers l’eau (où sa concentration est plus faible). Une fois dans l’eau, le CO₂ est évacué vers l’extérieur. La diffusion est passive : L’O₂ et le CO₂ traversent la membrane des lamelles branchiales uniquement grâce à un gradiant de concentration (de la zone à haute concentration vers la zone à basse concentration). Pas de réaction chimique : Il n’y a pas de transformation moléculaire de l’O₂ ou du CO₂ lors de leur passage à travers la membrane, donc pas besoin d’enzymes pour catalyser une réaction. Chez les décapodes (crabes, crevettes, homards, etc.), les échanges gazeux se font sans globules rouges ni hémoglobine libre dans le sang (appelé hémolymphe), mais avec des mécanismes biochimiques adaptés à leur physiologie. 1. Transport de l’oxygène (O₂) dans l’hémolymphe a. Pigment respiratoire : l’hémocyanine L hemocyanine est , une protéine respiratoire bleutée (car elle contient du cuivre, et non du fer comme l’hémoglobine) : L’hémocyanine se lie à l’O₂ de manière réversible, selon la pression partielle en O₂ (pO₂). L’hémocyanine est dissoute directement dans l’hémolymphe (elle n’est pas enfermée dans des cellules comme l’hémoglobine). b. Mécanisme de fixation de l’O₂ À haute pO₂ (au niveau des branchies) : L’hémocyanine fixe l’O₂. À basse pO₂ (au niveau des tissus) : L’hémocyanine libère l’O₂. 2. Transport du dioxyde de carbone (CO₂) a. Dissolution directe Une partie du CO₂ est simplement dissout dans l’hémolymphe. b. Formation de bicarbonate (HCO₃⁻) Le CO₂ réagit avec l’eau pour former de l’acide carbonique (H₂CO₃), qui se dissocie en bicarbonate (HCO₃⁻) et protons (H⁺). Pas d’anhydrase carbonique dans l’hémolymphe (:L'anhydrase carbonique est une enzyme qui transforme le CO2 en H2CO3 et inversement). Contrairement aux vertébrés, les décapodes n’ont pas (ou très peu) d’anhydrase carbonique dans leur hémolymphe, donc cette réaction est plus lente et moins efficace. c. Tamponnement L’hémolymphe contient des ions bicarbonate et carbonate qui aident à tamponner le pH, limitant les variations acido-basiques liées au transport du CO₂. 4. Adaptations spécifiques des décapodes La capacité de transport d’O₂ est limitée : L’hémocyanine transporte moins d’O₂ que l’hémoglobine, ce qui limite l’activité métabolique des décapodes par rapport aux vertébrés. Sensibilité à la température et au pH : L’affinité de l’hémocyanine pour l’O₂ est très sensible aux variations de température et de pH, ce qui peut affecter la respiration en cas de stress environnemental. Autres fonctions des branchies Le métabolisme de l’organisme du crabe produit de l’ ammoniaque ou des ions ’ ammonium (NH4+ ) Cette molécule chez le crabe est excrétée au-travers de la paroi des branchies par diffusion passive ( vers l’ eau de mer en raison du gradient osmotique ) Le milieu biologique du crabe est iso osmotique avec l’eau de mer ;- les branchies assurent aussi le maintien de cet équilibre associé au système rénal Ref Invertebrate Zoology Edward E Ruppert – Richard S Fox – Robert D Barnes. Dans la troisième partie nous essayerons de comprendre comment se fait le mouvement de l’ hémolymphe Dominique
-

Système branchial du crabe (Araignée de mer) 1
Tryphon T a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique, Pardon, j'étais dans les choux ! Heureusement cela commence à aller mieux. Un article malheureusement sans succès, mais qui fera date dans le forum ! Probablement un des meilleurs articles! Chaleureuses félicitations et admiration totale. Amicalement. -
cloportinette_a_trotinette a rejoint la communauté
-
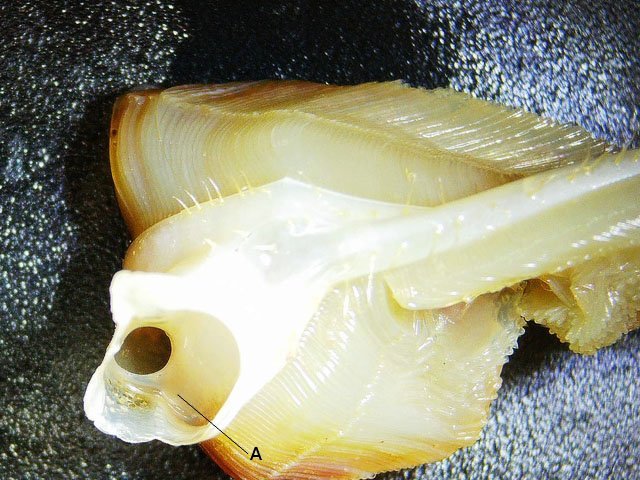
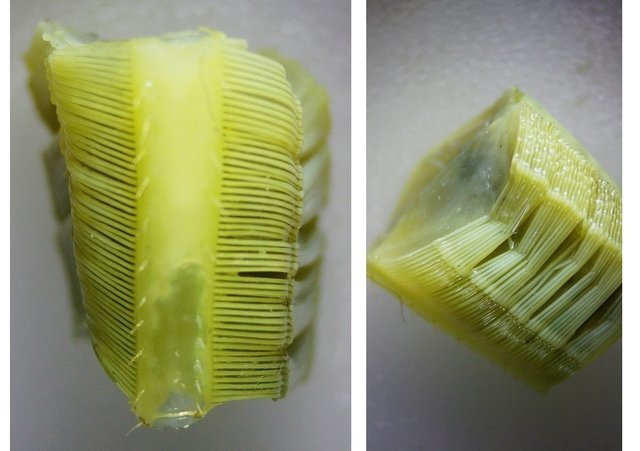
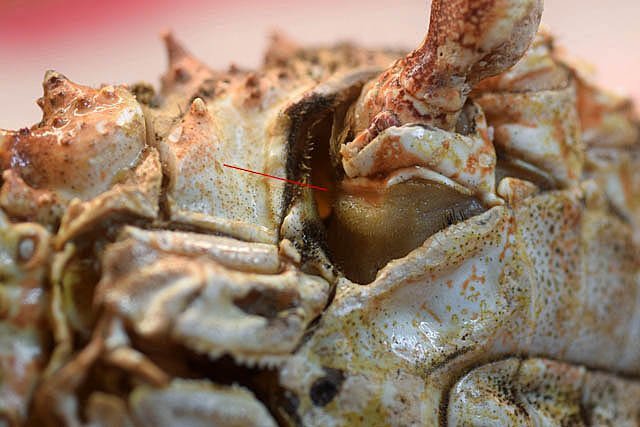
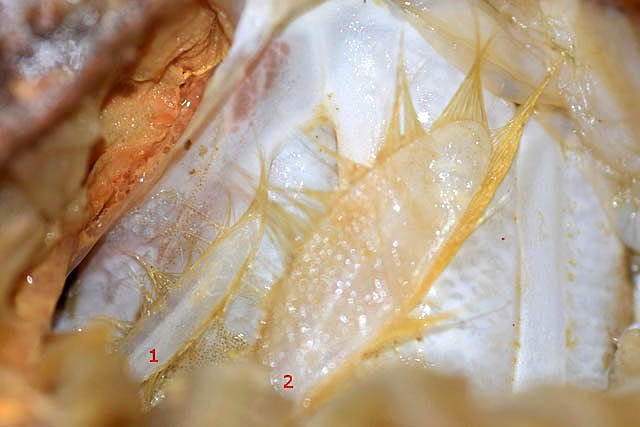
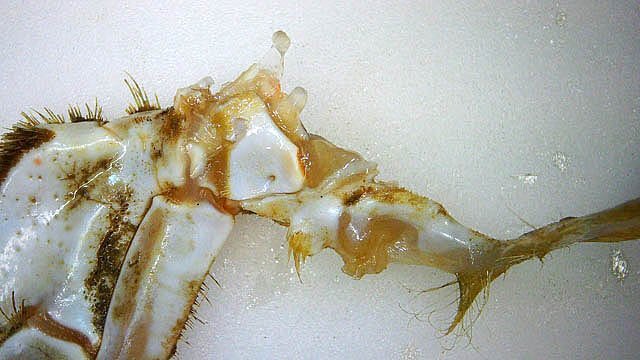
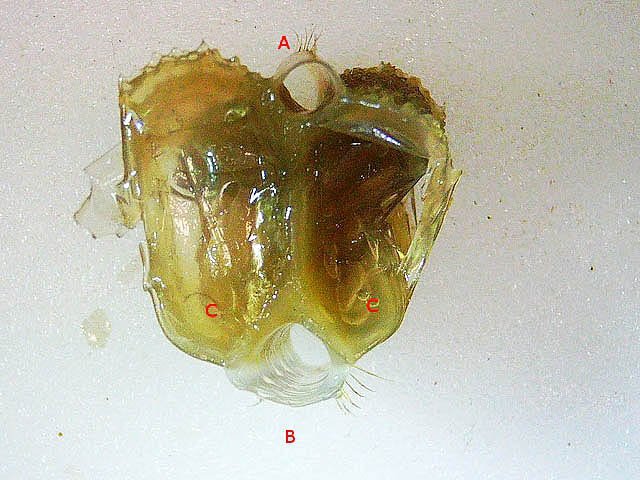
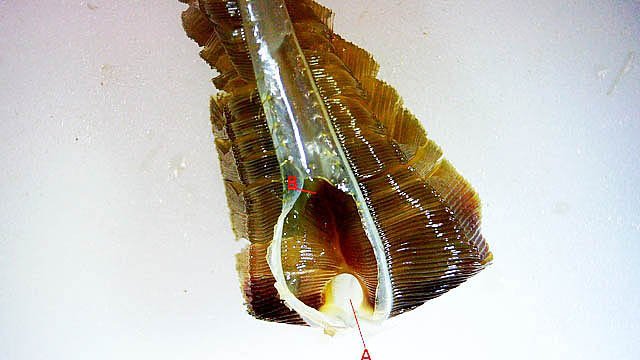
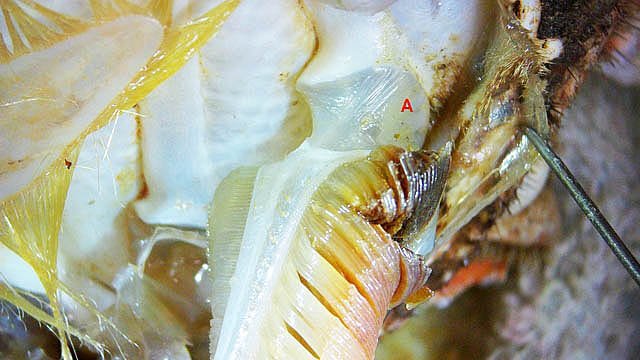
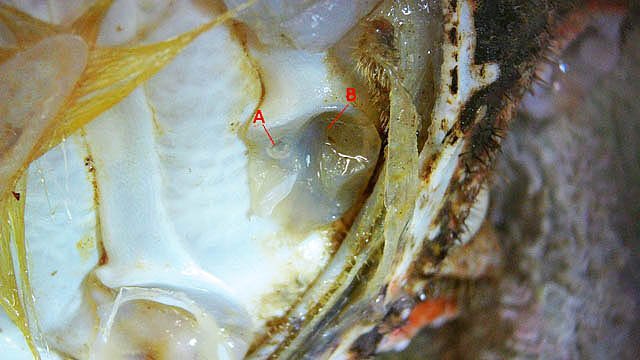
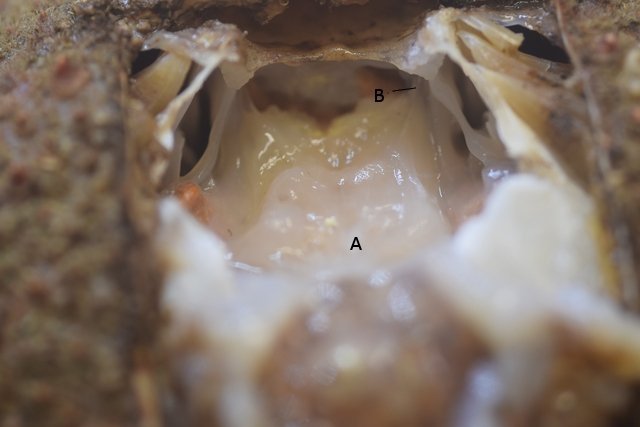
Système branchial du crabe (Araignée de mer) 1 Dans un premier article ont été présentés le cœur et le système vasculaire de l’ Araignée de mer .Dans les trois articles qui vont suivre on va essayer de comprendre 1 -l’ organisation anatomique du système branchial 2 l’ aspect histologique de ce système et dans 3 l’organisation de la répartition de l’hémolymphe oxygénée à travers le corps de ce crabe et en particulier l’ oxygénation des muscles des pattes sachant que le cœur tel qu’ il a été présenté n’ a pas la force de propulsion nécessaire pour cette fonction Cet article est illustré par le microscope à écran Tomlov Première partie - Anatomie du système branchial Arrivée de l’eau de mer -L’orifice d’entrée est assez vaste 1 cm x0,5 mm Cette arrivée est cachée à un examen rapide ; - il est nécessaire de pousser en arrière la première patte pour la découvrir . L’ eau de mer doit être isolée de l’ hémolymphe ; Il existe donc une cavité branchiale .La cavité branchiale est vaste 6 cm x7cm x 2cm.Cette cavité ( qui est bilatérale et située derrière la face latérale de la carapace est limitée par une membrane transparente très résistante qui est fixée sur les limites périphériques ( exosquelette ) et les limites du squelette interne. La carapace est enlevée ce qui permet de dégager le manteau dont le rôle est la synthèse de la carapace : Le manteau est enlevé -En dessous la membrane de la cavité branchiale est bien visible. Cette membrane limitant la cavité branchiale ; se soude sur les bords du squelette interne et sur la face interne de la carapace de manière totalement imperméable . Si cette membrane est enlevée les arcs branchiaux sont bien visibles - Ils sont au nombre de 7 leur taille est variable le plus grand fait 6 cm de haut et 1 cm de large à leur base. Sur la face antérieure du massif branchial existe des structures riches en poils qui font à la fois jouer le rôle de brosse et de mise en mouvement de l’ eau de mer. Sur la face antérieure du massif branchial il existe une formation rameuse importante. Les lames 1 et 2 sont elles situées sur la face postérieure du massif branchial - La plus grande est animée d’un mouvement d’essuie-glace Ce mouvement provient des scaphognathites qui sont des exopodites du deuxième maxille des crustacés, jouant un rôle crucial dans la respiration en agitant l'eau dans les compartiments branchiaux. ( ce mouvement constant est bien visible si le crabe est vu dans un aquarium ) . A partie visible située en avant de la bouche // B partie invisible située dans la cavité branchique. Détail sur l' organisation . Les Branchies Elles sont au nombre de 7 pour chaque massif branchial ( massif droit et massif gauche ) Chaque élément est de forme triangulaire . et apparaît comme un empilement de lamelles Sur l’ axe médian de cette structure courre un gros vaisseau bien visible Face anterieure : A Le vaisseau va de l’ extrémité distale vers la base et se courbe vers le réservoir récepteur B Nombreuses bulles d’ oxygéne Les deux vaisseaux ne forment pas un circuit avec une anastomose à leur sommet. les deux vaisseaux sont séparés à leur extrémité distale Les deux vaisseaux se jettent dans la même structure située à la base B Vaisseau postérieur C Surface d une des lamelles – chaque structure branchiale est constituée de l’empilement de centaines de lamelles. ( voir présentation histologique ). A arrivée des vaisseaux antérieurs et B arrivée du vaisseau postérieur Ce réservoir inferieur est fixé sur un passage qui conduit vers la partie interne du crabe Cette partie interne où sont réunis tous les organes ne contient pas d’eau de mer mais de l hemolymphe . A Manchon isolant de tout échange entre la cavité branchique et la cavité péricardique ( voir article sur le cœur ) qui contient l’ hémolymphe. Si on ouvre ce manchon : A Passage vasculaire correspondant au drainage de la branchie ( on remarquera qu il n’ y a qu’ un vaisseau par branchie ) et non deux ce qui aurait été le signe d’un mouvement circulaire de l’ hemolymphe ) B Membrane imperméable qui sépare la cavité branchiale de la cavité péricardique et qui maintient la branchie fixée à sa base. Une fois l’échange oxygène /gaz carbonique l’eau doit ressortir Si l’entrée a été facile à trouver la sortie est beaucoup plus cachée Elle est située en profondeur derrière les scaphognatites de la zone buccale à la base des deux dents. ( la sonde montre le trajet). Cette sortie est de la même taille ,à la base de la carapace que l’entrée soit 1cm X 0,7 cm Elle se situe en arrière du système buccal -Cette position est extrêmement avantageuse – -- elle empêche la pénétration de restes alimentaires dans la cavité branchique - -- elle lave le système buccal et les scaphognathites La seconde partie va présenter l’ aspect histologique de cette organisation La troisiéme va essayer de répondre aux questions du mécanisme de fonctionnement de ce système A- Irrigation des branchies puisque les vaisseaux ne font pas de circuit B Irrigation de pattes jusqu’ à leur extrémité distale puisque vu la taille du cœur il lui est impossible de jouer un rôle propulseur .assez puissant A suivre Dominique
-

molluscum pendullum coupe histologique
Dominique. a posté une image de la galerie dans Galerie Mikroscopia
-
Bonjour, Type de moteurs Pas à Pas ayant servi à un proto de microscope. En haut deux actionneurs de lamelles porte frottis en hématologie. Amicalement
-
Bonsoir Tryphon Jean - luc Tous Merci pour vos avis . Le sujet a été difficile à réaliser à cause des difficultés pour obtenir une bonne imprégnation de paraffine et obtenir des coupes correctes. Comme j' ai trouvé ,,après bien des tentatives, la bonne technique je vais en profiter pour faire l' étude des branchies - Ce sujet a déjà été traité pour plusieurs animaux - mais l' histologie comparative est toujours très interessante. A bientôt Amicalement Dominique
-

Crabe - cœur - anatomie histologie
Jean-Luc Bethmont (Picroformol) a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique, Bravo pour cette superbe présentation qui a dû de demander pas mal de temps ! cordialement, JL -
Opération à crabe ouvert !
-
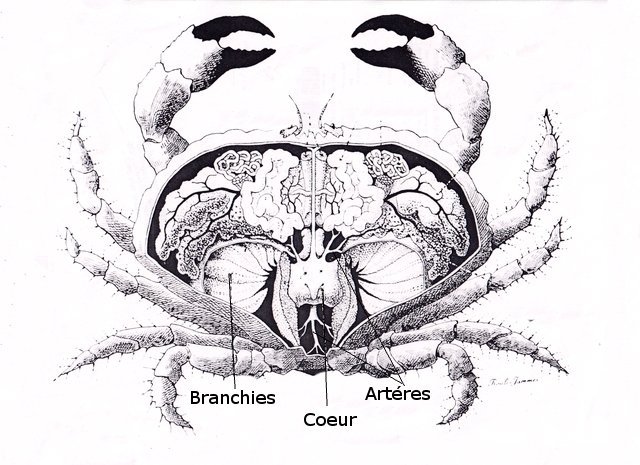
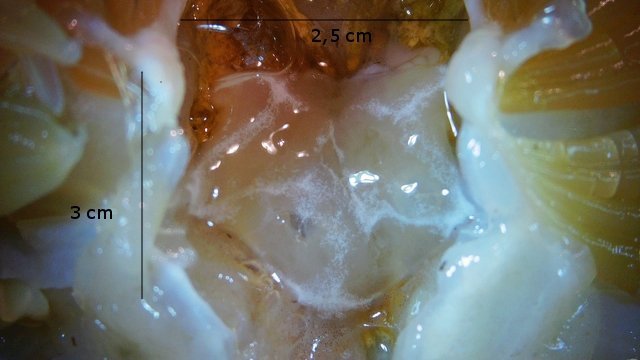
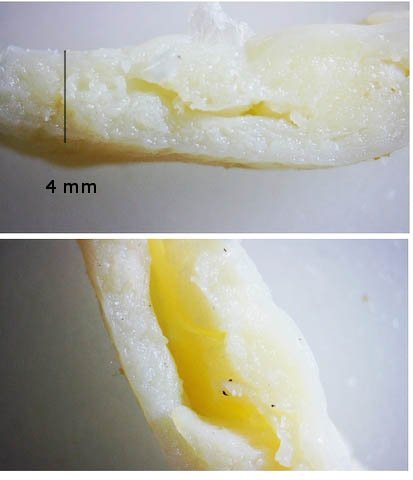
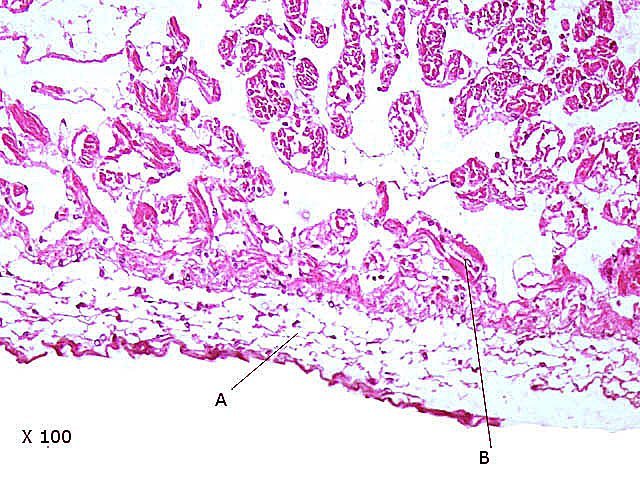
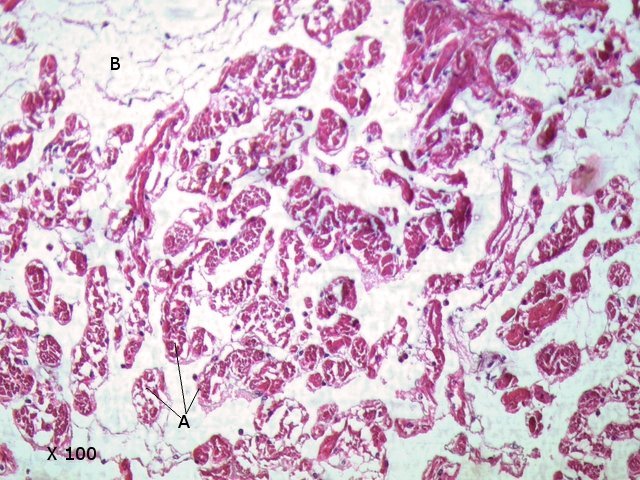
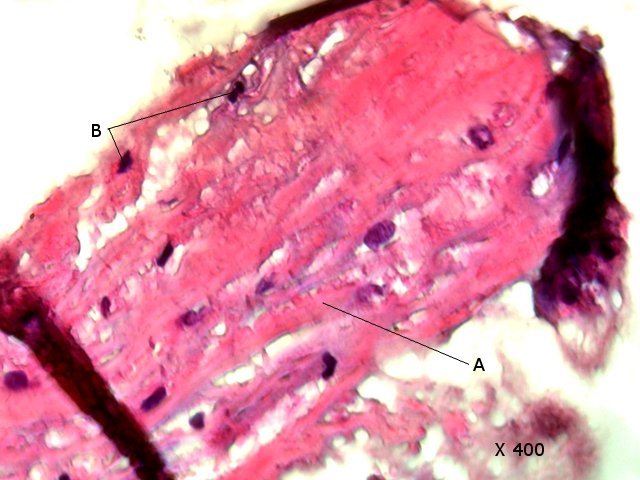
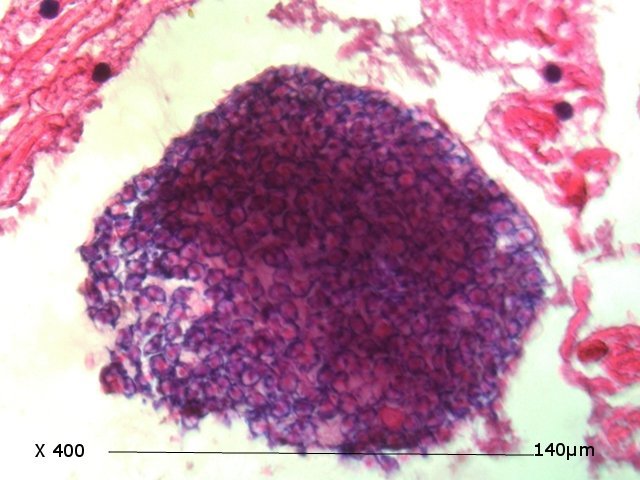
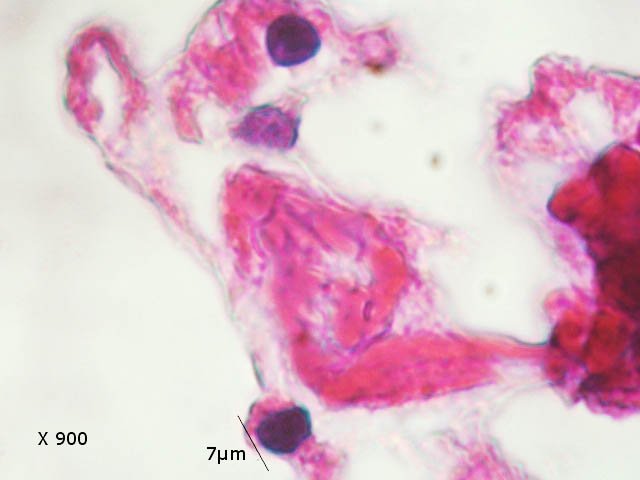
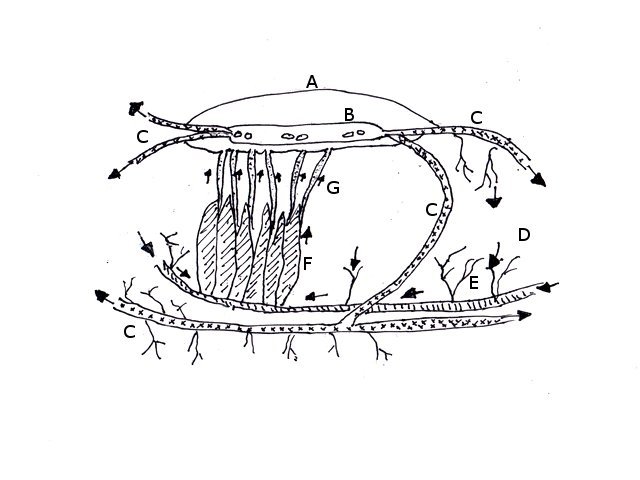
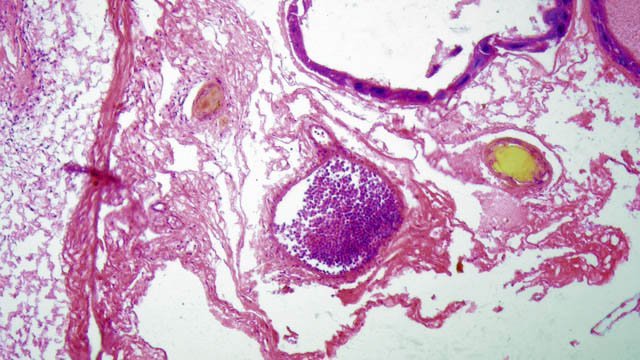
Crabe - cœur - anatomie histologie Comment s’organise la circulation dans un crabe - dans le cas qui nous intéresse une araignée de mer. - Pour mettre en évidence le cœur sans rien abîmer il est nécessaire de suivre le protocole suivant : – La carapace est enlevée doucement après avoir réalisé un volet dans la zone postéro-médiane grâce à une scie circulaire ( une Dremel ) bien connue des maquettistes. Sous la carapace il existe un épais tissu La couche supérieure, visible ici est le lieu de synthèse de la carapace La totalité de ce tissu forme un manteau de protection pour les organes sous-jacents . --Avec un bistouri une incision est réalisée sur les 3 côtés supérieurs. On récline alors le manteau doucement vers l’ arrière - La face inférieure de ce manteau correspond au toit de la vaste cavité péricardique . A -Le péricarde étant ouvert le cœur apparaît dans sa totalité chez les crabes mâles du moins en effet chez les femelles les ovaires sous la forme de deux long tubes de couleur rouge sont tellement développés qu’ils envahissent tout l’ espace supérieur rendant les résultats très aléatoires . B - Sur cette dissection certains vaisseaux sont visibles La dissection des différents organes se révèle particulièrement difficile et on ne peut qu’être admiratif du travail des anciens auteurs Le cœur apparaît comme une structure grossièrement rectangulaire et assez plate 3 cm sur 2,5cm et 5 mm d’ épaisseur. Pour se fixer les idées il est intéressant de prendre connaissance d’un schéma devenu classique : Coupe sans préparation du cœur . Le cœur est constitué d’une seule cavité (Ventricule unique) (Ce cœur ne fait que 4/5 mm d’ épaisseur. Il s’agit d’un sac contractile qui permet de mettre l’hémolymphe en mouvement - cet hémolymphe baigne tous les organes. Le remplissage se fait par des orifices latéraux : les ostioles Les artères partent du cœur vers la périphérie ,Elles sont ouvertes à leur extrémités et se vident dans cet espace appelé hémocœle qui contient l’ hemolymphe. Organisation de la paroi : Technique de préparation -Les tissus du crabe sont imbibés de sel ; leur déshydration est difficile La solution est de faire des bains dans un alcool éthylique très progressif 10-20-30 40 50 70 100 et 2 passages dans le Butanol à 100. ( 12 h par bain ) puis 2 jours dans du butanol à 100 saturé en paraffine Enfin bain de 2 jours dans la paraffine à 56 °c .Montage et coupe à 7 µm .. Coloration :Hématoxyline / Eosine/ Aniline ( bleu) Coupe de 7 µm d’épaisseur : A – Pericarde B – Myocarde - La grande distance entre les masses de cellules musculaires s’ explique par l’ absence de système capillaire - il faut que l’ endolymphe puisse s’ infiltrer partout ; Il faut donc que l’ hémocœle qui contient l’ hemolymphe s’infiltre dans tous les recoins de l’ organisme L'hémocœle assure ainsi la circulation sanguine dans un système circulatoire ouvert Les décapodes (comme les crabes, les homards ou les crevettes) possèdent un cœur dont la fréquence des battements varie selon l’espèce, la température de l’eau et leur niveau d’activité. En général, leur cœur bat entre 20 bpm et 60 bpm ( il a été signalé des décapodes ayant 200 battements par minute (bpm) : C – Endocarde D - Espace libre ventricule du cœur Pericarde : A Péricarde B Tissus musculaires Le Myocarde Les fibres musculaires – Elles sont disposées en faisceaux. Les fibres musculaires assurant la contraction et donc la mise en mouvement de l’ hemolymphe sont de type fibre musculaire lisse . A Fibres musculaires . B Tissu adipeux ou de réserves : Le cœur des décapodes peut contenir des cellules de stockage (lipides, glycogène), qui forment des amas clairs ou légèrement granuleux. Les fibres musculaires assurant la contraction et donc la mise en mouvement de l’ hémolymphe sont de type fibre musculaire lisse( A ) . Ces fibres sont sous le contrôle du système nerveux autonome et du système endocrinien Elles fonctionnent de manière indépendante ( rôle dans la vie végétative.). (Le tissu musculaire lisse est pour cette raison retrouvé dans la couche musculeuse de la paroi d'organes creux des systèmes digestif, respiratoire, circulatoire, urinaire et génital chez les mammifères). Le système vasculaire : Il s’agit d’un système ouvert :c’est-à-dire que l’ hemolymphe se répand dans la vaste cavité de l’hemocoele Il est récupéré à distance par des sinus veineux puis envoyé vers les branchies pour oxygénation et enfin vers le coeur pour subir une nouvelle propulsion . Image d’une coupe d’une artère courant dans la paroi du cœur – ( A noter un caillot d’ hemocytes dans la lumière de cette artère). L’ Hemolymphe L’ hemolymphe est le nom du liquide qui est contenu dans la cavité de l hémocœle Il n’y a pas de globules rouges fixant l’ hemoglobline mais l’ hemoplymphe contient une hemocyanine qui a le même rôle. L'hémocyanine oxydée, appelée oxyhémocyanine, donne une coloration bleue violette au « sang Elle est incolore dans sa forme réduite Elle contient deux cations cuivreux Cu+ qui se liennent à une molécule O2 de manière réversible en devenant cuivriques Cu2 Les Hemocytes : Sur cette photo il s’ agit d’un caillot créé par les techniques de préparation - il faut se souvenir que les hemocytes sont transparents Ils ont un rôle immunitaire. Concernant ces cellules immunitaires (l’équivalent des globules blancs) : Elles sont essentielles pour la réponse immunitaire innée des crustacés. Elles interviennent dans la phagocytose, l’encapsulation des pathogènes, la coagulation de l’hémolymphe et la production de molécules antimicrobiennes. Types principaux d’hémocytes chez les décapodes : Granulocytes (ou cellules granulaires) : impliqués dans la phagocytose et la mélanisation. Hyalinocytes (ou cellules hyalines) : moins granulaires, impliqués dans la coagulation et la cicatrisation. Donc bien qu’il n’y ait pas de globules blancs au sens strict (comme les leucocytes des vertébrés), les hémocytes remplissent des fonctions immunitaires comparables. Résumé du système circulatoire des Décapodes : -- A-- La cavité péricardique reçoit l’ hemolymphe saturé en Oxygéne en provenance des artères branchiques B --Le cœur est percé de plusieurs ostioles 2 à 3 fois 2 sur chaque côté ce qui permet le remplissage. C –L’hemolymphe va être propulsé suite à la contraction du cœur vers la périphérie grâce à un système artériel Ces artères sont ouvertes donc leur contenu se déverse directement dans l’ hémocœle D –Hemocoel L’ hémolymphe riche de CO2 est repris par un système veineux ouvert Ce qui assure un drainage de retour E – L’ hémolymphe drainé est orienté vers les branchies par un système circulation les sinus veineux F – Oxygénation par les branchies qui baignent dans l’ eau de mer - la carapace en effet n’ est pas hermétique mais laisse passer l’ eau environnante G - l’hémolymphe oxygéné retourne dans la cavité péricardique par les artères branchiales Ce schéma classique est le plus souvent rencontré - Héla il est difficile à comprendre à partir G et probablement faux - Le passage de l' hémolymphe oxygénée vers le cœur est un plus subtil que cela -C 'est ce que je vous propose de découvrir dans les articles sur les branchies et la circulation branchiale - A suivre - Références : https://www.plantyn.com/files/PLBI2.pdf https://cosmovisions.com/crustacesAnatomie.htm https://www.planeteanimal.com/anatomie-du-crabe-5309.html Aquaportail : Hémocyte Ghiretti-Magaldi et al. (1977) et Chassard-Bouchaud & Hubert (1975) Pour poursuivre la lecture : Sur MikrOscOpia il y a plusieurs articles sur le cœur - Celui de l’ huitre du calamar et du pigeon Dominique
-

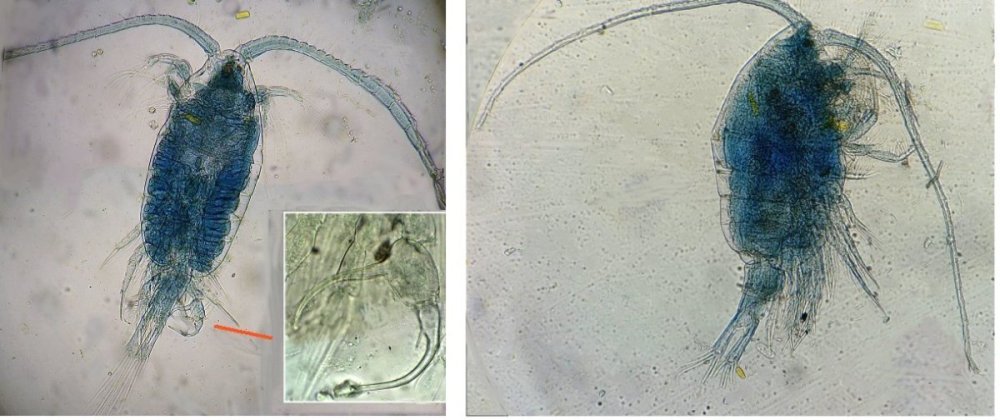
Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour Dominique Bonne question ! Les copépodes sont ubiquistes; on les trouve dans tous les milieux aquatiques voire des flaques d'eau, eaux saumâtres etc . Il n'y a pas de différences morphologiques entre espèce marine et eau douce. Dans mes observations j'ai trouvé des cyclopoïdes (le plus commun étant le cyclops) dans l'eau douce et aussi en eau de mer, mais pas de calanoïdes ni harpaticoïdes dans l'eau douce (encore que je n'ai pas beaucoup de choix pour les sites en eau douce !) . Je pense que la densité des espèces est beaucoup plus grande en eau de mer ce qui facilite la capture en nombre. Ce qui m'a étonné c'est de rencontrer Tigriopus qui n'est pas référencé en Méditerranée . Merci pour ton appréciation sur la dernière image "live" (: on voit le flou des maxillipédes qui s'agitent) , mais il faut être rapide pour la prise de vue. ! Amitiés JMC -

Petite collection de copépodes marins
Dominique. a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonsoir Jean -Marie Existe t il des différences qui permettent de dire ce copépode est d'origine eau douce celui-là vient de la mer ? Ta dernière photo est particulièrement réussie . Amicalement Dominique -

Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
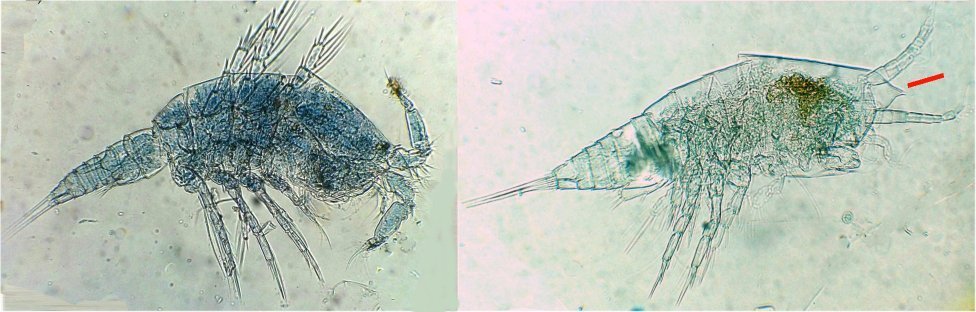
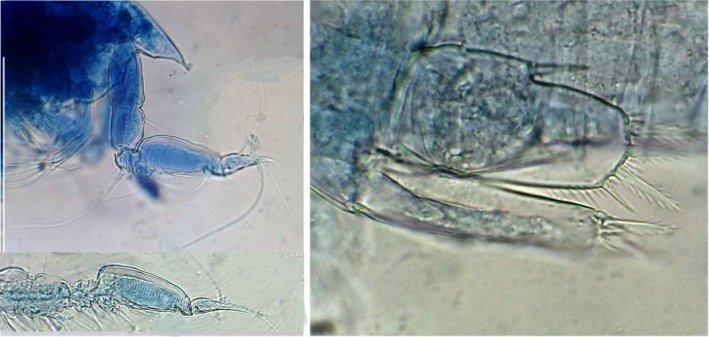
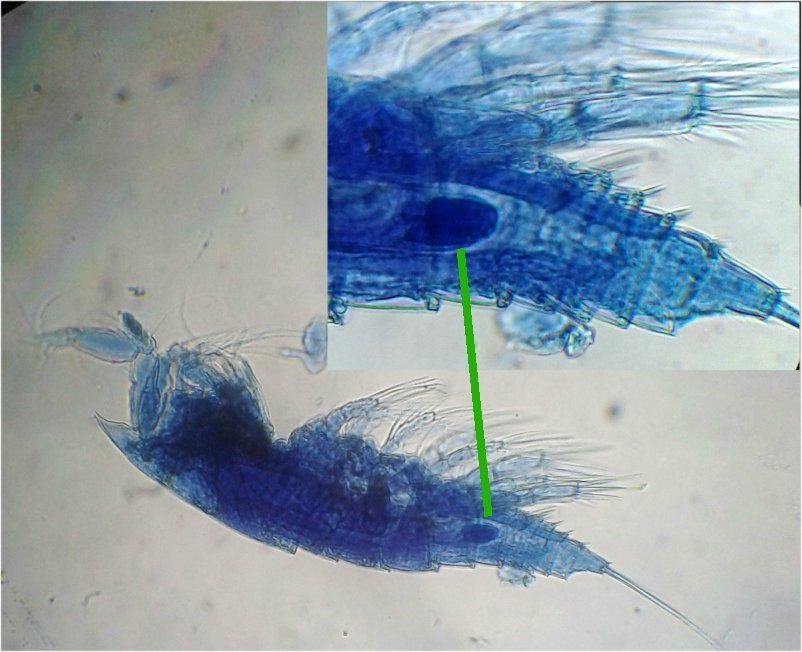
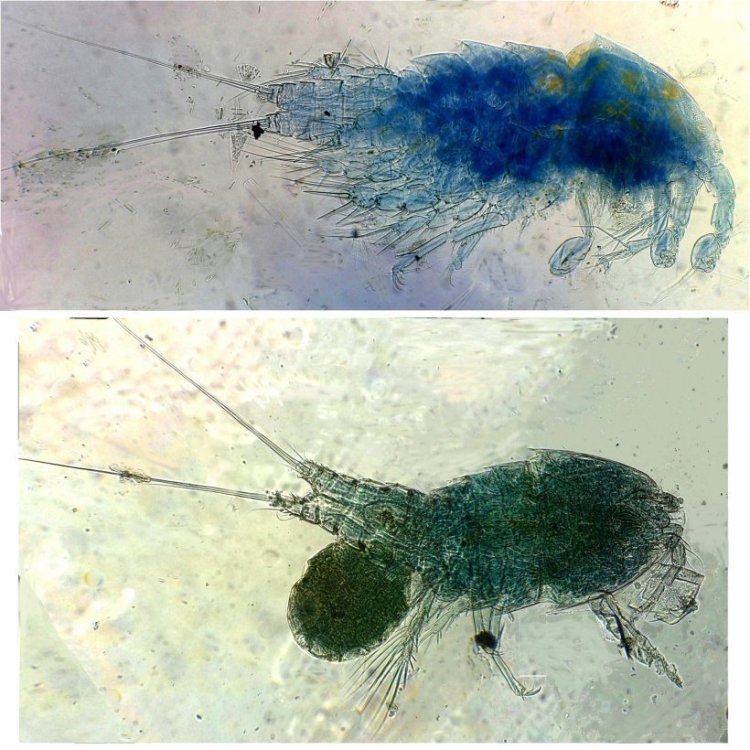
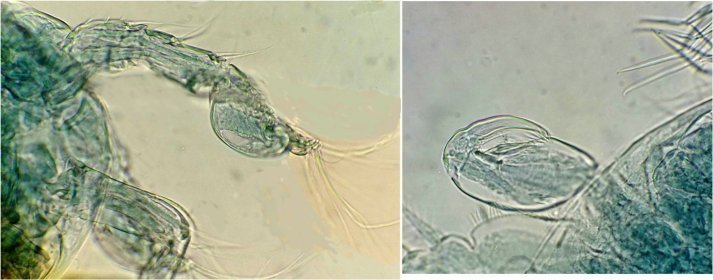
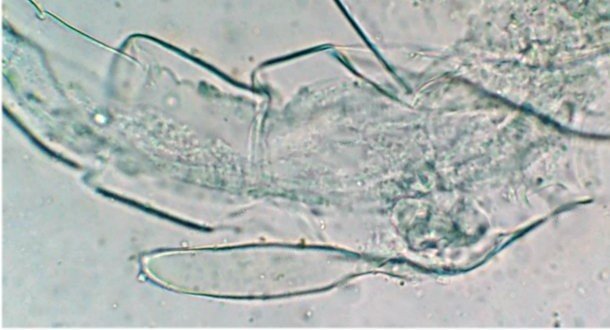
Suite ... Quatrième espèce : cette fois ordre des Harpaticoïdes : euterpina acufrontis : deux antennules courtes géniculées* sur le mâle à droite , rostre* bien visible sur la femelle mage de gauche détail d’une antennule mâle pliée et étendue et image à droite : P5 de la femelle très semblable à celle du mâle. Sur ce spécimen mâle on distingue un spermatophore* qui n’a pas encore été transféré sur la femelle détail au x 40 Cinquième espèce : harpaticoïde qui m’ a été difficile à identifier : Tigriopus. (Tig pods) Il en existe une quinzaine d’espèces. Leur couleur jaune est due à un pigment orange (astaxanthine) qui est synthétisé pour les protéger des rayons UVA et UVB du soleil, car les zones à faible profondeur (flaques) où ils vivent sont soumises aux rayons solaires. Les antennules, qui possèdent des détecteurs chimiques, permettent au mâle de reconnaître les propriétés chimiques d’une femelle en période de reproduction. On remarque les antennules du mâle de forme très caractéristique qui aident à l’accouplement et aussi la présence de maxillipèdes* chez les deux sexes. On voit bien le sac ovigène chez la femelle . Détail des antennules du mâle image de gauche (on y distingue des poils sensitifs ) et à droite un des deux maxillipèdes objectif x 40 Il semble que cette espèce soit plus rare en Méditerranée : je ne l’ai pas trouvée dans « Faune de France biblio Ref 3 ni sur Ref 4 (base de donnée française importante )» mais seulement chez « G.O. Sars – Ref2 ». L ‘espèce est sensée se trouver sur la cote Ouest de l’Europe mais ces spécimens ont bien été recueillis en Méditerranée ! Lexique : Antennule : Le plus antérieur des appendices pairs des crustacés, formé d'une base contenant un statocyste et de deux fouets, aux fonctions tactiles. L'une des fonctions de l'antennule est la détection de la nourriture, des mouvements de l'eau, des prédateurs Géniculée : avec une articulation rappelant celle du genou Spermatophore : une capsule contenant des spermatozoïdes créée par les mâles de diverses espèces , et transférée dans ou a proximité de l'ovipore de la femelle pendant l’accouplement Ovipore : organe sexuel femelle en forme de pore qui est inséminé par le spermatophore déposé par le mâle Maxillipède : Le maxillipède (littéralement « pied-mâchoire ») est un appendice du péréion (ou thorax) modifié chez certains crustacés et impliqué dans la nutrition. Le maxillipède est une sorte de « patte » thoracique qui a été transformée et qui sert à la mastication . Rostre : Prolongement pointu, vers l'avant du corps chez les insectes et crustacés Pour terminer et montrer la beauté d’un copépode vivant voici une image en fond noir pour s’exercer à la détermination : quel ordre, mâle ou femelle, espèce ?? Les indices sont ci dessus ! JMC -

Petite collection de copépodes marins
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
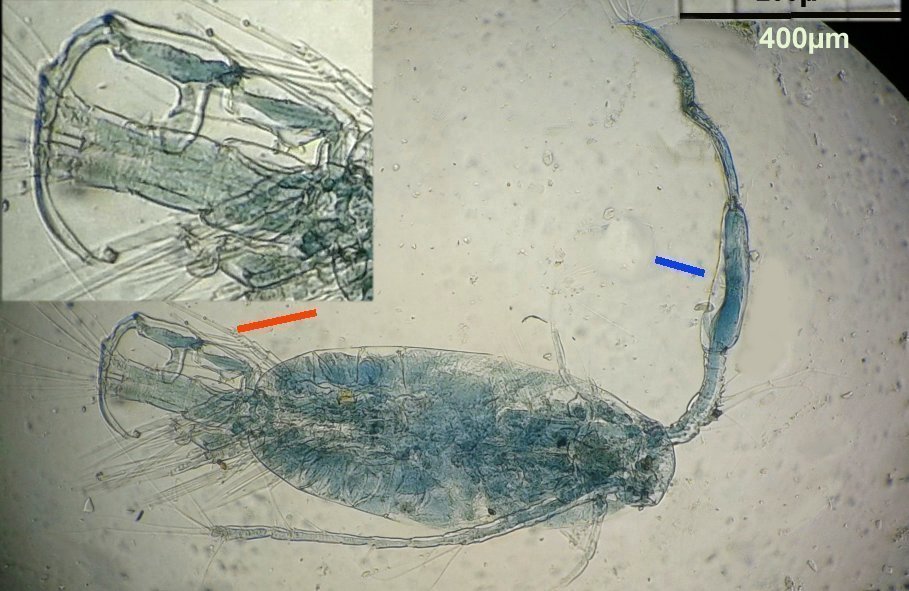
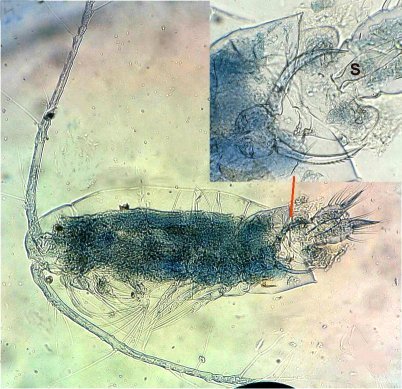
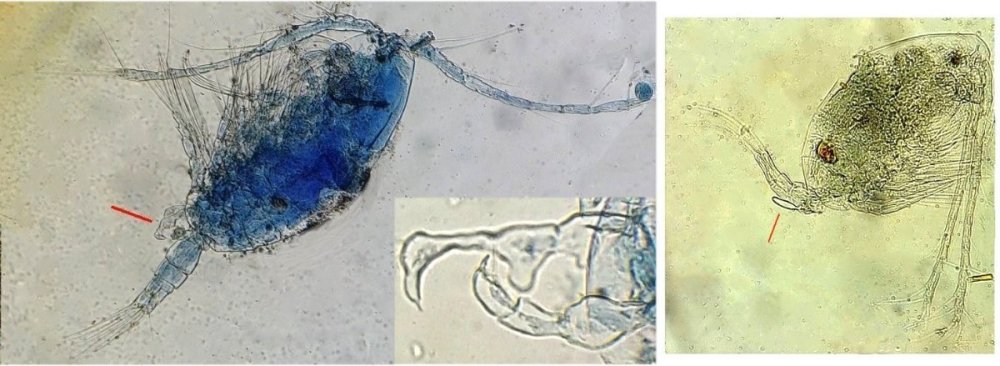
Les copépodes, sont de petits crustacés, qui constituent une grande partie du zooplancton ; ils représentent 12000 espèces où l’on distingue 10 ordres . Dans les prélèvements au filet à plancton (ici maille de 200 µm), le nombre de copépodes recueillis est très important en particulier les mois d’été. En prenant quelques précautions : conservation au frais de l’échantillon et observation rapide (entre 2 et 3 heures après prélèvement), de nombreux spécimens peuvent être observés vivants. Cependant en raison de leur nombre élevé, la concentration en oxygène baisse rapidement dans le flacon et vient ralentir leurs mouvements : il tombent au fond en constituant une « soupe » de copépodes et le prélèvement d’une seule goutte de ce dépôt ramène plus d’une dizaine de spécimens sur la lame. Dans l’image ci dessous , il faut donc diluer ! Ce grand nombre de spécimens va permettre de les figer en diverses positions et sur la quantité présente on peut trouver le mâle et la femelle . Pour les conserver : fixation au picroformol de Bouin directement sur lame, coloration par le vert de bromocrésol (pas vraiment un colorant mais un indicateur de pH) et montage à la gélatine glycérinée. J’ai ainsi réalisé plusieurs lames sur plusieurs années successives . Ceci fait je remets les reste du flacon à l’eau pour nourrir les alevins de poissons ... J’ai un peu négligé de m’intéresser plus tôt aux copépodes car je recherchais des sujets plus rares. En reprenant 6 ou 7 lames, dont certaines datent de 20 ans, j’ai pu identifier plusieurs espèces homogènes en quantité dans les échantillons. Voici quelques définitions de la morphologie des copépodes qui vont être utiles pour la suite : de plus , dans le texte, les mots repérés par « * » renvoient au lexique en fin d’article L’une des lames observées montrait un spécimen de l’ordre des calanoïdes, reconnaissables à leurs longues antennules* ; dont une des pattes de la dernière paire (P5) était largement modifiée en forme de pince : Ce dimorphisme sexuel est adapté à leur reproduction. La flèche rouge montre P5 modifiée et la flèche bleue une autre caractéristique du spécimen mâle : la présence d’une antennule géniculée* utilisée dans l’accouplement. La femelle ne possède pas d’antennule modifiée, les 2 sont identiques . P5 en forme de pince différente de celle du mâle :voici la femelle et la pince en détail : (S : spermatophore * ) Il est recommandé de lire ces liens pour voir plus en détail les modalités d’accouplement. https://forum.MikrOscOpia.com/topic/20108-reproduction-du-cop%C3%A9pode-paracartia-grani/#comment-83424 https://forum.MikrOscOpia.com/topic/20116-copépode-calanus-arcatia-arcaturia-clausi/#comment-83460 Les deux autres spécimens ci dessous sont de l espèce acartia grani (Male à gauche et femelle à droite). La pince du male est similaire à celle de pacartia grani mais semble moins sophistiquée. (détail à l’ objectif x40) La femelle n’a pas de pince à la différence de celle de paracartia on voit sur l’image à droite le spermatophore * collé sur l ‘ urosome de la femelle (flèche rouge) avec détail ci dessous à l’objectif x 40 Troisième espèce : Centropages ordre des calanoïdes aussi . La pince du male (photo de droite) est plus fine. On remarque aussi l’antennule géniculée * sur la droite du mâle une épine asymétrique sur la femelle (flèche bleue) orienterait vers centropages hamatu ; noter l’ovipore * (flèche verte) -
Bonjour Dominique, tous, J'ai déplacé les réponses à ce magnifique article, car elles traitaient d'un nouveau sujet. https://forum.mikroscopia.com/topic/20219-le-parasitisme-comportemental-exemple-le-ver-gordien/ Amicalement.
-
Albums
-
plancton d'eau douce
- Par Jean Marie Cavanihac,
- 0
- 0
- 28
-
Plantes
- Par Jean Marie Cavanihac,
- 0
- 0
- 10
-
plancton marin
- Par Jean Marie Cavanihac,
- 0
- 0
- 25
-
Eléments pour l'IBD
- Par Dominique Voisin,
- 0
- 0
- 8
-




























.jpg.b10e939d859152a3e8b4e84a1184543e.jpg)