-
Compteur de contenus
8 530 -
Inscription
Messages posté(e)s par Tryphon M
-
-
Oui,
Quand on a observé des ciliés au photonique et que l'on voit ici au TEM, les mêmes cils vus en coupe (surtout dans l'autre sujet, http://forum.MikrOscOpia.com/index.php?showtopic=12456 ), on voit la prouesse des ultra-coupes obtenues à l'ultra microscope !
D'abord la fixation, l'inclusion, à la résine, (Araldite !) , coupe à l'ultra-microtome, coloration des coupes, c'est assez comparable aux coupes à la paraffine, sauf que le matériel et les techniques sont adaptées afin de permettent de tels résultats.
Ce qui est remarquable, c'est la finesse extrême avec laquelle les milieux d'inclusion arrivent à pénétrer à l'intérieur de la matière vivante sans altérer ses structures.
Ensuite la finesse de la coupe dépend de l'état de l'arête du couteau et de la mécanique du microtome.
Mais pour obtenir d'aussi belles images, il faut que tous les éléments la chaîne soient au top !
Ce sont des images exceptionnelles. Souvent on n'arrive pas à ce niveau de netteté, mais comme ce qui compte ici c'est de reconnaître ce que l'on voit, l'aspect esthétique ne compte pas.
-
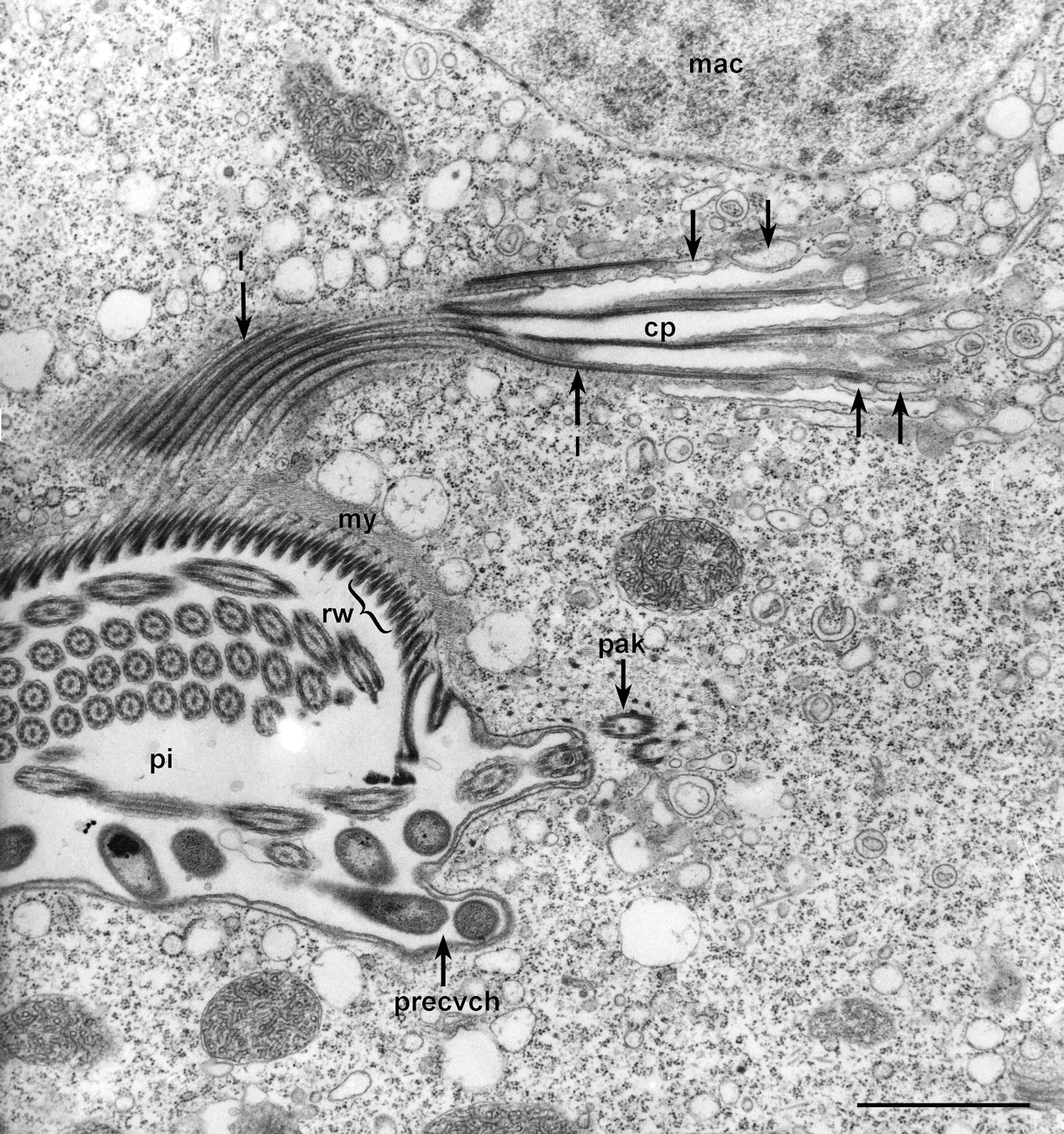
Food vacuoles arise from the single membrane that lines the cytopharynx (cp). Vesicles (arrows), similar to discoidal vesicles, attach to the cytopharyngeal microtubules (lamellar clumps) (l) that arise from the dorsal ribbed wall (rw) of the peristome (pi) and that pass beyond the cytosome (cell mouth, see Fig. 1f). The cytopharynx swells and a food vacuole balloons out through the ribs that are produced by the folded cytopharyngeal membrane and the attached lamellae. How, why and when a food vacuole pinches off needs further study. A myoneme (my) equivalent to the cytostomal cord in Paramecium lies along the origins of the lamellae (called cytopharyngeal ribbons in Paramecium). pak, paraoral kinetids; precvch, chamber with bacteria; mac, macronucleus. EM taken on 3/30/71 by R. Allen with Hitachi HU11A TEM. Mag. 9,250X. Bar = 1µm.
oooooOOOOOooooo
Bonjour,
Je vous présente une photo un peu surprenante pour le profane.
Il s'agit d'une coupe de Vorticelle dans la région du cytopharinx vue au Microscope Electronique en Transmission (TEM) à ne pas confondre avec le Microscope Electronique à Balayage (MEB). Bare = 1 micron. (Grandissement 4400 X : 9250 X sur l'original)
Contrairement aux images vues au MEB (Balayage) il faut faire quelques efforts pour interpréter ce genre de clichés.
Il faut en permanence avoir à l'esprit que nous voyons une coupe de quelques centièmes de micron d'épaisseur !
Ces images nous rappellent d'avantage les images anatomiques faites au Scanner ou à l' IRM que des photographies du corps humain faites avec un appareil photo traditionnel.
Bon nombre de microscopistes connaissent ces merveilleux petits organismes que sont les Vorticelles, sortes de petites clochettes attachées à un ressort qui se tend et se détend.
Une couronne ciliée attire la nourriture en suspension dans l'eau vers un entonnoir terminé par le cytopharinx.
Ces particules, algues ou bactéries, sont ensuite incluse dans une membrane qui va former une vésicule, sorte de petit ballon transparent, et voyager ainsi à travers tout le cytoplasme de la cellule pour effectuer une digestion.
C'est la région du cytopharynx que nous voyons ici.
Nous comprenons assez bien comment s'effectue cette digestion qui s'apparente à la phagocytose chez nos globules blancs ou chez les amibes, mais ici nous avons à faire à un organe complexe, le cytopharynx , qui sélectionne les particules qui doivent être absorbées ou non.
S'il y a un organe aussi complexe, fruit de l'évolution (?) il doit falloir qu'il existe un véritable "centre de décision" associé pour faire ce tri alimentaire.
C'est un véritable défi de comprendre ce phénomène.
Chez les cellules aussi simples que les bactéries (sans noyau) on peut faire intervenir une multitude de mécanismes chimiques pour expliquer leur fonctionnement, mais là, quel raffinement au niveau des structures !
Quelle est la nature de ces mécanismes, et s'il y a discrimination entre deux micro-organismes, l'un comestible, l'autre pas, où et sous quelles formes sont stockées les informations qui permettent ce choix?
Penchés sur nos microscopes, beaucoup d'entre nous nous demandons, en dehors du choc émotionnel esthétique, comment peut bien fonctionner tout cela et pourquoi!
La Microscopie Electronique nous donnes quelques réponses supplémentaires par rapport à nos microscopes photoniques, mais nous fait poser encore plus de questions.
Le microscope photonique (qu'on appelle parfois à tort, optique) est l'instrument scientifique qui a amené un plus grand pouvoir de résolution pour voir la nature.
Le Microscope Electronique à multiplié ce pouvoir de résolution par 1000 !
En multipliant par 1000 ou par un million le pouvoir de distinguer de plus fins détails physiques, c'est en réalité notre esprit qui a multiplié le sien par ces mêmes facteurs.
Armés de ces instruments, nous ne pouvons que nous émerveiller de ces splendeurs (dont l'image du haut n'est un microscopique échantillon) mais surtout nous nous sentons un devoir de nous poser des questions et de chercher les réponses.
Amitiés.
-
Bonjour Laurent,
Ta question est très juste.
Ce microscope fonctionne très certainement car il à l'air complet.
Toutefois, il faut tenir compte de plusieurs problèmes fondamentaux.
D'abord il faut le démonter presque entièrement pour le transporter sinon il y a de fortes chances qu'il se détériore pendant le transport.
C'est comme les nombreux microscopes photoniques d'occasion qui voyagent par des moyens postaux, souvent les colis sont jetés, et les pièces lourdes viennent forcer sur des pièces plus fragiles et les détériorer.
Ensuite il faut savoir le démonter.
A l'intérieur des lentilles qui pèsent parfois plus de 10kg, il y a souvent de très fragiles mécanismes qu'il ne faut surtout pas toucher et encore moins écraser si leur emballage individuel n'est pas prévu à cet effet.
Ensuite vient le temps du remontage. Il vaut mieux ne pas oublier une toute petite pièce!
Lors du remontage il est conseillé de changer certains joints, voir tous. De toute façon les joints en magnésium ne sont pas récupérables.
Je pense que le nombre de joints dans un microscope de ce type doit avoisiner la centaine.
Les pompes doivent recevoir une attention toute particulière.
Le mercure peut s'échapper des pompes à mercure, l'huile à palette déborder et contaminer les tuyaux, l'huile à diffusion (très chère) doit être remplacée.
Les pompes ioniques ne doivent pas trop rester en contact atmosphérique etc.
Dans le tank à huile (THT) il y a souvent des lampes à préserver des chocs, de plus elles sont souvent introuvables.
Reste ensuite à réparer les inévitables panes. Bonjour le travail. Et à trouver les pièces détachées.
Mais surtout, si par bonheur ou génie le microscope fonctionne, il faut y mettre dedans, des objets à observer.
Et pour cela il faut encore beaucoup de matériel.
Je connais tout çà, j'ai acquis 7 TEM , et je suis prêt à aider celui, un peu fou, qui se lancera dans l'aventure.
Faire fonctionner un TEM revient à quelque chose près, à refaire voler un Fouga-Magister.
Il y en a qui l'on fait...
Amitiés.Droit de réponse au sujet suivant :
http://www.lenaturaliste.net/forum/viewtopic.php?f=4&t=11781
Dans lequel est mise en question (en privé) mon honnêteté intellectuelle.
(Sujet séparé et caché venant du sujet suivant ICI ! )
Comme l'intox selon laquelle je ne cite pas ce forum est bien tenace ne procède pas de l'honnêteté intellectuelle de son auteur..
Bien entendu vous ne pouvez pas y accéder puisqu'il est dans un espace réservé, d'un forum où rien n'est caché.
'Birman dans fr.answers.yahoo.com' a écrit :
Pour moi l'honnêteté intellectuelle c'est l'objectivité avec laquelle on détermine sa propre opinion. C'est aussi l'absence de parti pris et une volonté d'équité dans l'appréciation des différents arguments.Pour moi aussi !
Tous les éléments d’appréciation, pour se forger une opinion honnête, ne sont recevables que si on a au préalable examiné tous les éléments précédents en commençant par l'origine de la chaîne de causalité. (1)
En ce qui concerne les relations entre les administrateurs des deux forums concernés il faut donc commencer au 18 mars 2004 date d'inscription de Chris à MikrOscOpia et certainement pas à partir de la création de son forum le 14-sep-2007.L'honnêteté intellectuelle n'a visiblement pas la même définition pour tout le monde.
(1) Supposons que nous relancions un dé, tant qu'on n'a pas obtenu le résultat désiré !
A l'inverse, faire commencer l'origine d'un litige au moment où çà vous arrange et non à son début, n'est pas plus honnête.
-
Bonjour à tous,
les MEB récents n'utilisent plus d'azote liquide aussi bien pour les pompes..Je ne suis pas d'accord avec Patrice qui nous dit que l'azote liquide n'est plus utilisé pour les pompes, pour la bonne raison que je n'ai jamais vu un seul modèle de pompe à vide utilisant de l'azote liquide en microscopie électronique.
Pour le reste, je suis d'accord.
Je sais qu'il existe des pompes cryogéniques, mais je n'en ai jamais vu sur un microscope et encore moins à balayage.
De plus les cryopompes utilisent le plus souvent de l'hélium grâce à un cryogénérateur.
Les seuls usages que je connait de l'azote liquide en ME est la décontamination au niveau du porte objet, les pièges à gaz en sortie de pompe à vide (dits pièges à azote liquide) et comme dans le microscope présenté, le système EDS, mais j'avoue ne pas en avoir rencontré.
Pardonnez-moi pour l'intrusion (relative), mais le sujet m'intéresse...
Cordialement.
-
Bonjour,
Une annonce sur un site de vente français présente un Microscope Electronique
http://www.leboncoin.fr/materiel_professionnel/380974336.htm?ca=5_s
Une série de questions se posent aux amateurs qui pourraient envisager un achat.
Une discussion est même ouverte sur un autre forum, mais ce forum n'est pas ouvert aux visiteurs (" trop de spam !!-- ")
Comme j'ai une petite expérience dans ce domaine, je suis en mesure de répondre à certaines questions et éventuellement donner quelques conseils et apporter mon aide.
D'abord quelques idées reçues ou erreurs.
- Non ce n'est pas un MEB (Microscope Electronique à Balayage) :
La morphologie générale de l'appareil n'est pas du tout la même, cela se reconnait au premier coup d'oeil.
Voir sur le site la différence entre les deux technologies.
- La loupe binoculaire sert à observer l'image fournie par le microscope.
Les électrons étant invisibles, on récupère l'image formée par le microscope sur un écran fluorescent qui est observé à la bino.
- Le Dewar que l'on voit sur la photo contient en effet de l'azote liquide, mais cela n'a rien à voir avec "la pompe à vide" (Il n'y a pas une pompe à vide dans un Microscope Electronique, mais un système de pompage qui comprend plusieurs types de pompes à vide complémentaires)
Il s'agit d'un dispositif de décontamination couplé probablement à un EDS.
- Au sujet des joints , en effet, ils ont besoin d'attention, mais c'est un problème mineur dans l'entretien général du microscope.
Le microscope lui même :
La marque: Je ne connais aucune marque de ME Wekex .
Par contre l'inscription sur le Dewar est KeVex qui est la marque d'un système EDS.
L'EDS est un système d'analyse du spectre des rayons X produits par les électrons sur une cible refroidie.
Même d'une marque connue, il n'existe pas de pièces de rechange pour un microscope de cet âge.
Les pièces pour les microscopes encore en service sont horriblement chères ainsi que la main d'oeuvre.
Le plus souvent il faut souscrire un contrat de maintenance.
En état de marche: possible. (mais j'ai un doute, il est sur palette.)
De toute façon, un ME n'est pas transportable en l'état.
Pour déplacer un ME, il faut le démonter et ceci de manière "chirurgicale".
Puis le remonter bien sûr.
Ensuite, il faut un laboratoire pour l’accueillir.
Un ME ne fonctionne pas comme un microscope photonique sur un coin de bureau.
Un ME a besoin pour fonctionner, de Vide, d'air comprimé, d'eau, d'électricité, de consommables, et tout le matériel pour préparer les échantillons (Ultramicrotome, métalliseur etc)
Bon courage à celui qui veut tenter l'aventure, mais je suis prêt à fournir mon aide.
Cordialement.
-
Bonjour Benoit,
Je vous remercie pour cette proposition.
Cet instrument fait beaucoup rêver dans le monde des amateurs !
Cordialement.
-
Bonjour les Amis, et merci pour le partage.
Je souscris entièrement aux remarques de mes éminents prédécesseurs:
Je pense aussi à une larve de Chironome (au pif quand même, çà y ressemble beaucoup)
Pour la fluorescence, on ne le dira jamais assez : cela n'a pratiquement aucun intérêt pour un amateur généraliste.
C'est une technique spécifique à l'étude biochimique qui nécessite de grandes connaissances et des marqueurs très spécifiques et très chers.
De plus le rayonnement UV est invisible et peut abîmer l'oeil !
Le danger ne vient pas de son utilisation en routine, les microscopes sont protégés tant qu'ils sont bien entretenus par des personnes compétentes et responsables.
Pour l'amateur qui est amené à démonter ou réparer lui même, son microscope, le risque est certain, allant même jusqu'à l'explosion !
Chacun prend bien entendu ses propres responsabilités et la mienne ainsi que les membres avertis du forum, n'est pas d'interdire quoi que ce soit, mais de'informer et de mettre en garde.
Et je le répète, cela n'a aucun intérêt pour un amateur .
Amitiés.
Petit supplément : je comprends la question de LDV : comme la larve semble être envahie d'algues vertes, il serait intéressant en effet de rendre la chlorophylle de ces algues visible en fluorescence , nous aurions dans ce cas une belle couleur rouge .
-
Bonjour Raphael, tous,
Je comprends très bien tes préoccupations : pourquoi risquer de s'empoisonner quand on peut utiliser des produits naturels.
Mais est-ce la bonne problématique?
D'un côté, nous avons une huile synthétique composée d'une seule molécule et de l'autre un produit naturel composé d'une multitude de molécules qui ne sont pas neutres puisqu'on leur attribue des propriétés médicinales.
Un médicament n'est pas un produit neutre!
Veut-on soigner ses objectifs ou faire de l'immersion sans s'empoisonner?
Soyons réaliste.
On dépose une petite goutte d'huile sur une préparation, ensuite, en principe on ne s'en enduit pas les doigts, on ne l'avale pas.
Avec combien de gouttes d'huile est-on en contact dans une semaine, dans un mois, au cours de sa vie?
Dans un cas comme dans l'autre, si on ne lèche pas ses lames ou les objectifs pour les nettoyer, on cours bien moins de risques à faire de l'immersion que de respirer l'air du Métro ou l'air des villes .
Puisque c'est le principe de précaution qui va guider notre choix, j'opterais personnellement pour l'huile synthétique tant qu'on en trouve encore, ensuite, j'utiliserais celle qui se présentera , sans plus d'état d'âme.
Amitiés..
Pour votre curiosité, voici quelques formules "pour faire savant" et deux Pdf très instructifs que je vous recommande de parcourir.
Huile de Cèdre :
Sesquiterpènes : alpha-cédrène (31.6%), thujopsène (11.44%), cuparène (1.44%)
Sesquiterpénols : cédrol (22.07%)
Huile de ricin : acide ®-(+)-12-hydroxy-9Z-octadécénoïque.
Huile de Tacamaque:
http://fred.laure.free.fr/data/these_f_laure.pdf
-
Tout à fait, son indice de réfraction (1.47) est proche de celui du verre (1.52).
Reste que je ne connais pas sa compatibilité avec les ciments des lentilles frontales.
-
-
La dernière vidéo montre que l'on peut faire toutes sortes de coupes, même des coupes de 3 mm de diamètre.
Sur la vidéo du message précédent, on voit bien que le moule inox comporte une partie beaucoup plus petite que les autres moules qui ont un fond plat.
Avec ce moule nous avons donc une petite surface de coupe contrairement aux autres qui font des coupes aux dimensions de la cassette.
On peut donc mouler un bloc de paraffine à la taille que l'on désire, c'est à dire celle de l'échantillon.
Pour l'autre côté du bloc de coupe, c'est à dire celui qui se fixe sur le microtome, on peut envisager un second dispositif aux dimensions du support, mais en inox et réutilisable !
Il suffit que ses dimensions extérieures correspondent à celles de la cassette .
Je pense même que le moule doit avoir des dimensions permettant sa fixation sur le microtome.
Dans ce cas là, il suffirait d'un second moule percé de petits trous pour permettre à la paraffine de pénétrer au contact du premier bloc obtenu avec le premier moule.
Donc un moule spécial à fond étroit adapté à la coupe et un moule percé pour la fixation, cela devrait le faire ...
Pour le distributeur de paraffine, il faudrait un récipient (inox de préférence ou en alu çà devrait le faire)) muni d'un robinet à sa partie inférieure.
Ensuite une simple résistance plongeante (d'aquarium peut-être) et un thermostat (voir JMC) suffirait.
Cordialement.
-
Bonjour Sandrine, JMC,
D'abord félicitations pour l'acquisition !
Ensuite, pas de panique.
Les cassettes sont utiles et je dirais presque indispensables.
A quoi sert une cassette?
D'abord, c'est une petite boite dans laquelle on range l'échantillon tout au cours de son périple.
Les cassettes servent à identifier l'échantillon quand on travaille à la chaine dans un hopital par exemple.
Evidemment, il ne faut pas mélanger les prélèvements de patients différents !
Il y a même des imprimantes pour imprimer un code sur chaque cassette.
En dernier, la cassette servira de support pour le bloc sur le microtome.
A tout moment donc on aura un suivi de l'échantillon.
Mais, il n'est pas besoin de "tout un appareillage" pour distribuer la paraffine, cela peut être fait "à la main", mais il est préférable d'avoir un distributeurs simple .
C'est un récipient chauffant (résistance) avec un robinet.
Sinon on peut faire chauffer la paraffine à la casserole (ou presque)
Ensuite on place son échantillon dans un moule et sur ce moule on colle la cassette.
On enlève le moule et on introduit la cassette dans le support de microtome, la cassette étant prévue pour fonctionner avec un microtome.
Le moule en inox est récupérable et la cassette jetable.
On peut toujours récupérer la cassette mais ce n'est pas facile de nettoyer toute la paraffine.
On voit ici le rôle de la cassette.
Il existe de nombreux systèmes d'enrobage dans des blocs qui dépendent du type de support de bloc et donc de microtome.
Il y a pas mal de VIDEOS sur internet qui montrent le processus.
A titre de curiosité, un bloc un peu spécial...
Et pour finir, une petite brochure.
Microtomy_booklet_french_online.pdf
Cordialement.
-
-
Re,
En complément du précédent message, je joins une image extraite du" Oxford Experimental Journal of Botany" http://jxb.oxfordjournals.org
Fig. 2. Mature fruit exocarp cell (45 dpa), showing intense DAB staining of the inner edge of the cell wall (CW), and the plasma membrane (PM). The cytoplasm, shows little or no DAB staining, with no activity associated with organelles such as mitochondria (M), chromoplasts (CH) and the nucleus (N). The tonoplast (T) bordering the vacuole (V) shows little or no DAB staining compared with the tonoplast of immature tomato fruit (Fig. 1A, B). Calibration bar=1 µm.En D on voit bien le décollement de la membrane plasmique.
La plasmolyse se fit "donc" par récolement de la membrane plasmique.
On se rend compte de la FINESSE des détails obtenus en microscopie électronique.
La barre représente 1 micon ! Le grandissement sur mon écran est de 20 000 fois, on peut déjà y suivre le tonoplaste sur toute la largeur de la photo.
Explication de la plasmolyse :
Les photos qui suivent sont extraites de ce site : http://www.svtauclairjj.fr/allium/plasmolyse.htm
On voit bien sur la dernière photo que plusieurs vacuoles se sont formées et on voit bien que le cytoplasme entoure la vacuole et que c'est bien la membrane cytoplasmique qui est décollée de la paroi cellulaire (CW ou cell wall) et on devine également des ponts cellulaires (cytoplasme trabéculaire ) traversant le vide optique créé par la plasmolyse.
Pour ceux qui n'on pas eu la chance de voir tout cela en direct, j'ai choisi ces pages parce qu'elles donnent une vue très réaliste de ces phénomènes.
Pour les microscopistes amateur, ils verront à quel point ces images et vidéo sont conformes à ce qu'ils ont pu observer
Je recommande de visionner l'ensemble des pages du très beau site de Jean Jaques Auclair qui concernent :
Cellules d'oignon :
- Organisation du cytoplasme de la cellule épidermique d'Allium cepa
- Paroi, membrane plasmique et vacuole de la cellule épidermique d'Allium cepa
- Organisation de la cellule épidermique d'Allium cepa Coloration vitale au rouge neutre
- Cellule épidermique d'Allium cepa colorée au rouge neutre Vacuole / Cytoplasme
- Cellule épidermique d'Allium cepa colorée au rouge neutre Paroi / Cytoplasme Ponctuations
- Le cytoplasme de la cellule épidermique d'Allium cepa siège d'incessants mouvements d'organites
- Plasticité et mobilité du Reticulum endoplasmique de la cellule épidermique d'Allium cepa
- Cyclose et plasticité des mitochondries
- Etat plasmolysé de la cellule épidermique d'Alliun cepa
- Déplasmolyse de la cellule épidermique d'Allium cepa
Cellules d' Elodée :
- Déplacement des chloroplastes et des mitochondries dans la cellule de feuille d'Elodée
Et les pages associées.
Très bel exemple de cytoplasme trabéculaire. ! (Trabéculaire à la même origine que travée Une travée est un élément qui traverse, comme une poutre ...)
Qui doute encore de l'existence de la vacuole ?
Cordialement.
.
-
Bonjour Yorin,
Merci d’être toujours (encore) en ligne
Je veux bien, dans l'absolu, tenir compte de la première objection mais, honnêtement, j'aimerais que l'on ne prenne pas Tissot pour le dernier des débutants.Ce n'est pas "dans l'absolu", (comme si cette condition était négligeable)
c'est la première des conditions du protocole : utiliser des cellules ayant exactement le même stade de plasmolyse.
Tout le reste du protocole en dépend. C'est la raison pour laquelle cette condition non indiquée dans le protocole est primordiale.
Concernant les deux autres objections, elles restent à mes yeux assez superficielles dans la mesure où rien ne vous empêche de tester UNE expérience avec la technique et la concentration de votre choix. Juste pour voir. Par pure curiosité.J'ai déjà indiqué que le protocole n'était pas complet en ce qui concerne l'état initial des cellules.
Soit !
Si on admet que le quelconque (de mon choix) inclue toutes les techniques et concentrations, il faut considérer que la méthode utilisée quotidiennement dans les laboratoires officiels en fait partie également.
Et on connait les résultats.
Si au contraire, ce quelconque exclue les techniques les plus universellement admises, cela me pose un gros problème .
Une seule fixation suivie d'une inclusion à la paraffine, suivie d'une coupe , suivie d'une coloration type hématoxyline (1) prend beaucoup de temps, nécessite du matériel spécialisé et n'est pas à la portée d'un amateur, ce n'est pas un problème de curiosité ou non.
C'est pour cela que je vous ai conseillé de vous adresser à un laboratoire officiel (INRA CNRS).
Vous m'excuserez de partir de cette dernière citation pour répondre à votre dernier post, mais elle m'a fait rire !Pourquoi ? Parce que le formol aussi conserve très bien. Cela suffit-il pour valider la thèse de Tissot ? Non.
Je suppose que vous vouliez dire invalider ?
Si j'ai pris l'exemple des cornichons, c'est pour répondre à votre allégation de substance corrosive concernant l'acide acétique (voir les photos de pièce de monnaie et de tibia ).
Non seulement le vinaigre ne corrode pas les cornichons, il ne les transforme pas en ratatouille, mais en plus, on les mange !
Mettre de l'acide acétique sur la langue (plus sensible encore que le tibia) aux concentrations de Tissot, nous le faisons tout les jours.
Il n'y a décidément que vous pour prendre cela à la lettre !Quand on réitère de faire cette expérience à plusieurs interlocuteurs, je suis en droit de penser que c'est le reflet de votre conviction et non un trait de l'humour.
conserve mal le cytoplasme et dissout le chondriome."D'abord je rappelle que c'est Langeron qui l'écrit en 1924. Et que depuis on maîtrise ce problème puisqu'on n'utilise pas l'acide acétique SEUL.
Je rappelle encore que du temps de Tissot, on ne connaissait quasiment rien du chondriome et qu'actuellement on coupe les mitochondries (voir les photos que j'ai postées) en tranches fines disons pour fixer les idées en 50 tranches distinctes.
On peut ensuite reconstituer une mitochondrie en 3D, comme d'ailleurs l'ensemble de la cellule..
Croyez-vous in instant que les fixateurs utilisés pour cela et qui respectent la structure de la cellule avec AUTANT de précision la transforment en RATATOUILLE?
Et comment se fait-il que toutes les techniques modernes de fixation des cellules aboutissent toutes à des résultats aussi concordants, à une échelle aussi FINE et aussi en opposition avec les conclusions de Tissot.?
Toute l'anatomie ultrastructurale de la cellule est cohérente et correspond à toutes les investigations biochimiques associées.
C'est tout le contraire de la théorie de la ratatouille!
Que pensez-vous par ailleurs du passage ci-dessous ? Quel contre-argument apporteriez-vous ?Je dirais simplement que des années sont passées depuis Tissot et que nous observons maintenant ce dont il niait l’existence avec une résolution 1000 X supérieure à celle de ses instruments.
Il suffit de mettre un peu de Rouge Neutre au contact d'une cellule végétale pour voir la vacuole, la cellule étant vivante et donc non fixée.
http://www.svtauclairjj.fr/allium/vacuole.htm
Et la membrane qui limite la vacuole (le tonoplaste) est observable en microscopie électronique.
Cordialement.
(1)PROTOCOLE de COLORATION H&E :
1. Placer dans un bain de xylène pendant 5min
2. Placer dans un bain de xylène pendant 5min
3. Placer en alcool 100° pendant 5 min
4. Placer en alcool 95° pendant 5 min
5. Placer en alcool 70° pendant 5 min
6. Placer dans un bain d’alcool chlorhydrique pendant 5 min
(ou bain d’alcool ammoniacal pendant 5 min)
7. Rincer à l’eau courante pendant 10 min
8. Placer dans la solution d’ hématoxyline de Mayer pendant 5 min
9. Rincer à l’eau courante pendant 10 secondes
10. Placer dans un bain d’eau carbonatée pendant 5 min
11. Rincer à l’eau courante pendant 10 min
12. Placer dans la solution d’Eosine pendant 5 min
13. Placer dans un bain de chlorure de calcium pendant 5 secondes
14. Placer dans un bain de chlorure de calcium pendant 2 min
15. Placer en alcool 100° pendant 3 min
16. Placer en alcool 100° pendant 3 min
17. Placer en alcool 100° pendant 3 min
18. Placer en xylène pendant 5 min
19. Sortir en xylène
20. Monter les lames .
Extrait de http://www.labonord.com/IFU/FR/10047105.pdf
-
Bonjour,
Je lis ceci dans le blog de Yorin,
Un interlocuteur dit qu'il s'est simplement tâché les doigts, sans brûlure avec une teinture en préparant des échantillons...(1)
La bonne blague ! Tu es prêt à faire de même avec de l'acide acétique et de l'acide osmique - qui sont les véritables cibles de l'article ?Acide acétique:
(Pour l'acide osmique j'ai déjà répondu, mais je précise la chose suivante.
En microscopie électronique, on plonge une ampoule d'acide osmique dans un récipient contenant de l'eau , on casse l'ampoule sous l'eau avec une pince, et on soumet le sujet aux VAPEURS qui se dégagent du récipient.
Il n'est donc pas question de plonger le bras dans de l'acide.)
Pour l'acide acétique donc :
Je lis dans un ouvrage ancien (Langeron 1942):
"Employé seul, en solution aqueuse à 1%, il sert à mettre en évidence le noyau des protozoaires en cours d'examen extemporanés, mais il ne peut servir de fixateur proprement dit car il conserve très mal le cytoplasme et dissout le chondriome."
Pour se donner une idée de ce qu'est une concentration d'acide acétique à 1% , voici ce que dit Wikipédia au sujet du vinaigre :
"Le vinaigre commun comporte une concentration d'environ 5 à 8 % d'acide acétique"
Que je sache, les cornichons s'y conservent très bien !
Cordialement.
(1)
"je sais ce que j'ai vu avec une simple coloration juste avec une teinture non corrosive dont je me suis taché les mains sans que ça me brule ou quoi que ce soit."
-
Bonjour Jean-Marie, tous,
Tes photos sont des plus convaincantes!
La dernière est particulièrement édifiante !!!
On voit bien que les pigments sont dans les tomatophores :)
Cependant je me demande si dans une tomate mûre, les cellules n'ont pas tendance à éclater (c'est sûr!) ainsi que les membranes des vésicules et le pigment se dissoudre dans l'ensemble de la gelée qui résulte de cette lyse.
Scénario en trois phases :
- Dans un premier temps la cellule synthétise des pigments qui sont stockés dans des vésicules, comme tout produit de sécrétion cellulaire.
- Dans un deuxième temps, la concentration, au sein des vésicules auglmente et les pigments cristalisent.
- Dans un troisième temps, la cellule meurt ou tout au moins la membrane de la vésicule éclate et le pigment diffuse dans tout ce qui reste de l'espace cellulaire.
On peut se poser la question suivante : comment avec aussi peu de matériel chromatique par cellule les tomates paraissent elles aussi rouges ?C'est une question essentielle en microscopie!
D'autres ce sont demandé pourquoi le sang est rouge ?
La réponse est classiquement parce qu'il est constitué en grande partie de Globules Rouges qui contiennent de l'hémoglobine .
Or au microscope, les GR ne sont pas rouges! Mais orangés.
De plus, il n'y a pas de vésicules chromatophores qui contiennent l'hémoglobine , preuve qu'une substance chromatiquement active, peut être diffuse et non figurée.
A mon avis, pour répondre à ta question, il faut aller voir du côté de la cosmologie!
Pourquoi le ciel nocturne est-il noir, alors que des milliards de galaxies et d'étoiles y billent?
Il devrait être lumineux au contraire.
Cosmologiquement.
-
Bonsoir,
Je me suis permis une correction de la balance des blancs + Niveau de luminosité/contraste.
En effet, la couleur semble venir exclusivement des pigments et non de molécules dissoutes dans l'ensemble du cytoplasme.
Cela s'explique: les chromoplastes (qui contiennent les pigments) sont issus de l'évolution des chloroplastes.
La diffusion de la couleur dans l'ensemble de la préparation (y compris dans les parties "blanches" ) a donc une origine instrumentale (appareil photo)
Cordialement.
-
Bonjour à tous,
D'abord, je voudrais féliciter les intervenants sur la bonne tenue du débat.
Qu'en pensez-vous ?
Beaucoup de choses très intéressantes...
Objectivité :
Sur la photographie:
Il ne fait aucun doute que "la photographie" regroupe un tas d'activités diverses.
La multitude des réglages d'un appareil photo moderne et l’existence de post traitements, fait déjà que l'appareil n'est pas tout à fait objectif, puisque l'humain, peut apporter de nombreuses modifications à l'image qu'il voit dans son viseur, en fonction ... de sa subjectivité.
Dans la photo d'art, le problème de l'objectivité du matériel ne se pose même pas.
Dans la photographie destinée à la publication ou à la diffusion familiale, le souci de présenter des photos conformes aux critères de l'esthétique ou de la mode, ne sont pas absentes non plus.
Sur la photographie scientifique :
Qu'en est-il de la photographie scientifique en général et de la photomicrographie en particulier?
Le premier souci du scientifique serait en premier de vouloir, justement que sa photo corresponde le plus possible à la réalité.
Il fera donc ses réglages dans ce sens.
Dans ce cas comme dans les autres cas précédents où est l'objectivité de la photo puisque l'humain intervien dans les réglages.
Qu'en est-il des automatismes?
On pourrait se dire : laissons l'appareil se débrouiller tout seul.
Je répondrais que TOUS, les automatismes sont des algorithmes HUMAINS.
Dans tous les cas de figure, l'objectivité d'un instrument repose sur la subjectivité humaine.
Le seul problème à se poser, est celui des buts recherchés par le scientifique qui prend la photo, ou ceux qui ont conçus l'appareil lui même et les algorithmes qui permettent son fonctionnement et par là même son honnêteté.
Ici encore, tout repose sur les buts et l'honnêteté de l'observateur.
Sur l'observation au microscope.
En microscopie, la photographie se complique du fait que le microscope ne voit qu'un plan de l'objet à la fois.
Dans la vision directe au microscope, l'observateur fait à la fois appel au "pompage" qu'il effectue avec la mise au point micrométrique, a sa persistance rétinienne et à sa mémoire visuelle.
Il intègre donc dans son cerveau plusieurs plans de coupe, pour se faire une représentation, plus conforme à la vision macroscopique, de l'objet.
Dans ce sens, le dessin est supérieur à la photo car il intègre ces différents plans de coupe restitués par son cerveau.
Nous rencontrons deux séries de problèmes:
L'objectivité lors d'observations initiales. (A priori)
L'objectivité à posteriori.
Dans une observation initiale, c'est à dire sur un sujet qui n'a jamais été observé auparavant, on n'à aucune idée préconçue de ce que l'on va voir. C'est la découverte.
Dans ce cas, on va régler son microscope et utiliser les techniques que l'on a à sa disposition, en essayant de "faire pour le mieux" .
Mais surtout on va multiplier les techniques et les moyens pour voir si les résultats se recoupent.
On peut alors commencer à échafauder des théories. C'est le cas des microscopistes du temps de Tissot.
Pour toutes les observations actuelles sur la cellule, il est difficile de faire abstraction des connaissances notamment apportées par la microscopie électronique.
Ainsi, de nombreux amateurs, connaissant la représentation des Diatomées en microscopie électronique en balayage, règlent leur microscope dans le but d'avoir des résultats le plus conforme à ce qu'ils connaissent déjà. Cette démarche, est tout sauf de l'objectivité.
Sur l'observation en microscopie en Haute résolution :
Je le dis tout de suite cette Haute Résolution (HR) n'a rien à voir avec les qualificatifs que l'on trouve sur certains appareils audio-visuels !
Il s'agit bien de la résolution du microscope (dans le sens de la Physique !) quand elle est à la limite des ressources de l'instrument.
Dans ces conditions d'observation, les lois de l'optique géométrique sont supplantées par celles régissant la diffraction, c'est à dire qu'intervient surtout la nature ondulatoire de la lumière.
Toute interprétation de l'image à cette échelle est à prendre avec précaution, notamment en se méfiant des réflexes acquis dans le monde macroscopique de tous les jours.
Entrons dans le vif du sujet !
Je vais résumer les raisons qui font que les expériences de Tissot ne sont pas ou difficilement reproductibles.
1-On ne connait pas l'état des échantillons AVANT les manipulations.
2-On ne connait pas les concentrations des solutions.
3-On ne connait pas la technique des coupes.
Ce que je crois, sans pouvoir en apporter la preuve, c'est que le point 2 est secondaire par rapport aux points 1 et 3.
Je pense que les fixateurs agissent vite s'ils sont bien employés et ne doivent pas modifier la turgescence de la cellule.
Par contre un fixateur trop faible pourrait bien permettre une modification de la turgescence avant de commencer à agir.
Par contre, dans la mesure où le fixateur remplit son rôle, c'est à dire qu'il fige en l'état la cellule, l'état de la cellule AVANT sa fixation, a bien entendu la plus grande importance.
De même on constate que de nombreux contenus cellulaires ont été perdus lors de la coupe, ce qui modifie l'analyse que l'on peut faire du procédé.
Qu’est-ce qui nous dit que des informations intéressantes n'ont pas été arrachées par le rasoir?
Tout à fait, sauf que 4%, c'est déjà beaucoup et considéré comme "costaud".Cela peut très bien signifier que la proportion de formol dans la solution fixante tombe donc finalement à 4% - comme vous l'avez d'ailleurs écritIl faudrait donc connaitre la composition des fixateurs employés à l'époque par d'autres et leur technique d'application dont absolument rien n'est dit comme la TAILLE de l'échantillon qui joue sur la vitesse de diffusion du fixateur et donc à quel moment il commence à agir à l'intérieur de la cellule.
Ensuite QUELLE partie de l'échantillon a été retenue pour l'examen et la publication.
Est-ce que les images retenues sont identiques aux autres images de la coupe ou est-ce que d'autres images, non conformes à la théorie de Tissot on été écartées?
Je signale pour le non-microscopiste que dans un échantillon on fait de nombreuses coupes et que dans chaque coupe, on peut voir de nombreux champs microscopiques.
Quelle est la représentativité des photos présentées?
Nous polariser sur les fixateurs peut nous faire passer à côté de nombreuses sources d'erreurs qui peuvent avoir lieu avant et après la fixation.
A quoi ressemble une cellule végétale fixée avec X ou Y% de formol ? d'acide osmique ? etc. Aboutirait-on alors à quelque chose qui ressemble, de près plutôt que de loin, aux observations de Tissot ?Il est totalement légitime de se poser cette question, comme le fait de vouloir refaire les observations de Tissot.
J'ai de manière dispersée, indiqué que cette expérimentation était difficilement envisageable.
- La première raison est justement la "croyance" en la vision "officielle" de la cellule" , c'est cette vision que je voudrais le plus défendre, tant elle est riche d'arguments, il est vrai peu connus du public.
Au niveau du public, c'est une question de croyance ou de confiance.
Il est infiniment plus simple de comprendre une théorie qui explique TOUT en quelques mots, même si elle est totalement farfelue, que d'étudier pendant des années la biologie moléculaire.
- La deuxième est purement financière.
Une coloration type hématoxyline sur coupe à la paraffine n'est pas à la portée de tout un chacun ( http://www.microscopies.com/DOSSIERS/PRATIQUES/TPM-3/COUPARAF%20.htm )
Je signale que ce sujet est directement inspiré du travail quotidien d'un service d' Ana-Path.
Alors expérimenter de nombreuses fois, avec de nombreux mélanges et concentrations ne me parait pas réaliste financièrement.
Sans compter que le tétroxyde d'osmium ne s'utilise pas en photonique, il est trop cher et surtout trop dangereux. On ne l'utilise qu'en microscopie électronique.
Sur la plasmolyse :
Ce document me semble très intéressant !
D'une part, il s'agit d'une expérience réalisable par tous, qui plus est, sans fixation !
Mais je suis très étonné par le résultat, tout au moins, par le dessin qui en est donné!
Je suis surpris qu'il y ait une relation entre les vacuoles de plusieurs cellules adjacentes ! Que j'ai coloriées en rouge.
Je ne vois pas du tout ce qui pourrait justifier d'un tel résultat.
Pour une fois, je donnerais raison à Yorin, sur l'intérêt qu'il y aurait eu à produire une photographie.
J'invite les microscopistes de ce forum de refaire l'expérience présentée ICI et à nous présenter des photos qui mettent en évidence ou non, ces mystérieuses relations inter-cellulaires.
Protocole rapide:
Prélevez de l'épiderme d'oignon comme chacun sait le faire, et mettez-le entre lame et lamelle.
D'un côté de la lamelle introduisez à la pipette soit une solution saline soit de l'eau distillée, vous récupérez le liquide de l'autre côté de la lamelle avec un buvard (pour ceux qui en ont encore !) ou un papier absorbant.
Faites cela l'oeil à l'oculaire (C'est mieux à l'écran vidéo) en vous faisant aider si nécessaire.
L'utilisation d'une solution de nitrate de sodium ou de nitrate de potassium n'aurait pas les mêmes effets sur la forme des vacuoles !
Je n'ai pas de réponse sur le "maillage" de cette photo, mais elle est beaucoup plus lisible que les autres présentées.
Je cogite ...
Cordialement.
-
Bonjour Doc, et tous,
Ce sujet est excellent !
Et ces dernières images très bien réalisées.
Je rappelle qu'il fait suite au sujet de Thibault sur la carotte.
http://forum.MikrOscOpia.com/index.php?showtopic=12199.
Le pigment responsable de la coloration de la tomate (en l’occurrence) est contenu manifestement dans des organites spécialisés appelés chromoplastes.
La question que l'on peut se poser à mon avis reste valable à l'échelle macroscopique et microscopique.
La coloration de l'ensemble de la cellule, est-elle due à la présence de pigments le plus souvent cristallisés, localisés à des structures spécialisées ou bien existe-t'il en plus une répartition du pigment sous forme soluble dans l'ensemble du cytoplasme.
Dans la négative: est-ce que les cristaux de pigment, illuminés par l'éclairage du microscope, n'agissent pas à leur tour comme des sources lumineuses éclairant l'ensemble du cytoplasme, le rendant coloré.
Dernière hypothèse à vérifier, est-ce que cette coloration diffuse ne provient-elle pas d'une diffusion colorée au niveau du microscope lui-même?
Au niveau de la diffusion optique d'origine cellulaire:
La première photo de Doc, comme celle de Thibault (carotte) semblent aller dans ce sens: l'ensemble de la photographie, prend la couleur de la tomate (rouge-orangé) ou de la carotte (jaune).
Ce qui me chiffonne, c'est que les parties du champ (dans les deux cas) qui ne contient pas de cellule, est de la même couleur )
Un problème de balance des blancs ?, l'appareil photo ou la camera serait trompée par la coloration des pigments?
Ce qui est sûr, c'est qu'en Contraste de Phase et en Fond Noir, ce "phénomène de diffusion" n’apparaît pas !
Qu'en pensez-vous?
Cordialement.
-
Le protocole de Tissot.
- Analyse et conclusion.
Préambule:
Contrairement aux animaux qui se déplacent pour chercher leur nourriture (énergie), les végétaux doivent se dresser pour rechercher la lumière.
Cette fonction spécifique aux végétaux est due à la pression de turgescence exercée par l'eau à l'intérieur de la cellule.
Schématiquement ce phénomène de turgescence est mis en oeuvre de la manière suivante.
La cellule végétale proprement dite, le protoplaste, entouré comme les cellules animales, d'une membrane plasmique, est contenu dans une enveloppe semi-rigide la paroi cellulosique.
La pression de turgescence permet à cette enveloppe semi-rigide de se maintenir en extension.
Si cette pression diminue, l' enveloppe est un peu moins rigide.
Sur le plan concret, tout le monde (un minimum curieux) peut se rendre compte de ce phénomène.
Une plante privée d'eau, le Basilic que l'on conserve sur son balcon dans un petit pot, par exemple, commence à se flétrir, les feuilles se ramollissent et les tiges se courbent.
On dit que la plante à "soif" ! Un arrosage judicieux, va lui redonner son bel aspect antérieur.
D'un autre côté, quand on observe au microscope une cellule végétale vivante (sans fixation donc) on voit qu'une grande partie de son volume est occupé par un espace dépourvu d'éléments figurés qu'on a appelé la vacuole (vacum = vide). Dans certaines cellules végétales vivantes, on voit une seule vacuole ou bien plusieurs vacuoles plus petites. Des études ultérieures dont nous ne parlerons pas à ce stade, ont montré que cette ( ou ces) vacuole ont leur propre membrane appelée tonoplaste.
Disons pour l'instant que cet espace "vide" est occupé par de l'eau dont la pression, justement rend possible la turgescence.
Mécanisme de la turgescence :
Nous ne reviendrons pas sur le mécanisme de l'osmose déjà exposé dans le forum, mais c'est cette osmose qui rend possible la turgescence.
Nous avons donc une cellule (protoplaste) délimitée par une membrane semi-perméable (membrane plasmique) contenue dans une "boite" semi-rigide. C'est la chambre à air dans le pneu.
Quand nous arrosons le Basilic qui a "soif" avec de l'eau (quasiment pure ), l'eau est amenée au niveau de la cellule.
L'eau extra-cellulaire (amenée par l'arrosage) va traverser la paroi semi-rigide par des "pores", puis la membrane plasmique par osmose. ( Le milieu intra-cellulaire étant largement plus concentré que l'eau d'arrosage, et d'autant plus concentré que la plante à "soif" !)
Ceci provoque , une augmentation du volume de la cellule, et comme ce volume est limité par la paroi cellulosique, il y a une augmentation de sa pression interne.
Dans ces conditions, une cellule végétale nue (protoplaste) , c'est à dire privée de sa paroi externe cellulosique, éclaterait !
Si la mise en évidence de cette fonction de turgescence de la cellule végétale est évidente pour tout jardinier, dans nos écoles, elle est mise en évidence en trempant des frittes de pomme de terre crues dans des solutions de différentes concentrations.
Dans l'eau pure, les frittes s'allongent.
A l'inverse, si on plonge une cellule végétale dans un milieu hypertonique (par rapport à son milieu interne), le volume d'eau diminue par osmose (fuite d'eau) et sa pression interne baisse, sa paroi plasmique se décolle de la paroi (cellulosique). Voir l'image en balayage du message précédent.
Bien entendu, touts les stades entre la plasmolyse totale et la turgescence maximum sont possibles.
Justification de l’existence des vacuoles ?
Dans le schéma précédent, je n'ai pas parlé de vacuole.
Imaginons que le principe de la turgescence/plasmolyse se fasse directement dans la cellule sans l'intervention d'une vacuole.
TOUT le contenu du cytoplasme serait soumis à des étapes de dilution/concentration, d'une grande amplitude, incompatibles avec le fonctionnement du métabolisme.
En isolant l'eau de turgescence à l'intérieur d'une membrane ( tonoplaste ), seule la vacuole change de volume et de concentration ionique, préservant l'ensemble du cytoplasme de ces variations assurant un métabolisme optimal.
CONCLUSIONS :
Le protocole présenté ne permet pas de reproduire l'expérience, parce qu'il manque des précisions sur les concentrations exactes des produits utilisés.(voir le post précédent)
Nous avons vu l'importance de la concentration des solutions dans lesquelles on plonge une cellule sur la répartition des organites internes de cette cellule.
Une solution de fixateur trop concentrée peut aboutir à une rétraction du contenu cellulaire par fuite d'eau, mais je n'ai pas la preuve que ce soit le cas ici.
Comme dit Yorin, il faudrait expérimenter, mais le protocole n'est pas complet.
Mais le protocole n'est pas complet surtout, parce qu’il n'indique pas l'état de la cellule AVANT la fixation !
J'insiste sur cette condition: on ne sait rien de l'état de turgescence de la cellule AVANT la fixation.
En supposant que la fixation soit parfaite (respecte totalement les composants de la cellule ), cette fixation traduira l'état de la cellule juste AVANT la fixation.
Une plante qui a "soif" et une plante "rassasiée" ne donnera pas du tout la même image d'elle.
Un protocole est la règle du jeu dans une expérimentation scientifique.
Il faut que tous les protagonistes soient d'accord sur ce protocole et que se protocole soit suffisamment précis pour éviter toute erreur d’interprétation et éliminer les causes de falsifications.
Depuis Tissot, je dirais que l'esprit critique a eu d'innombrables occasions de se manifester, et les connaissances ont, dans le même espace de temps, considérablement augmentées.
Je ne pense pas qu'il y ait eu à l'origine de l'étude de la cellule végétale, une bonne technique de fixation oubliée, et une mauvaise, reproduite à l'infini de manière aveugle et obstinée.
Si la cellule végétale n'avait pas de vacuole, des milliers de faits constatés quotidiennement n'existeraient pas.
Les plantes n'existeraient probablement pas non plus. De plus ces fixations sont aussi utilisées pour les cellules animales.
Si cette affirmation (absence de vacuole) est vraie, TOUTE la biologie est à revoir.
Gloire et richesse à celui qui arrive à le démontrer, pour moi, il n'y a pas de doute.
Amitiés.
-
Le protocole de Tissot.
- L'inclusion
- La coupe
- La déparaffinisation
- La coloration
Le fragment fixé, puis lavé, a été déshydraté dans l'alcool absolu, puis traité par le toluène et enfin inclus dans la paraffine à l'étuve à 56° environ (paraffine de Péchelbronn fusible à 54°).La coloration a été faite sur coupes le plus souvent par l'hématoxyline ferrique, soit seule, soit suivie d'une coloration à froid par la fuchsine de Ziehl additionnée de 1/3, 1 /2 ou 2/3 d'alcool à 95°, ou par la fuchsine acide, ou l'érythrosine. En général, la colora¬tion a été faite par l'hématoxyline ferrique seule par les manipulations suivantes :
Les coupes déparaffinées ont été mordancées pendant une à 10 minutes dans une solution aqueuse d'alun de fer à 0,50 ou 1 % à la température de 40°, lavées rapidement à l'eau distillée, puis colorées à la température de 40°, pendant 10 minutes, dans une solu¬tion d'hématoxyline à 1 %, datant d'au moins un mois et obtenue en mélangeant, à 80 cc. d'eau distillée, 10 cc. d'alcool à 95°, 10 cc. de glycérine et 1 gr. d'hématoxyline ; enfin, elles ont été lavées rapidement à l'eau distillée puis immergées pendant 2 ou 3 secondes ou un peu plus, dans une solution de carbonate de lithium à 0,25 % pour transformer la coloration noire en une coloration bleu foncé et enfin lavées à l'eau distillée.
Dans certains cas, quand on a voulu obtenir une coloration progressive surveillée et arrêtée au point voulu, sans différentiation, le mordançage et la coloration ont été faits dans les mêmes solutions, mais à froid pendant le temps nécessaire, le mordançage étant fait pendant 30 à 60 minutes.
L'examen microscopique des coupes a été fait en général sans différenciation, mais quand celle-ci a été jugée nécessaire, elle a été faite, soit par une solution saturée d'iode dans l'alcool, soit par une solution de carbonate de lithium à 0,25 % ou par une solution d'alun de fer ammoniacal à 1 %, ou encore par l'alcool saturé d'acide picrique.
Dans la grande majorité des cas, les préparations ont été étudiées sans avoir subi aucune différenciation, la coloration par l'hématoxyline ferrique ayant surtout pour but de rendre visibles et très apparents tous les éléments figurés et la différenciation n'ayant visé pour l'étude du cytoplasme qu'à rendre plus perméables à la lumière les points trop fortement colorés.
L'inclusion : RAS
Coupes:
Par contre rien n'a été dit sur la technique des coupes. (matériel utilisé, épaisseur)
Au vu des photos, beaucoup de cellules ont perdu leur contenu.
Coupes trop fines, trop fragiles, mauvaise manipulations lors de la coloration, sont des causes paussibles.
Mais j'insiste, cela ne compromet en rien l'analyse des cellules restées intactes.
Colorations :
Ce chapitre ne pose pas de problème.
A mon avis les indications données sont suffisantes.
Ces séries de colorations me paraissent poussées et ont pour but d'après l'auteur de de rendre visible TOUS les éléments figurés du cytoplasme.
Et je ne doute pas un instant que Tissot y soit arrivé.
A la lecture du protocole,je n'ai aucune raison de mettre en doute l'efficacité de ses colorations.
Par contre, aucun des éléments figurés de la cellule, visibles en microscopie photonique, n’apparaît sur les photos présentées.
En particulier, les mitochondries dont on a tant parlé, n'apparaissent pas.
Le problème provient à mon avis de la mauvaise qualité de la reproduction des photographies et un bon dessin aurait permis à l'information contenue dans ces préparations de traverser les années.
Cordialement.
-
Le protocole de Tissot.
- La fixation
Des essais très nombreux que j'ai effectués avec les fixateurs les plus divers, j'ai tiré la conclusion que tous altèrent plus ou moins les éléments qui constituent l'organisation cellulaire ; cette altération existe même avec la fixation la plus réussie.Ce qu'il importe donc de rechercher, c'est un minimum d'altération et c'est seule¬ment par la détermination des proportions optima de substance dans le fixateur et de la durée optima de son action sur le matériel étudié qu'on peut y parvenir. Cette recherche étant effectuée sur plusieurs fixateurs, on arrive, en choisissant le plus favorable, à obtenir une conservation de la structure cellulaire suffisante pour l'étude.
Malgré ces déterminations préalables, les résultats des fixations sont irréguliers, sans qu'on en perçoive la cause ; c'est un fait connu. Aussi au cours des recherches et malgré les déterminations préalables, j'ai souvent pratiqué des fixations simultanément sur des fragments semblables du même matériel soit avec des concentrations différentes du fixa¬teur, soit avec des durées de contact variables, 1, 2, ou 3 jours..., etc., quelquefois beaucoup moins.
La fixation a été opérée en général soit par une solution de formol seul à 10 %, rare¬ment avec une moindre proportion (6 à 10 %), soit avec une solution de formol à laquelle ont été ajoutés les constituants du liquide de Ringer. Très souvent les fixations ont été faites simultanément et comparativement sur le même matériel avec le formol bichromate (Regaud). Mais en général ces préparations n'ont pas été utilisées en raison de la défec¬tuosité des résultats.
Bien que ne parlant pas de la technique de coupe, matériel et épaisseur, ce protocole me semble assez clair pour pouvoir l'analyser.
Malgré ces déterminations préalables, les résultats des fixations sont irréguliers, sans qu'on en perçoive la cause ; c'est un fait connu.
Cette déclaration de Tissot est tout à fait honnête et nous donne une indication sur l'état des connaissances sur la fixation de l'époque.
Je pense que certains éléments de la technique n'étaient pas maîtrisés faute de connaissance suffisantes.
Pour réaliser une fixation reproductible, il faut tenir compte des trois facteurs suivants :
la molarité
la concentration ionique
le pH
Je ne suis pas certain que toutes les conditions nécessaires à une bonne fixation soient intégralement respectées dans le protocole, mais seul un chimiste (que je ne suis pas ) pourrait bien répondre.
La fixation a été opérée en général soit par une solution de formol seul à 10 %
D'après le PDF cité plus haut (Jussieu) en microscopie photonique est considéré comme doux le formol à 1% et énergique à 4 %
Tissot utilise du formol à 10% ! (1)
soit avec une solution de formol à laquelle ont été ajoutés les constituants du liquide de Ringer.
Je suppose qu'au niveau formol il s'agit toujours de 10% ?
quant au liquide de Ringer, il en existe deux de composition différente, une pour les animaux à sang chaud, l'autre pour les batraciens.
La solution de Ringer fait partie des sérums physiologiques, encore faut-il que l'on précise physiologique pour quel type de cellule.
En effet le caractère de physiologique est un caractère relatif!
Physiologique est l'exact synonyme de isotonique .
Le caractère physiologique ou isotonique se définit par rapport à une autre solution séparée par une membrane semi-perméable.
Le Ringer est donc un liquide qui a la même pression osmotique que le contenu des cellules animales (selon la formule pour les animaux à sang chaud ou les batraciens) pas pour les cellules végétales.
Pour scrophulaire, le Ringer est hypertonique pour une cellule végétale et provoque donc une plasmolyse (la cellule se ratatine ou se ratatouille :) )
En fait une grande incertitude règne dans ce protocole car Tissot nous dit :
Une solution de formol, sans présiser la concentration on suppose à 10 % mais ce n'est pas certain.
à laquelle ont été ajoutés les constituants du liquide de Ringer OK mais pour quelle quantité totale (QSP) de liquide final ?
Donc on connait les constituants du fixateur, mais on ne sait rien des proportions
On ne peut donc pas reproduire ce protocole.
Ensuite certaines considérations me paraissent un peu "légères".
que tous altèrent plus ou moins les éléments qui constituent l'organisation cellulaire
on arrive, en choisissant le plus favorable, à obtenir une conservation de la structure cellulaire suffisante pour l'étude.
Mais en général ces préparations n'ont pas été utilisées en raison de la défec¬tuosité des résultats.
Tissot juge de la conformité de ses fixations par rapport à quoi? Certainement pas par rapport aux travaux des autres chercheurs.
Il estime que certains fixateurs sont meilleurs que d'autres et il cherche, et c'est légitime, le meilleur fixateur possible en se basant sur quel modèle de cellule?
La cellule à vacuoles ou sa cellule sans vacuole mais avec un réseau ?
C'est là le coeur du problème. C'est celui de l'objectivité du chercheur.
Est-ce que l'on prend ce que l'on trouve ou est-ce que l'on cherche à tout prix ce que l'on a envie de trouver.?
En fait je pense, mais je peux me tromper, que Tissot, cherche des arguments dans le dosage des fixateurs pour démontrer sa thèse plutôt que d'essayer de comprendre pourquoi les fixateurs donnent des résultats différents.
Quel est le critère qui lui fait dire que tel fixateur est BON et que tel fixateur est MAUVAIS si ce n'est la conformité du résultat obtenu par rapport à ce qu'il cherche à voir?
Qu'en pensent les chimistes ?
Cordialement.
(1) Un élément qui peut ajouter une incertitude supplémentaire au protocole est le suivant :
Le formol du commerce est une solution de méthanal à 40 % . On ne peut pas faire plus concentré (j'en sais quelque chose !)
Pour certains auteurs peu précis, une solution de formol à 10% est une solution du formol du commerce( à 40% donc), au dixième.
Ce qui fait que l'on a en fait une solution de formol à 4 % .
Quand je vous dis que ce n'est pas un protocole reproductible !
-
Bonjour scrophulaire,
Tout à fait !
Très bon cours !
Quand on étudie les méthodes de fixation, et c'est d'autant plus vrai que l'on veut voir de fins détails (microscopie électronique) on doit tenir compte de la concentration molaire, de la concentration ionique et du pH.
C'est en effet une cellule en plasmolyse que l'on observe chez Tissot : alors comme fixation douce ?
C'est pour cela que j'ai montré une cellule plasmolysée observée en balayage.
Du fait de la préparation la plasmolyse y a atteint une valeur extrême.
Chez tissot on doit observer une valeur intermédiaire entre la cellule normale et celle-ci, d'où cet aspect bombardé ?
Pour interpréter cette photo, je me suis en effet posé la question de la nature de la membrane décollée, celle de la cellule ou celle de la vacuole.
J'ai supposé que la membrane de la vacuole en ce rétractant entraînait avec elle la membrane cytoplasmique, mais je ne suis qu'un jeune ignorant dans ce domaine.
Il serait intéressant de voir avec de tels moyens, tous les stades de la plasmolyse, ne serait-ce que pour savoir si les filaments se prolongent à l'intérieur de la vacuole comme semblent le dire certains textes...
Cordialement.

















Le ScopePad-500
dans Appareils de prise de vue
Posté(e)
Bonjour,
Je vous présente aujourd'hui un "nouveau" système de prise de vue au microscope le ScopePad-500 de chez Hipower.
C' est le second modèle d' "appareil photo pour microscope intelligent" après le ScopePad-200
C'est une camera 5 Mpix classique couplée à une tablette.
Il semblerait qu'il existe deux déclinaisons, une tournant sous Androïd 2.3 , l'autre sous Windows 7.
L'intérêt est que vous visualisez directement sur une tablette qui vous permet à son tour de communiquer sur le Web ou bien de faire tourner d'autres applications
La qualité de l'image vaut, ce que vaut la camera, tout à fait classique.
Ces caractéristiques sont les mêmes.
Ce qui en fait l'intérêt, c'est la disponibilité des images directement sur tablette pour ceux qui en ont l'habitude.