-
Compteur de contenus
4 186 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Tout ce qui a été posté par Jean Marie Cavanihac
-
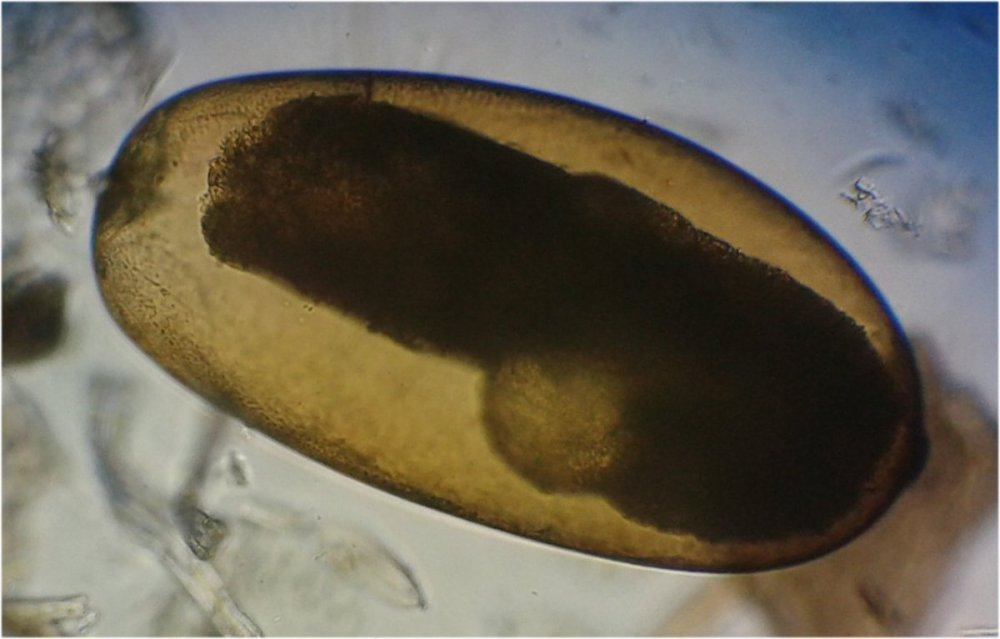
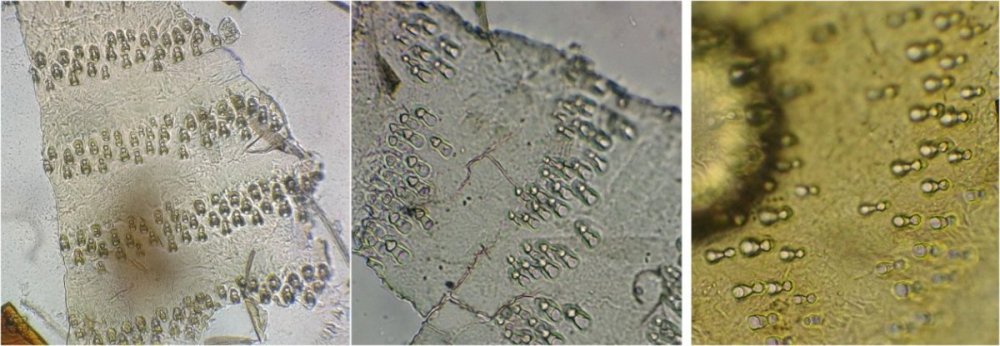
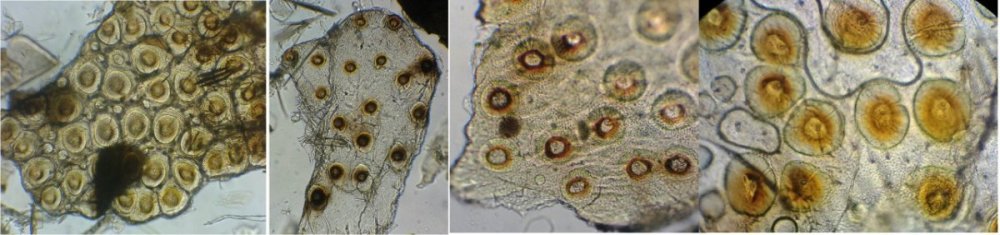
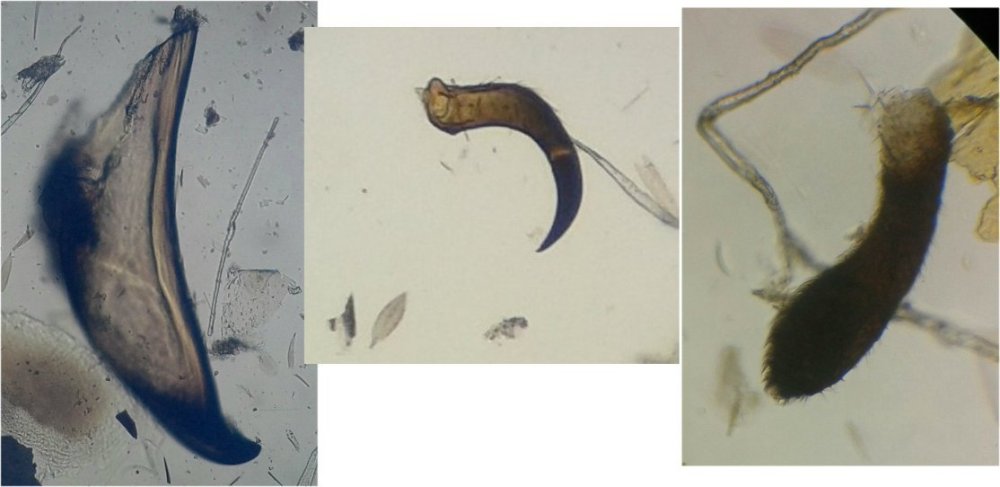
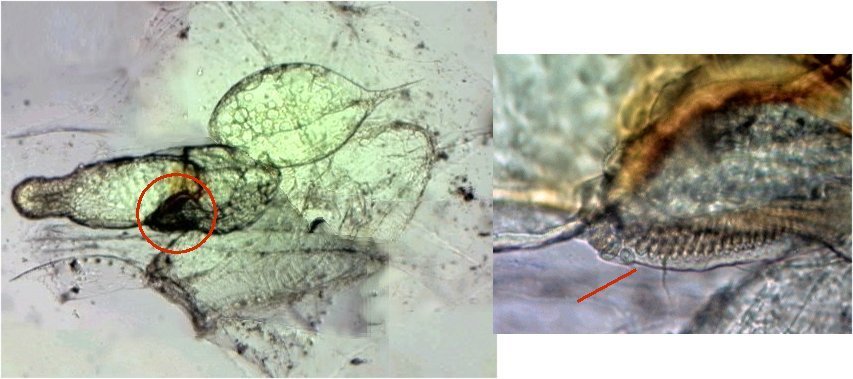
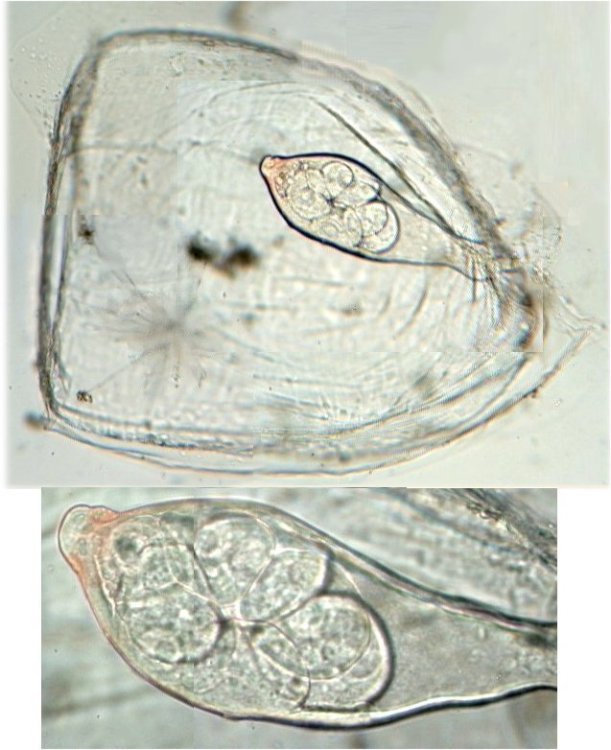
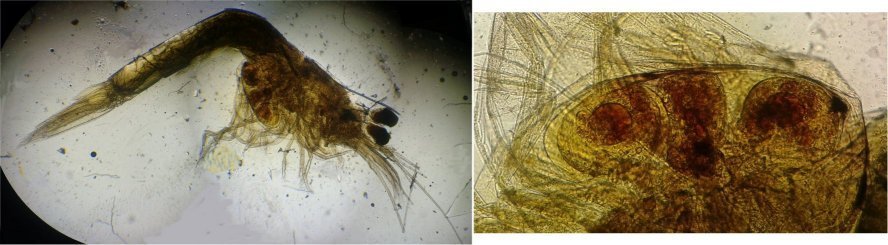
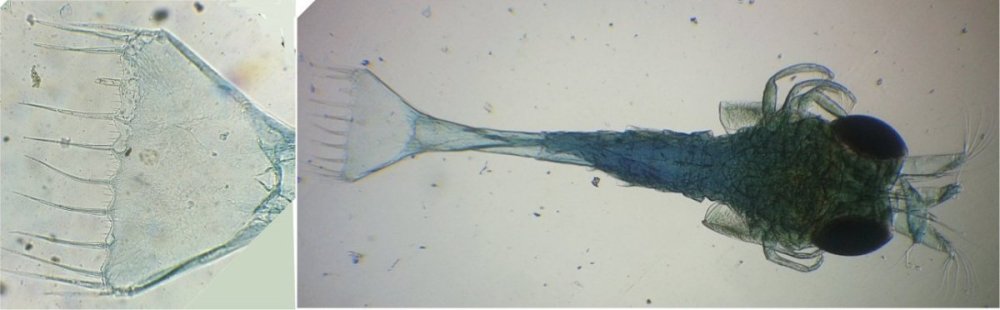
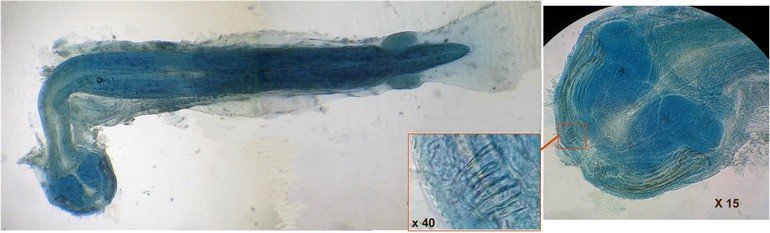
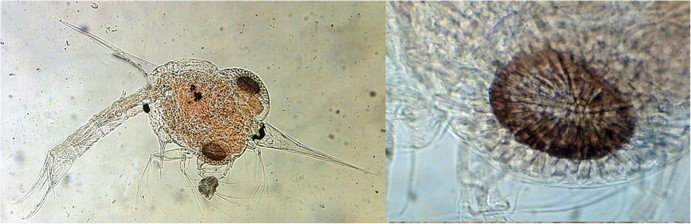
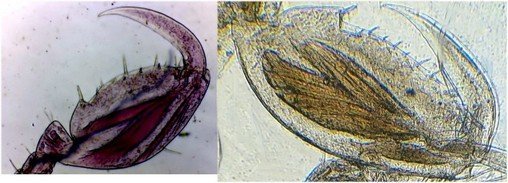
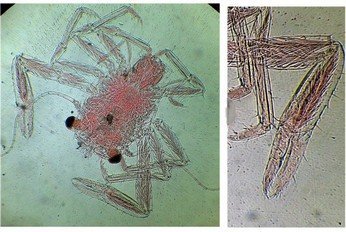
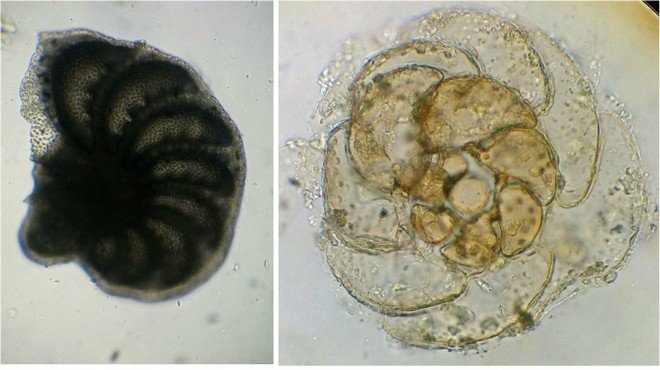
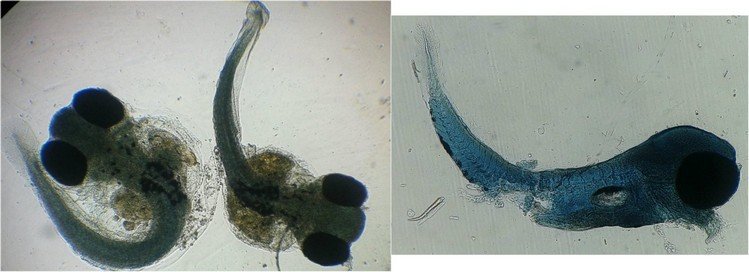
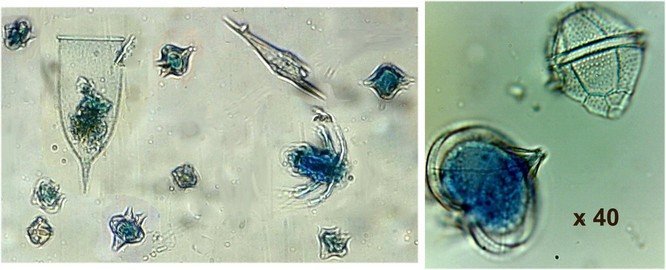
J’aurais pu intituler cet article « Vingt ans après » mais le titre est déjà pris Le but est de revoir - au moins 20 ans après leur réalisation -, diverses lames que j’ai montées selon le protocole suivant : - Fixation au picroformol de Bouin - lavage - ajout liquide glycériné laisser évaporer ou enlever le surplus par le coin d’un mouchoir papier - coloration (si utile) puis lavage - montage à la gélatine glycérinée ** (faite maison) sur platine chauffante - pose lamelle - rinçage lame à l’eau froide pour enlever la gélatine qui a débordé de la lamelle - scellement au vernis à ongle quand la lame est sèche Au début de mes observations, surtout de plancton, je souhaitais garder les sujets pour examen ultérieur, quand j’aurais eu plus de documentation sur leurs caractères spécifiques. La photo est un bon moyen, mais souvent les éléments d’identification fine n’y sont pas toujours visibles selon comment a été faite la mise au point lors de la prise de vue. Pour des sujets très transparents (et sachant qu’ils s’éclaircissent avec le temps ) j’utilisais deux colorants : l’éosine et le vert de bromocrésol ( un indicateur de pH virant bleu à pH=4) Rangement dans des boites faites maison avec du carton ondulé (5 boites comme celle ci ) ce qui fait dans les 250 lames à explorer. Noter la petite astuce consistant à repérer sur l’étiquette la position approximative du sujet sous la lamelle (surtout s’il y en a qu’un ) : point marqué par la flèche rouge. Bien entendu après plus de 20 ans les lames ne sont pas toutes en parfait état ! Les principaux défauts : rétraction de la gélatine qui n’englobe plus le sujet (récupérable, on le verra), développement de structures qui ne semblent pas être des moisissures (peut être des bulles ?), sujets non colorés devenus trop transparents …Par exemple cette anémone de mer encore visible mais entourée de ces structures Comment rajouter de la gélatine ? C’est assez facile avec la platine chauffante ci dessous (alimentée par le transformateur de la lampe du microscope). A gauche exemple de gélatine rétractée (flèches) sur une lame contenant un polype de méduse On gratte le vernis sur un coté de la lamelle au plus prés de la bulle, on pose la lame sur la platine et on ajoute un fragment de gélatine sur la partie grattée : celle ci en fondant s’infiltre par capillarité et on peut éliminer les bulles en tapotant légèrement sur la lamelle . Voici un effet non prévu du fixateur : le Bouin est acide (contient de l’acide picrique) et ramollit voire dissous les structures contenant du calcaire, d’où l’allure « mole » de cette larve d’ophiure (a droite spécimen vivant) .Donc attention ! Voyons les résultats sur divers sujets planctoniques et ce qu’ apporte l’examen à postériori de ces lames pour retrouver des détails qui ont échappé aux premières observations Voici une larve de galathéa. (espèce de crabe) l’observation des détails de la queue permet de préciser l’espèce Autre exemple : sur ce chaetognathe Sagitta : on voit très bien sur la tête les crochets de chitine mais la littérature fait état de dents antérieures et postérieures, dents antérieures que je n’avais pas vu et que l’on va retrouver dans le détail au X 40 Autre exemple encore plus intéressant de recherche à posteriori: j’avais remarqué sur cette femelle copépode ( calanus paracartia identifié à postériori sur cette lame ) un détail qui m’avait échappé : flèche rouge avec détail à droite : coloré en rose (sur l'image) on voit un spermatophore Lors de l’accouplement le mâle maintient la femelle grâce à une patte modifiée en pince et lui transfère le spermatophore qui va adhérer à l’abdomen de la femelle comme spermathèque et les spermatozoïdes contenus féconderont ses œufs en temps utile …voir ici les détails : https://forum.MikrOscOpia.com/topic/20108-reproduction-du-cop%C3%A9pode-paracartia-grani/#comment-83424 Autre sujet facile à conserver : radula de patelle ;La patelle, coquillage qui a la forme d"un chapeau chinois, possède (comme les escargots) cet organe chitineux qui lui permet de râper les algues Sur cette larve de crabe stade zoéa , le X 40 sur l’œil permet de voir les ommatidies A la longue les colorations à l’éosine, qui étaient uniformes, se différencient en se fixant sur les muscles ; par exemple sur ces gnathopodes de caprelles : peut être à cause d’un rinçage insuffisant du Bouin car l’éosine se décolore en milieu acide Idem pour cette larve de crabe stade mégalops : les fins muscles sont colorés en rose Avec le temps : le foraminifère de droite a perdu la matière minérale (acidité du Bouin sur le calcaire ? ) et on voit l’organisation des chambres , alors que l’autre est resté inchangé et peu transparent. Autre exemple de bonne conservation : ces alevins de poisson , sur celui de droite : on voit la vessie natatoire et les vertèbres (X 2,5) Bonne conservation pour ces vers : polychaete qui a beaucoup pâli à gauche et annelide Un dernier exemple avec ces dinoflagellées et ce tintinide Favella Voilà donc quelques exemples de montages à la gélatine sur des organismes marins. Je ne sais pas si les résultats seraient meilleurs avec le Baume du Canada, ou les résines synthétiques modernes. Je crains que les déshydratations préliminaires ne déforment beaucoup les échantillons. Un avantage de la gélatine est sa rapidité d’utilisation. Le procédé fonctionne bien avec les plantes et les coupes végétales. Mais ceci est une autre histoire …. * Note : une recette de gélatine de notre regretté Walter Dioni et d’autres milieux de montage https://www.microscopies.com/DOSSIERS/Magazine/Articles/WD-MILIEUX/Montage.html
-

Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour Dominique Bonne question ! Les copépodes sont ubiquistes; on les trouve dans tous les milieux aquatiques voire des flaques d'eau, eaux saumâtres etc . Il n'y a pas de différences morphologiques entre espèce marine et eau douce. Dans mes observations j'ai trouvé des cyclopoïdes (le plus commun étant le cyclops) dans l'eau douce et aussi en eau de mer, mais pas de calanoïdes ni harpaticoïdes dans l'eau douce (encore que je n'ai pas beaucoup de choix pour les sites en eau douce !) . Je pense que la densité des espèces est beaucoup plus grande en eau de mer ce qui facilite la capture en nombre. Ce qui m'a étonné c'est de rencontrer Tigriopus qui n'est pas référencé en Méditerranée . Merci pour ton appréciation sur la dernière image "live" (: on voit le flou des maxillipédes qui s'agitent) , mais il faut être rapide pour la prise de vue. ! Amitiés JMC -

Petite collection de copépodes marins
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
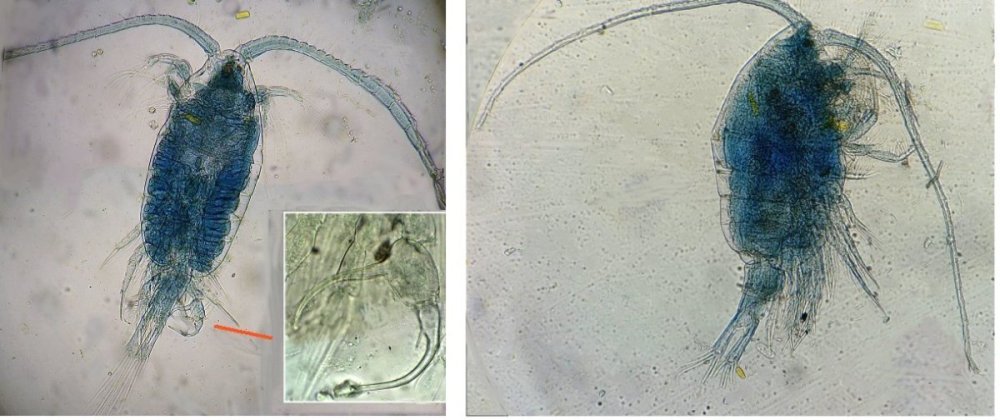
Suite ... Quatrième espèce : cette fois ordre des Harpaticoïdes : euterpina acufrontis : deux antennules courtes géniculées* sur le mâle à droite , rostre* bien visible sur la femelle mage de gauche détail d’une antennule mâle pliée et étendue et image à droite : P5 de la femelle très semblable à celle du mâle. Sur ce spécimen mâle on distingue un spermatophore* qui n’a pas encore été transféré sur la femelle détail au x 40 Cinquième espèce : harpaticoïde qui m’ a été difficile à identifier : Tigriopus. (Tig pods) Il en existe une quinzaine d’espèces. Leur couleur jaune est due à un pigment orange (astaxanthine) qui est synthétisé pour les protéger des rayons UVA et UVB du soleil, car les zones à faible profondeur (flaques) où ils vivent sont soumises aux rayons solaires. Les antennules, qui possèdent des détecteurs chimiques, permettent au mâle de reconnaître les propriétés chimiques d’une femelle en période de reproduction. On remarque les antennules du mâle de forme très caractéristique qui aident à l’accouplement et aussi la présence de maxillipèdes* chez les deux sexes. On voit bien le sac ovigène chez la femelle . Détail des antennules du mâle image de gauche (on y distingue des poils sensitifs ) et à droite un des deux maxillipèdes objectif x 40 Il semble que cette espèce soit plus rare en Méditerranée : je ne l’ai pas trouvée dans « Faune de France biblio Ref 3 ni sur Ref 4 (base de donnée française importante )» mais seulement chez « G.O. Sars – Ref2 ». L ‘espèce est sensée se trouver sur la cote Ouest de l’Europe mais ces spécimens ont bien été recueillis en Méditerranée ! Lexique : Antennule : Le plus antérieur des appendices pairs des crustacés, formé d'une base contenant un statocyste et de deux fouets, aux fonctions tactiles. L'une des fonctions de l'antennule est la détection de la nourriture, des mouvements de l'eau, des prédateurs Géniculée : avec une articulation rappelant celle du genou Spermatophore : une capsule contenant des spermatozoïdes créée par les mâles de diverses espèces , et transférée dans ou a proximité de l'ovipore de la femelle pendant l’accouplement Ovipore : organe sexuel femelle en forme de pore qui est inséminé par le spermatophore déposé par le mâle Maxillipède : Le maxillipède (littéralement « pied-mâchoire ») est un appendice du péréion (ou thorax) modifié chez certains crustacés et impliqué dans la nutrition. Le maxillipède est une sorte de « patte » thoracique qui a été transformée et qui sert à la mastication . Rostre : Prolongement pointu, vers l'avant du corps chez les insectes et crustacés Pour terminer et montrer la beauté d’un copépode vivant voici une image en fond noir pour s’exercer à la détermination : quel ordre, mâle ou femelle, espèce ?? Les indices sont ci dessus ! JMC -

Petite collection de copépodes marins
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
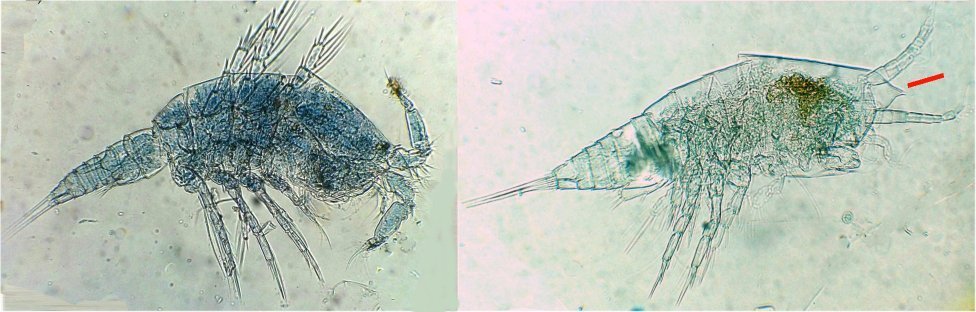
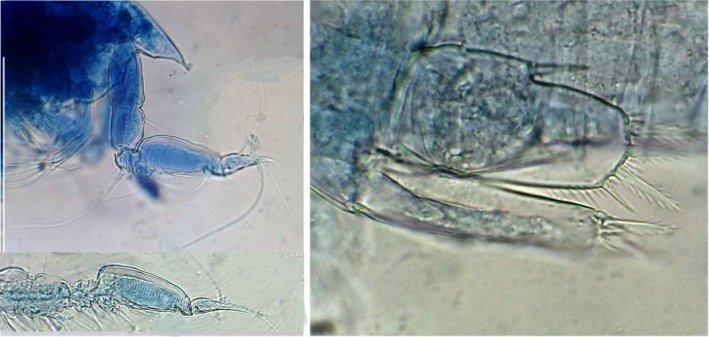
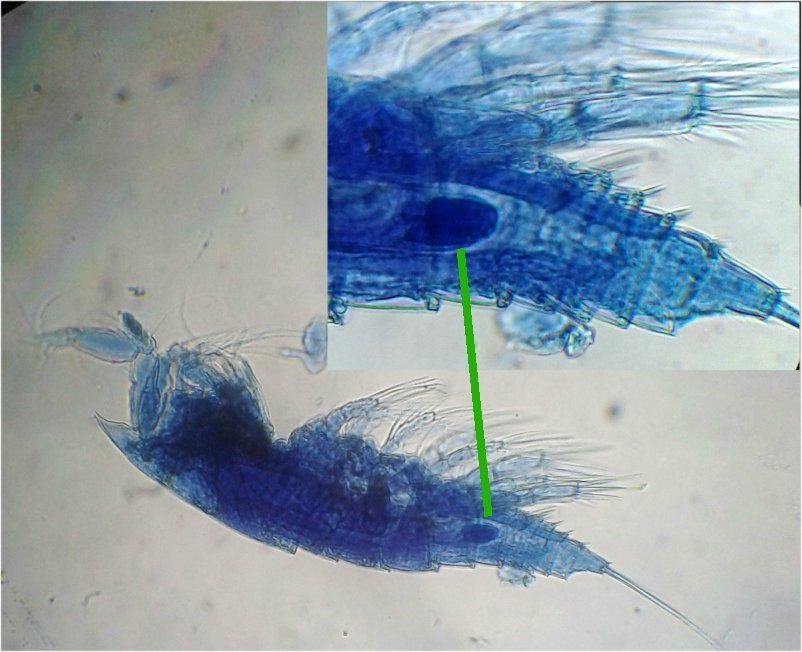
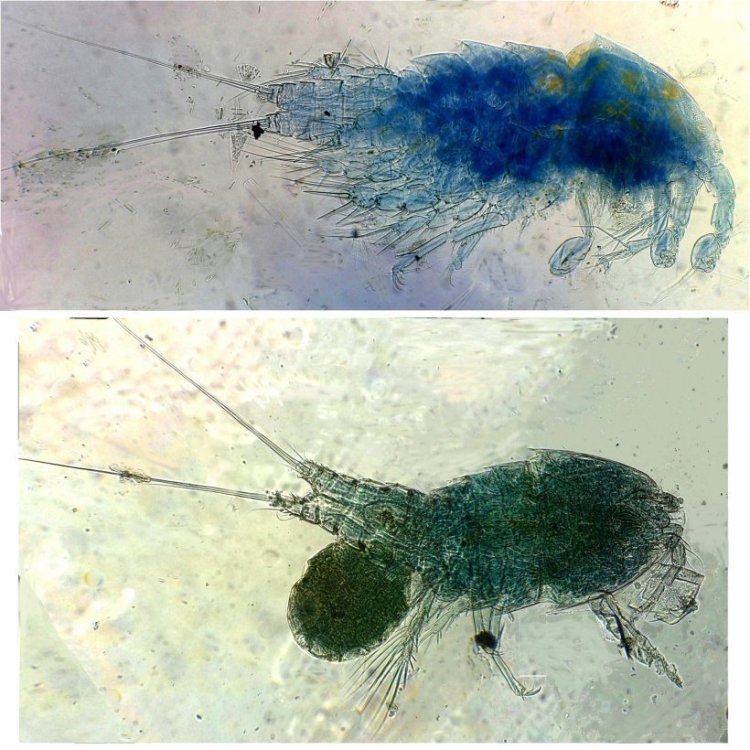
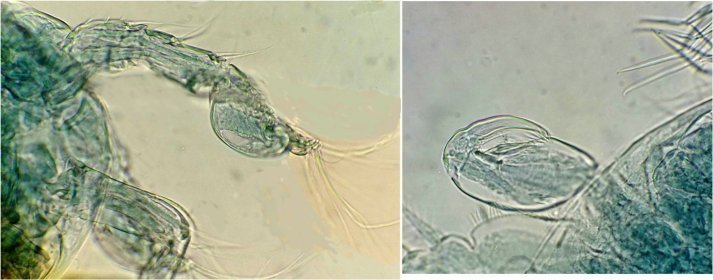
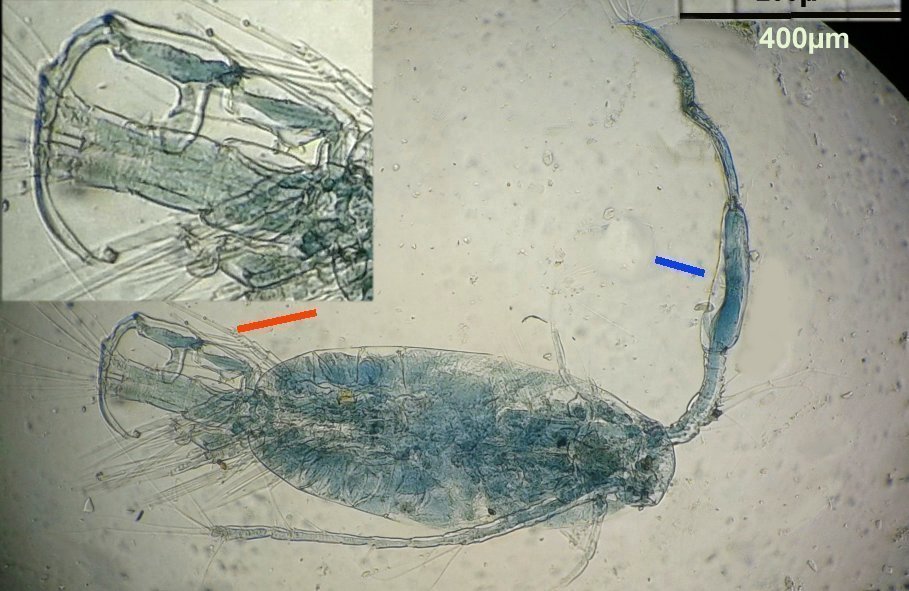
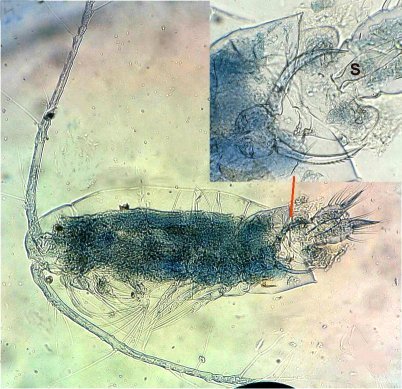
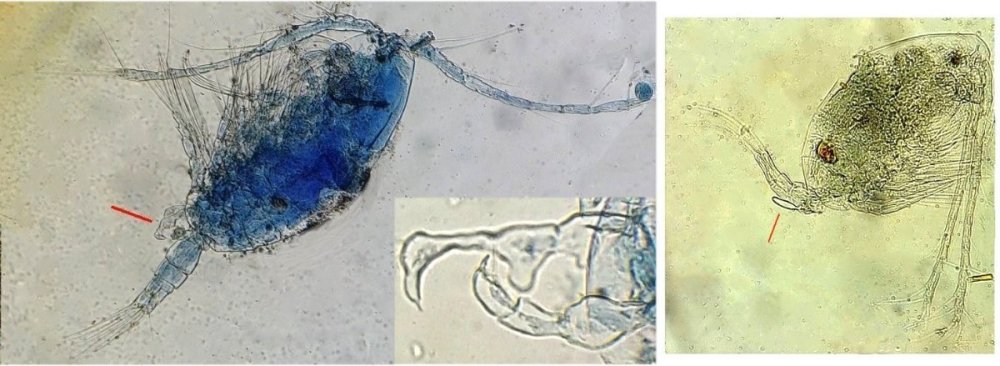
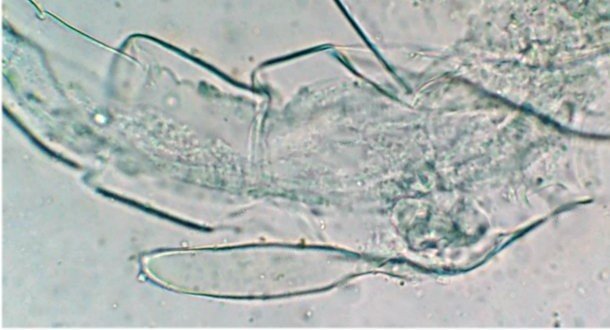
Les copépodes, sont de petits crustacés, qui constituent une grande partie du zooplancton ; ils représentent 12000 espèces où l’on distingue 10 ordres . Dans les prélèvements au filet à plancton (ici maille de 200 µm), le nombre de copépodes recueillis est très important en particulier les mois d’été. En prenant quelques précautions : conservation au frais de l’échantillon et observation rapide (entre 2 et 3 heures après prélèvement), de nombreux spécimens peuvent être observés vivants. Cependant en raison de leur nombre élevé, la concentration en oxygène baisse rapidement dans le flacon et vient ralentir leurs mouvements : il tombent au fond en constituant une « soupe » de copépodes et le prélèvement d’une seule goutte de ce dépôt ramène plus d’une dizaine de spécimens sur la lame. Dans l’image ci dessous , il faut donc diluer ! Ce grand nombre de spécimens va permettre de les figer en diverses positions et sur la quantité présente on peut trouver le mâle et la femelle . Pour les conserver : fixation au picroformol de Bouin directement sur lame, coloration par le vert de bromocrésol (pas vraiment un colorant mais un indicateur de pH) et montage à la gélatine glycérinée. J’ai ainsi réalisé plusieurs lames sur plusieurs années successives . Ceci fait je remets les reste du flacon à l’eau pour nourrir les alevins de poissons ... J’ai un peu négligé de m’intéresser plus tôt aux copépodes car je recherchais des sujets plus rares. En reprenant 6 ou 7 lames, dont certaines datent de 20 ans, j’ai pu identifier plusieurs espèces homogènes en quantité dans les échantillons. Voici quelques définitions de la morphologie des copépodes qui vont être utiles pour la suite : de plus , dans le texte, les mots repérés par « * » renvoient au lexique en fin d’article L’une des lames observées montrait un spécimen de l’ordre des calanoïdes, reconnaissables à leurs longues antennules* ; dont une des pattes de la dernière paire (P5) était largement modifiée en forme de pince : Ce dimorphisme sexuel est adapté à leur reproduction. La flèche rouge montre P5 modifiée et la flèche bleue une autre caractéristique du spécimen mâle : la présence d’une antennule géniculée* utilisée dans l’accouplement. La femelle ne possède pas d’antennule modifiée, les 2 sont identiques . P5 en forme de pince différente de celle du mâle :voici la femelle et la pince en détail : (S : spermatophore * ) Il est recommandé de lire ces liens pour voir plus en détail les modalités d’accouplement. https://forum.MikrOscOpia.com/topic/20108-reproduction-du-cop%C3%A9pode-paracartia-grani/#comment-83424 https://forum.MikrOscOpia.com/topic/20116-copépode-calanus-arcatia-arcaturia-clausi/#comment-83460 Les deux autres spécimens ci dessous sont de l espèce acartia grani (Male à gauche et femelle à droite). La pince du male est similaire à celle de pacartia grani mais semble moins sophistiquée. (détail à l’ objectif x40) La femelle n’a pas de pince à la différence de celle de paracartia on voit sur l’image à droite le spermatophore * collé sur l ‘ urosome de la femelle (flèche rouge) avec détail ci dessous à l’objectif x 40 Troisième espèce : Centropages ordre des calanoïdes aussi . La pince du male (photo de droite) est plus fine. On remarque aussi l’antennule géniculée * sur la droite du mâle une épine asymétrique sur la femelle (flèche bleue) orienterait vers centropages hamatu ; noter l’ovipore * (flèche verte) -

Ce que mangent les hirondelles...
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
suite des ailles des enveloppes céphaliques / pièces buccales Un objet inattendu qui rappellerait un œuf Sur des thèmes voisins de cette « coprologie aviaire » voir aussi : https://forum.MikrOscOpia.com/topic/17024-fiente-de-pic-vert/#comment-67569 Amitiés JMC -
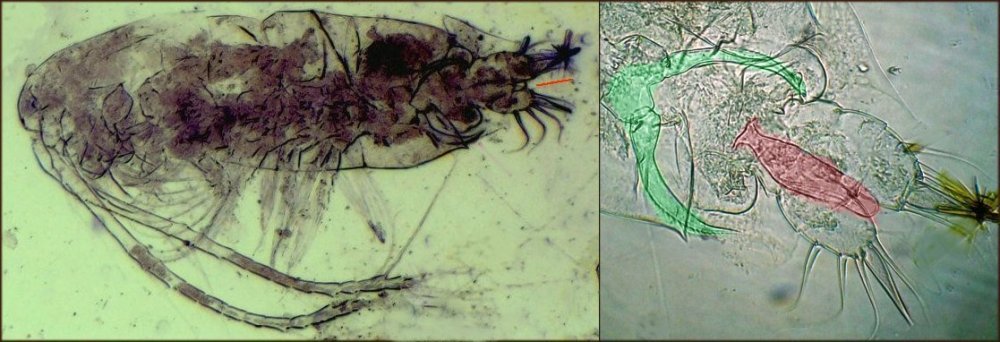
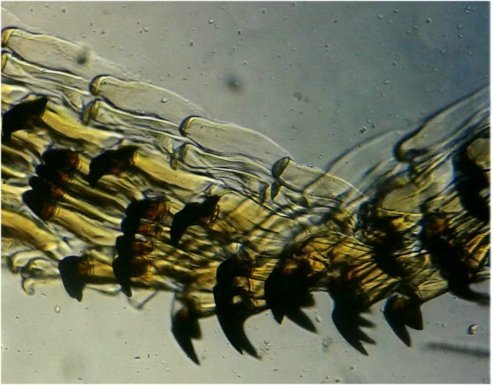
Il fait trop chaud pour aller chercher des échantillons, mais parfois ceux ci tombent littéralement du ciel ! En effet tous les matins des hirondelles tournent dans ma cour, se posent sur les fils à linge, gazouillent à tue tête, et parfois, en s’envolant, laissent un petit cadeau : Voici donc sur une feuille du figuier une fiente qui mesure environ 1,5 cm. En la diluant dans de l’eau , surtout la zone foncée, révèle un grand nombre de parties d’insectes. Sachant que les oiseaux n’ont pas de dents on peut s’interroger sur ce qui permet d’obtenir de si petits morceaux. Je pense que leur gésier doit contenir des particules de sable qui permettent la mastication. N’étant pas entomologiste pour deux sous, je ne m’avancerai pas sur l’identification des insectes ingérés, mais contrairement à ce qu’on pense ce ne sont pas que des moustiques ! Il peut être utile d’utiliser une mini goutte de liquide vaisselle pour aider à mouiller les morceaux de kératine . A défaut d’identification on peut toutefois regrouper les structures par fonctions . Sauf mention contraire les images sont faites au x 15 : Les écailles d’ailes : on remarque la présence d’écailles longues et fines provenant certainement d’ailes de moustiques mais aussi d’autres types d’écailles : Des fragments d’ailes où l’on distingue les pédicelles d’attache des écailles Voir ici : https://forum.MikrOscOpia.com/topic/19533-%C3%A9caille-des-papillons/#comment-81091 Des pattes difficiles à identifier car très morcelées des cornées faciles à reconnaître par leurs éléments hexagonaux des fragments d’épiderme ou d’élytres avec des ornementations circulaires et des poils aux centre de chacune des griffes / mandibules / palpes
-

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour à tous Jean Marc , on peut utiliser le LM338 qui va à 3 A ce qui est largement suffisant pour des Leds . Pour calculer le courant dans R1 la formule est 1,25/R1. (R1 en ohms). L'inconvénient est que toute l'intensité va passer par le rhéostat R1 qui doit tenir le coup... ça se trouve des rhéostats 2 W mais c'est un peu cher.Je préconiserait un commutateur 6 positions commutant des résistances de puissance (entre 1 et 2 w) sachant que c'est rare qu'on ait besoin d'un réglage très fin de la lumière...* Je peux faire un schéma si besoin Amitiés JMC * J'ai une alim simplifiée pour led 1 W avec 2 positions : Normal et Boost cette dernière position n'étant utilisée que pour le X 40 -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour En analogique il y a le LM338 K qui peut aller jusqu'à 5 ampères (3 A pour 338 sans K) et son montage en générateur de courant ci dessous.. On doit pouvoir remplacer R1 par un commutateur de plusieurs résistance supportant les intensités demandée; on n'a pas forcément besoin d'un réglage fin... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour vu sur ce site plusieurs types de radiateurs et même certains ventilés de petite taille . pour une LED 3 watts que l'on n'utilise pas toujours à pleine puissance cela doit suffire...Pour l'alimenter en courant continu c'est moins évident, les drivers "tout fait" sortent en courant alternatif.... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Je voudrais attirer l'attention sur le fait que ces petits modules d'alimentation ne sont pas des générateurs de courant . Une faible variation du réglage de la tension peut faire varier dans de grandes proportions le courant dans la led . voir ici https://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-LEDS-2/LEDS2.htm A défaut un fusible en série avec la LED me parait indispensable : par exemple pour LED 3 watts fusible 1,5 A, pour 10 watts 3,15 A ou 4 A etc... Amitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
Bonjour Jean Luc Moi c'est Jean-Marie (pas Jean Marc ! ) Le problème principal pour la LED c'est de pouvoir la positionner à la place de l'ampoule actuelle. Bien que la LED soit plus petite , il faut aussi loger son radiateur indispensable. Pour une remplacer une ampoule de 30 w on peut estimer qu'une LED 3 W (qui consomme 1 ampère) est suffisante. Les alims pour LEDS disponibles travaillent en courant constant mais en alternatif ! Il faut concevoir une alimentation filtrée en courant continu ou utiliser une alimentation de laboratoire réglable en courant. Il faudrait avoir une photo de l'ampoule en place pour voir si la transformation (réversible) est possible Pour Neat Image le principe est de prendre un échantillon de bruit seul sur une zone unie de l'image et de faire son spectre en fréquence puis le soustraire de l'Image. Probablement en utilisant la transformée de Fourier. Mais si on peut d'emblée obtenir une bonne image le post processing est inutile. AMitiés JMC -

Capture Rapide
Jean Marie Cavanihac a répondu à un(e) sujet de Jean-Luc Bethmont (Picroformol) dans Appareils de prise de vue
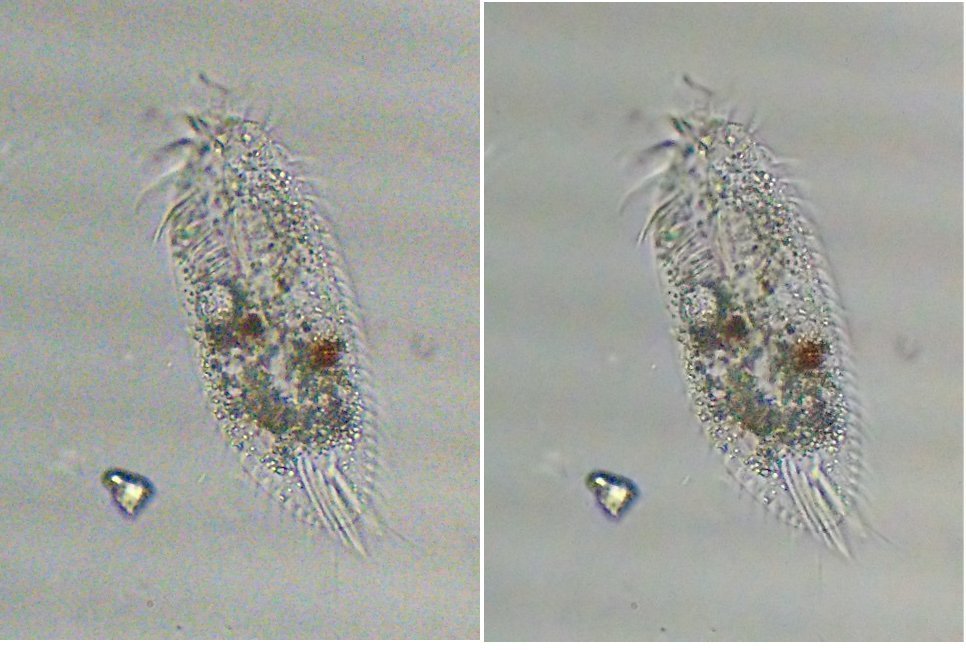
Bonjour Jean Luc Vraiment intéressante ta démarche , que l'on pourrait aussi appliquer au zooplancton vivant et qui m'intéresse à ce titre !. Pour le scintillement (et les barres sur les images) la solution serait de passer en éclairage LED alimenté en courant continu filtré , il pourrait être même possible au moment de la prise de vue de suralimenter brièvement la LED pour faire un pseudo flash (comme sur les téléphones) . Pour le bruit on peut utiliser Neat image dont voici le résultat avec la version gratuite et en prenant comme échantillon un rectangle en haut à droite de l'image: Amitiés JMC -

Exploration d'un bac extérieur rempli d' eau
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique L'algue filamenteuse n'est pas une cyanobactérie... Je pense à Geminella peut être , mais je ne suis pas très riche en algues d'eau douce ! Amitiés JMC -

Population de l'estran de la plage du Havre
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique Voisin dans ÉCOSYSTÈMES MICROSCOPIQUES
Bonjour Dominique Bonne initiative ! c'est intéressant de pouvoir suivre les populations au cours de l'année . On dirait que les premières images de la série sont en contraste de phase ? avec une certaine perte de résolution par rapport au fond clair me semble-t-il ... En parlant d'estran cela m'a rappelé ce site qui décrit pas mal d'espèces : https://nature22.com/estran22/estran.html Amitiés JMC -

Piles coulées
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Il me semble que les diodes laser rouges sont alimentés en 2,2 volts et environ 30 mA.. Elle sont chatouilleuses sur la régulation/limitation du courant (risque d'emballement thermique) . Démonte la platine et vois le cheminement du PCB ... peut être y a t il juste une résistance entre le laser et la pile ? A moins qu'il y ait du monde en CMS du coté cuivre ! D'ailleurs on ne voit pas d'où vient l'alimentation de cette platine... AMitiés JMC -

Le Mystère des dominos.
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Un grand classique des "dominos" ce sont les vis qui se desserrent avec le temps = contact intermittent qui charbonne = surchauffe ! Je ne vois pas de rapport avec le fil de terre cependant ... AMitiés JMC -

Piles coulées
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Peut être que le circuit sert a allumer alternativement l'un et l'autre laser...Essaye de nettoyer avec un pinceau et de l'alcool , retourne le PCB pour voir s'il n'y a pas une puce dessous, tu en prends une photo pour voir les pistes et on essayera de faire de la rétro ingénierie; il n 'y a pas beaucoup de composants, c'est jouable... Amitiés JMC -

Cochenille les dégâts sur les branches .
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique Je suis impressionné par tes coupes dans un matériau aussi dur. Et devant l'étendue des déformations je me demande s'il n'y aurait pas une bactérie injectée par les cochenilles ? Ce n'est pas trop dans l'intérêt du parasite de détruire sa source d'alimentation ! Amitiés JMC -

Diatomées indicateurs des pollutions métalliques
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique Voisin dans Diatomées (Discussions)
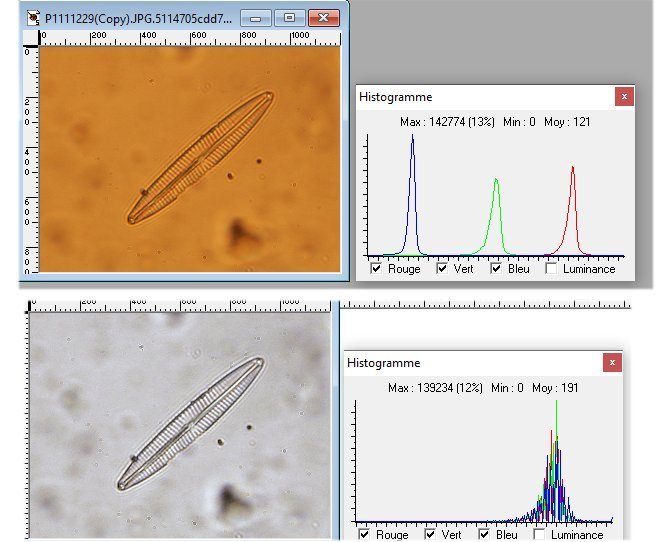
Bonjour Pour la balance des blancs : si microscope avec lampe halogène régler l'appareil photo sur lumière artificielle. Le réglage du condenseur n'agit pas sur la balance. Par contre fermer le condenseur améliore la profondeur de champ. Pour régler l'intensité de la lumière utiliser le potentiomètre de la lampe. Par exemple avec l'objectif 100 pousser la lumière a fond et fermer le condenseur. Mais les images sont récupérables ! voir ici : Voici le résultat : en jouant sur l'ajustage des 3 canaux et l'étirement de l'histogramme : Amitiés JMC -
Bonjour Dominique Je suppose que les images sont faites au Tomlov. La coupe colorée à l'acridine est magnifique ! Amitiés JMC
-

siphonophores
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
C'est le problème ! On n'a pas de référence pour déterminer la taille surtout dans les images sous marines . D’après la littérature, la plus longue chaine de zoïdes serait de l'ordre de 50 mètres...Je pensais aussi que la plupart des espèces étaient plus grandes mais sur des images scientifiques (avec échelle indiquée) on reste de l'ordre de 1 à 5 mm pour la taille des zoïdes, bien sûr la tige peut être bien plus longue...J' ai mis une échelle sur l'image de la cloche de muggiaea, les autres images sont à la même échelle. Les images partielles étaient faites à l'objectif X 6,3 Amitiés JMC -

siphonophores
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour Ce qui m'a frappé c'est leur taille. On voit des images prises par des plongeurs mais on les croit plus grands qu'ils ne sont. Cela m' a été un peu difficile de retrouver des images partielles prises il y a 23 ans avec la caméra vidéo analogique petit champ et de reconstituer les individus entiers. A l'époque je n'avais aucune idée de ce que c'était et j'ai surement loupé des détails sur lesquels j'aurais pu faire de plus forts grossissements ! Mais ce sont des animaux fascinants et bioluminescents en plus... Pour la petite histoire chaque année des quantités de vélelles (un autre siphonophore à flotteur aérien de quelques cm) s'échouent pas loin de chez moi, il faudra que je tente d'en récupérer ! Amitiés JMC -
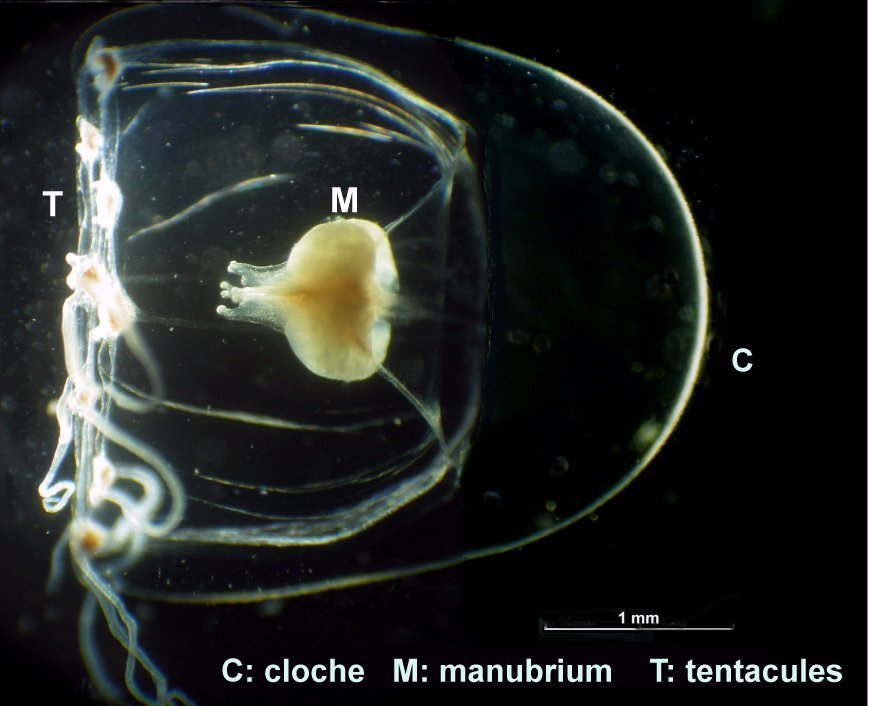
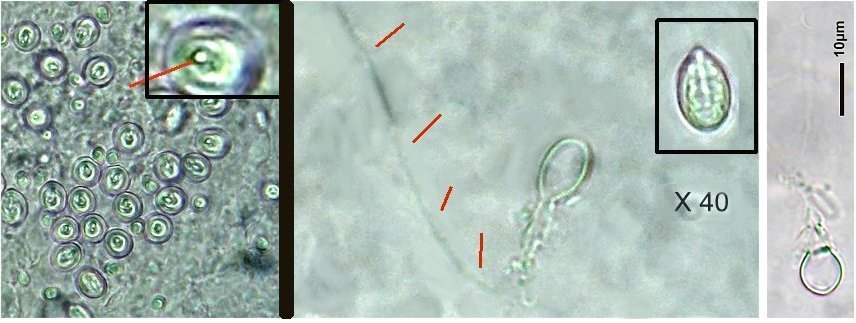
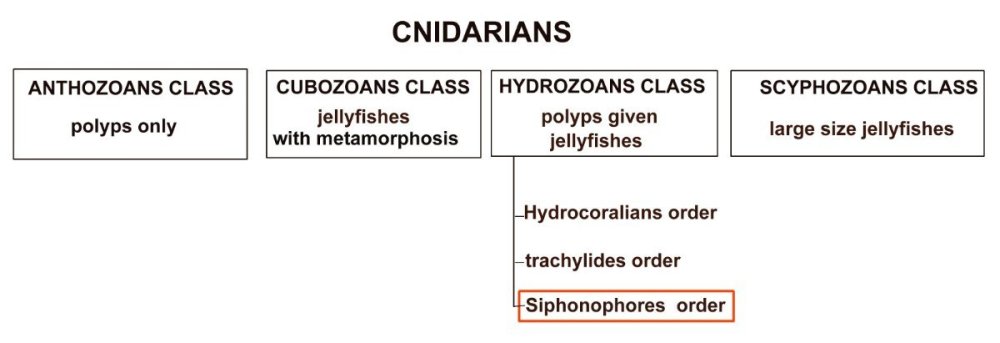
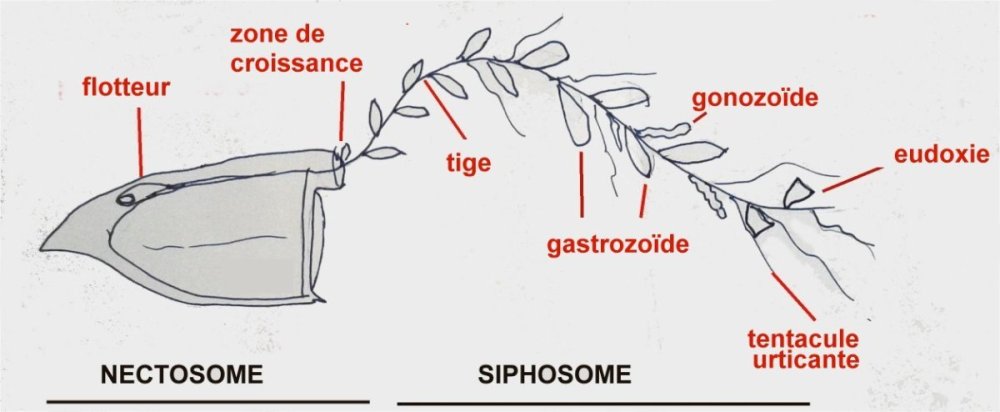
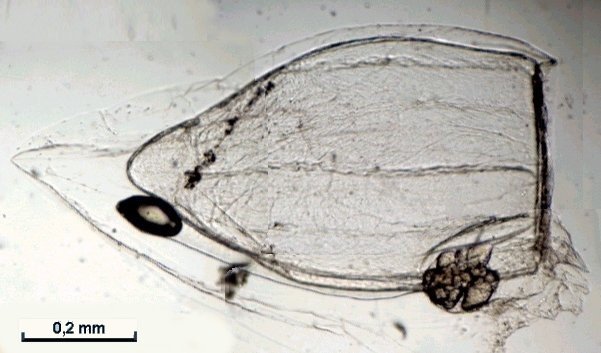
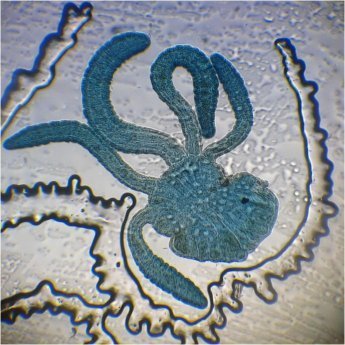
Les siphonophores sont un embranchement des cnidaires, et leur nom signifie en Grec « qui porte des tubes ». Tous les cnidaires ont une caractéristique commune : la présence de cellules urticantes : les nématocystes. Voici un exemple de cnidaire sous la forme d’une microméduse probablement Turritopsis nutricula . Elle n’est PAS un siphonophore Les tentacules portent les nematocystes sous la forme de cellules spécialisées contenant un filament enroulé en spirale et terminé par une sorte de harpon. L’éjection du harpon est commandée par le contact de la proie avec un cnidocil qui sert de déclencheur. Le harpon injecte une substance qui paralyse la proie. A gauche nematocysts vus de dessus et en détail (flèche) la position du cnidocil. A droite cnidocystes déchargés les flèches indiquent le long filament que l’on devine enroulé en spirale dans le détail encadré de droite L’étude et l’identification des siphonophores sont rendues difficiles par leur structure et les diverses phases de leur évolution. De plus leur corps gélatineux est fragile et il est difficile de les capturer complets. Une terminologie particulière a été développée pour décrire leurs composantes. Ce sont les plus complexes des cnidaires marins et leur grande diversité a engendré une systématique particulière basée sur des descriptions morphologiques Voici leur position dans l’ordre des cnidaires : Selon la configuration de leur colonie , les siphonophores peuvent être classés en trois groupes : les cystonectes, les physonectes et les calycophores. La colonie de cystonectes possède pneumatophore et siphosome (la chaine de zoïdes). Celle de physonectes a : pneumatophore, nectosome (les cloches nageuses) et siphosome. La colonie de calycophorans n'a pas de pneumatophore et possède nectosome et siphosome. Le pneumatophore rempli de gaz sert de flotteur pour la colonie. Situé au sommet de la colonie il l’aide à rester au bon niveau de flottaison et la maintien verticale. Le nectosome est la région composée du ou des nectophores qui propulsent la colonie.Le siphosome est la partie inférieure : longue tige qui porte les autres zoïdes spécialisés pour l'alimentation : gastrozoïdes, la reproduction : gonozoïdes et la défense : dactylozoïdes. Schéma montrant la configuration et les différentes parties d’ un calycophore : il faut imaginer la colonie verticale. Elle est constituée de plusieurs dizaines de zoïdes interdépendants répartis le long d‘une tige ou stolon, ce qui en fait de grands prédateurs Un spécimen de calycophoran : muggiaea : on voit vers le haut de la cloche à gauche non pas un pneumatophore mais une goutte d’huile. En bas à droite les premiers zoïdes Voici probablement une eudoxie = individu âgé qui se détache de la tige avec les trois types de zoïdes ; on y voit plusieurs structures intéressantes : gastrozoïde à gauche, somatocyst en forme de poire au milieu ; à droite détail à l’objectif X 15 de la partie sombre cerclée montrant une ébauche de tentacule avec des cnidocystes (flèche rouge) Une autre eudoxie gonophore ( de muggiaea ?) avec le manubrium contenant les embryons . Au dessous détail du manubrium avec sa pointe rose Images d’autres siphonophores ici (Physionectae ): https://www.researchgate.net/publication/384964925_Unexpected_diversity_and_novel_lineages_in_the_cosmopolitan_genus_Nanomia_Cnidaria_Siphonophorae_Physonectae Ces espèces ont des zoïdes et nectophores mesurant quelques mm. Une espèce bien plus grande est la Physalia (Portugese man of war) avec un flotteur aérien de plus de 10 cm et des tentacules pouvant atteindre 10 m. Son contact est dangereux même pour l’homme. Il est difficile de recueillir des spécimens complets de siphonophores au filet à plancton. La tige se rompt et les zoïdes sont perdus. Cela explique que les 177 espèces connues n’ont été que peu étudiées et parfois les eudoxies ont été considérées comme une espèce à part. Note : Mes images utilisées datent de plus de vingt ans sur des échantillons récoltés en mer à partir d’un bateau et je n’ai pas eu l’occasion d’en rencontrer d’autres depuis.
-

Nouvelles du pouce.
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Désolé pour toi, l'ongle devrait repousser, sa base n'est pas touchée , mais il lui faudra du temps... Amitiés JMC










.jpg.b10e939d859152a3e8b4e84a1184543e.jpg)