-
Compteur de contenus
4 186 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Tout ce qui a été posté par Jean Marie Cavanihac
-

Comment récupérer des images ratées
Jean Marie Cavanihac a posté un sujet dans Appareils de prise de vue
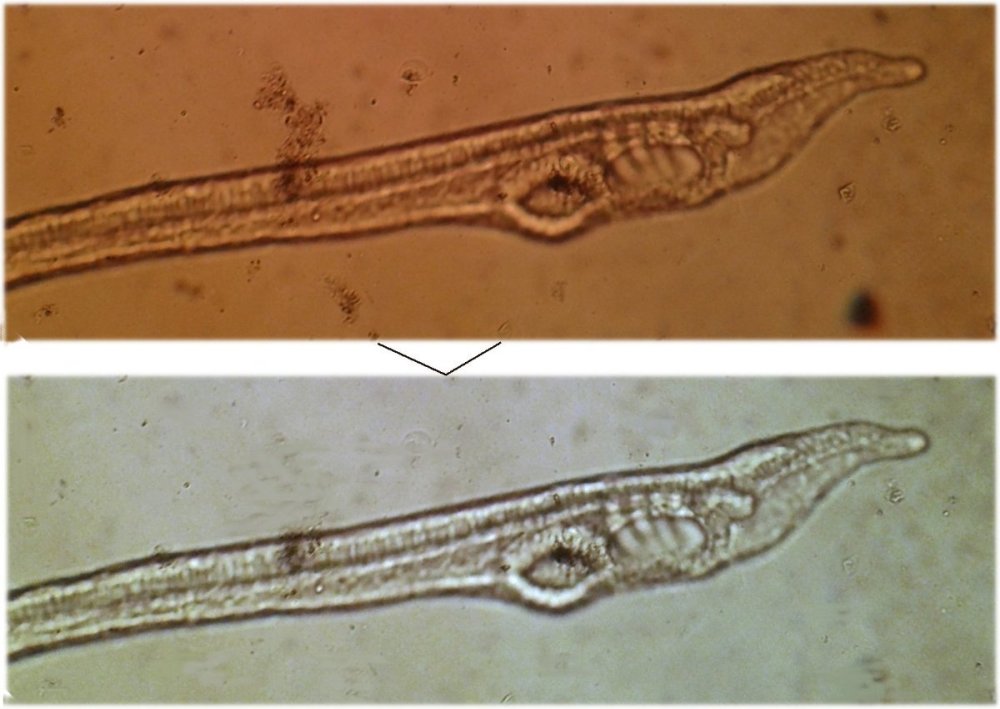
Bonjour Je ne vais pas re-inventer l'eau tiède, d'autant que les techniques décrites l'ont été dans divers posts, par divers participants mais j'ai pensé qu'il serait bien de les regrouper sur un sujet au titre facile à retrouver et illustrer les résultats qu'on peut obtenir. Exemple comment améliorer cette image de la tête d'un Amphioxus pour mieux voir la bouche ? le problème est que le sujet bouge, on baisse l'éclairage (ici à incandescence) pour ne pas le troubler ....(image du haut) et arriver à l'image du bas qui est plus acceptable ? vous le saurez en lisant ici : Amitiés JMC -
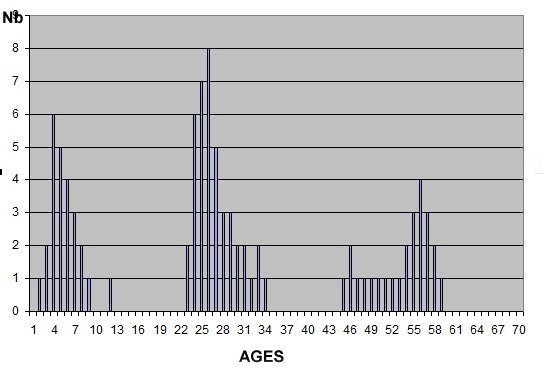
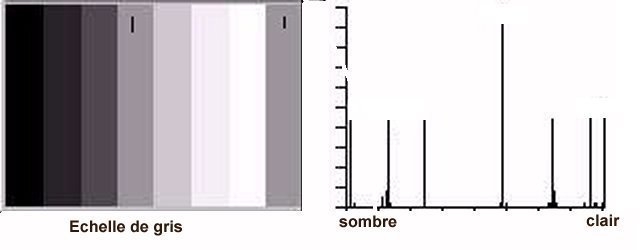
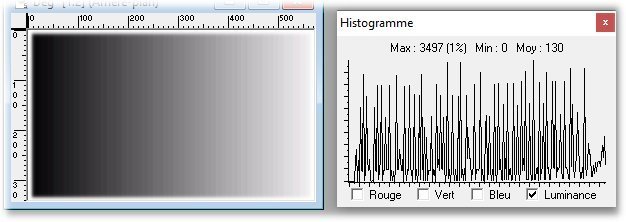
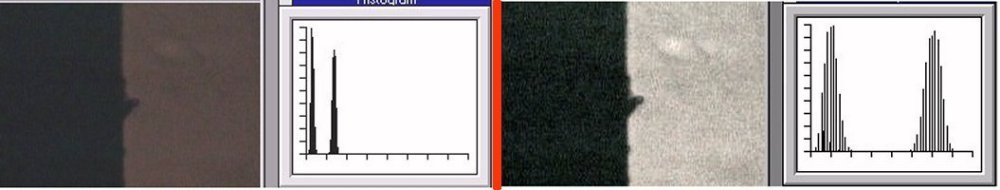
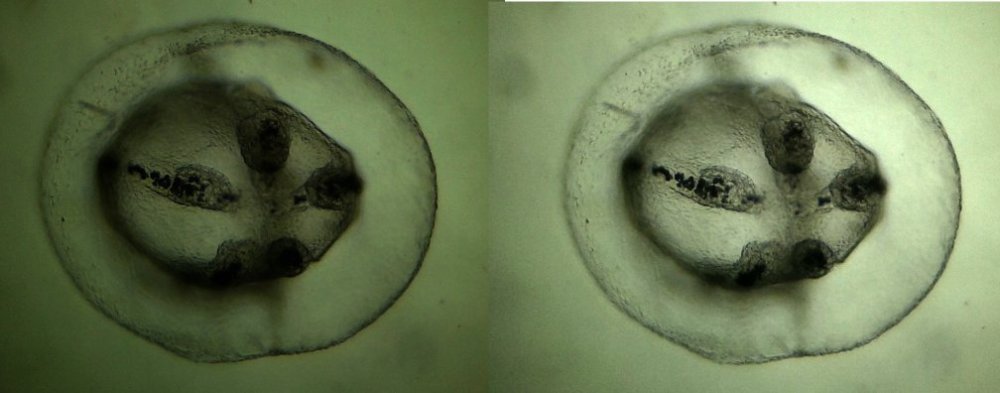
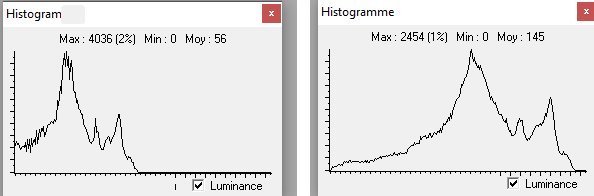
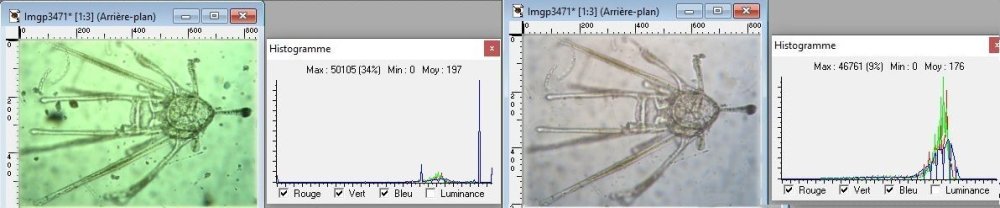
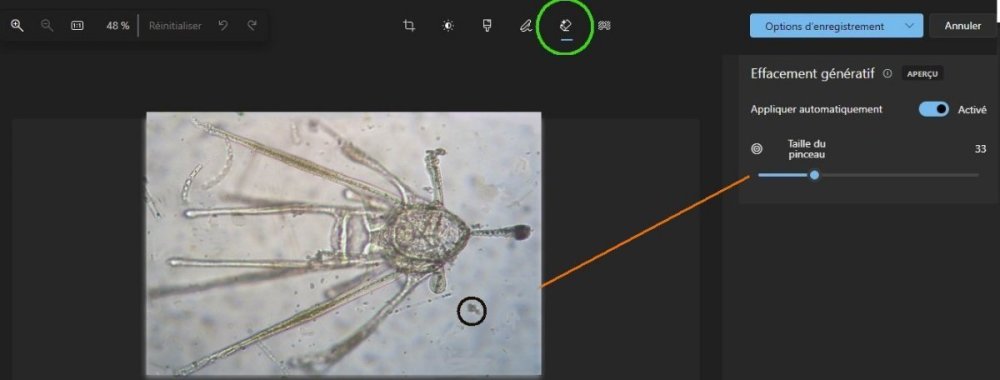
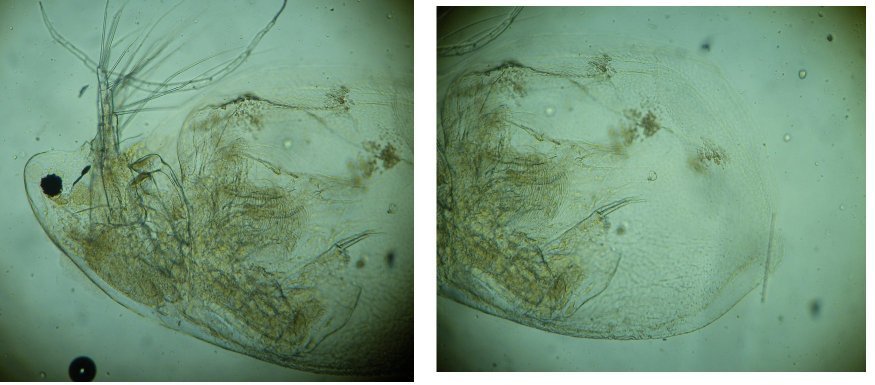
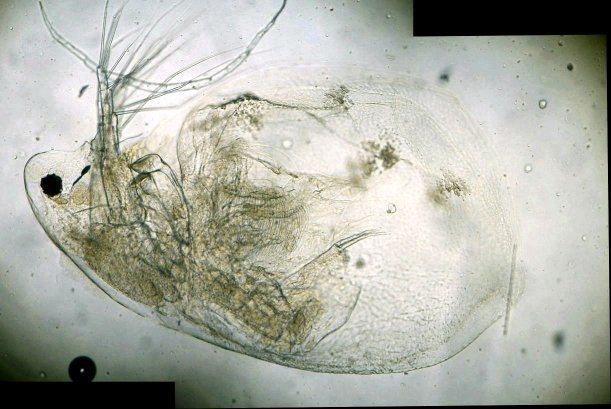
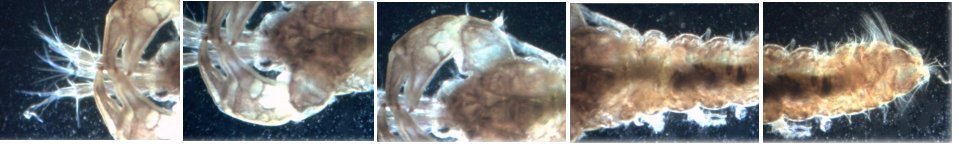
L’un de mes sujets favoris est l’observation du plancton – vivant- ce qui créé des contraintes particulières pour l’obtention de bonnes images : les sujets bougent et il faut les suivre en jouant sur la platine XY, faire la mise au point , ouvrir ou fermer le condenseur, prendre la photo… Je pense que le meilleur opérateur serait ...une pieuvre avec ses 8 bras ! Cela explique que certaines images ne sont pas de bonne qualité : par exemple trop sombres, ou avec dominante couleur car l’appareil photo n’a pas eu le temps de faire la balance des blancs etc ...mais on veut conserver ces images d’un spécimen rare . On va voir que l’on peut atténuer quelques défauts en utilisant des fonctions logicielles qui n’ajoutent pas de pixels à l’image d’origine. En effet certaines fonctions ré échantillonnent l’image en créant de nouveaux pixels. Un bon conseil est de toujours garder l’image originelle et de faire les traitements sur une copie. Nous allons commencer par une fonction très pratique et rapide : l’étirement de l’histogramme en un clic. L’histogramme est un outil statistique montrant la répartition d’une population. Mais d’abord un petit exemple pour illustrer ce qu’est un histogramme : prenons le cas de l’age de spectateurs lors d’une séance de cirque en famille : on regarde l’age de chaque spectateur et on lui affecte une colonne dans le graphe ci dessus . Si 8 spectateurs ont le même age par exemple 26 ans , la colonne aura une hauteur de 8 éléments. Sur le graphe on voit 3 pics : le premier à gauche correspond aux ages des enfants de 2 à 13 ans, celui du milieu à l’age des parents et celui de droite à l’age des grands parents accompagnant : en horizontal les classes d’age et en vertical le nombre de présents dans chaque classe Transposons cette représentation pour les niveaux d’éclairement d’une image : on a l’image d’une échelle de gris et à droite l’histogramme correspondant aux valeurs d’éclairement. Dans l’échelle deux plages (marquées) ont la même intensité de gris ce qui produit une barre deux fois plus haute dans l’histogramme au niveau correspondant : Voyons ce que cela donne en pratique sur une image qui ne comporte que 2 plages : une très sombre et l’autre un peu plus claire: (cas d’une photo qui manque de lumière). L’histogramme montre 2 barres situées plutôt aux niveaux sombres. En appliquant la fonction « histogramme stretch » le résultat à droite montre une image plus équilibrée en luminosité et on voit que l’histogramme occupe à présent toute la dynamique des niveaux du sombre au clair. On voit aussi que les « barres » sont plus épaisses et l’explication se voit dans l’image améliorée : le blanc n’est pas uniforme (le noir aussi mais cela se voit moins) à cause du bruit contenu dans l’image. Il s'agit du bruit électronique du capteur CCD ou Cmos, bruit qui a un niveau constant mais lorsque le signal utile (la lumière) diminue, le capteur compense en augmentant son amplification (Gain) et augmente aussi la contribution du bruit : le rapport signal/bruit (S/N ratio) se dégrade. Ce bruit est dû à la nature quantique des électrons qui se déplacent par paquets, et leur agitation augmente avec la température ce qui augmente aussi le bruit Les caméras à haute sensibilité utilisées en astronomie sont refroidies par effet Peltier Premier essai d’un étirement d’histogramme sur cette image de micro méduse qui manque de lumière : en un clic l’image est meilleure. Au dessous les histogrammes de luminance des deux images : sur celui de droite on voit qu’il occupe la totalité des niveaux du plus foncé au plus clair Pour les images en couleurs on aura 3 pics dans l’histogramme correspondant aux 3 couleurs utilisées par les filtres de la matrice du capteur . Les traitements qui suivent sont faits avec PaintShopPro 5 mais existent dans Photoshop et autres logiciels… Exemple avec une image colorée : voici un spécimen de copépode du genre pontellina vivant : c‘ est un sujet rare car pas d’images sur le Web ! L’éclairage a été diminué pour ne pas l’exciter et on voit une dominante rouge . On va faire coïncider les pics rouge et bleu avec le pic vert qui est le mieux centré sur l’histogramme En utilisant les curseurs du menu RGB adjust : en superposant les 3 pics, la couleur du fond se rapproche du blanc : plus les pics vont vers la droite de l’histogramme plus l’image sera claire . On améliore encore en appliquant l’étirement d’histogramme qui déplace les trois pics vers la droite Si le contraste est faible la fonction « gamma correct » améliore sensiblement le résultat Autre exemple avec une larve d’ echinocardium cordatum (oursin coeur) se métamorphosant en adulte La dominante verte vient du capteur qui n’a pas eu le temps de faire la balance des blancs On remarque que sur l’image de droite les taches dans le fond ont disparu ! Cela n’a rien à voir avec l’histogramme mais avec une fonction (cercle vert) de la visionneuse d’image de Windows 10 illustrée ci dessous : on déplace le pinceau (= le cercle centré sur le défaut) et le logiciel remplace la tache par la moyenne des pixels environnants Autre logiciel En utilisant l’application de windows 10 « Image Composite Editor » qui réalise des panoramas , on va traiter ces 2 images partielles d’un cladocère simocephalus : on obtient cette image « stitched » qui a été corrigée avec les fonctions décrites plus haut : RGB/histogram stretch/ gamma correct : le but était d’obtenir plus de détails en utilisant un plus fort objectif mais alors le sujet dépassait du champ et on est obligé de combiner 2 images Attention ce logiciel ajoute des pixels Autre exemple un peu plus complexe avec ce tanaïdae : 5 photos élémentaires au 2 X: Résultat avec ICE mais sans optimisation du fond : Voilà donc quelques techniques de « sauvetage » d’images mais bien sûr cela ne dispense pas de s’appliquer à faire les meilleures images lors de la prise de vue. Les traitements d’images ne peuvent PAS apporter de l’information là où elle est absente. N’ oubliez pas les limites des logiciels : Garbage in, garbage out !
-

Népenthes alata plante carnivore
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique Jolie étude ! Sur les images de glande sécrétrices, en particulier sur le détail des glandes en forme d"étoile , quel est le grossissement utilisé ? J' ai l'impression qu'elles sont déjà visibles à l'oeil nu sur d'autres images ... Amitiés JMC -

VInaigre Angillule du vinaigre
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Ils ressemblent beaucoup à des nématodes . Il me semble que j'avais obtenu des cristaux intéressants en laissant évaporer une goutte sur la lame , mais ça fait longtemps de ça...en je ne me souvient plus du protocole... Amitiés JMC -

Planctons d'automne 2024
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour Jean Luc Pour conserver les échantillons avec spécimens vivants, il faut utiliser un bocal large avec un tiers de volume d'eau, et retirer les choses inutiles et macroscopiques genre algues qui pourrissent vite ; disons que 2 à 3 jours c'est le max selon les espèces. Cela peut aussi aider de mettre le bocal au frais (frigo/ coté légumes). Pour conserver et fixer plus longtemps (mais pas vivants) ajouter un peu d'alcool ou fixatif formolé (genre fixateur de bouin ...). durée de conservation : 1/2 journée pour larvacées, 2 jours pour copépodes, 3 pour vers et larves plus longtemps pour dinoflagellées ou diatomées Amitiés JMC -

Planctons d'automne 2024
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour On trouve en effet des échelles (piscine ....) mais en architecture portuaire il y a un nom spécifique plus court ! Je voulais montrer que l'on peut recueillir du plancton sans beaucoup de moyens ...et que l'automne est souvent plus riche en spécimens que le printemps... J'ai hésité à faire une présentation différente : une introduction (moyen de recueil...) et poster une image par jour pour faire de l'animation mais cela serait moins cohérent pour la lecture. Amitiés JMC -

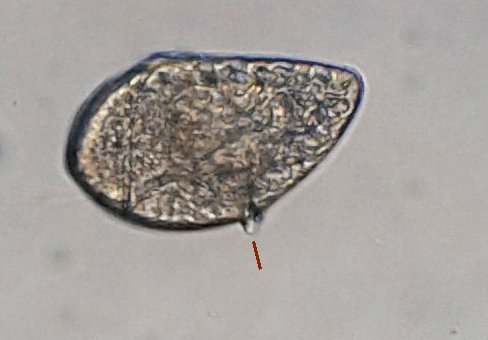
biddulphia challengerii.jpg
Jean Marie Cavanihac a posté une image de la galerie dans Jean Marie Cavanihac
-

Planctons d'automne 2024
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
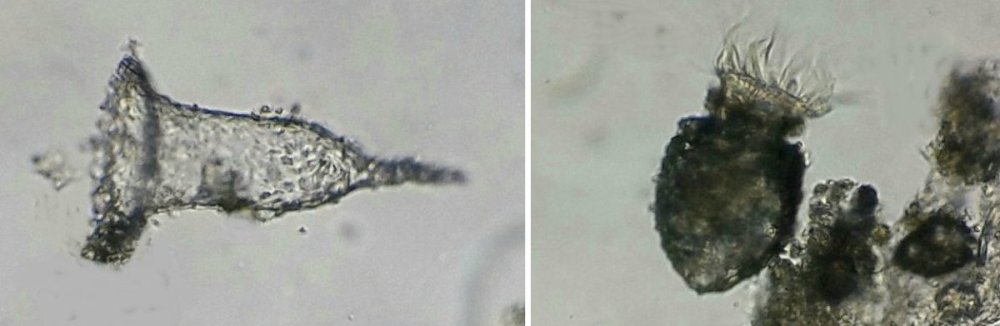
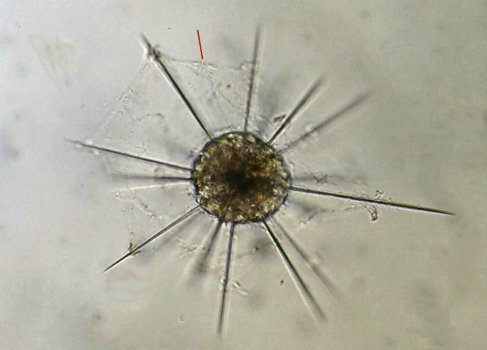
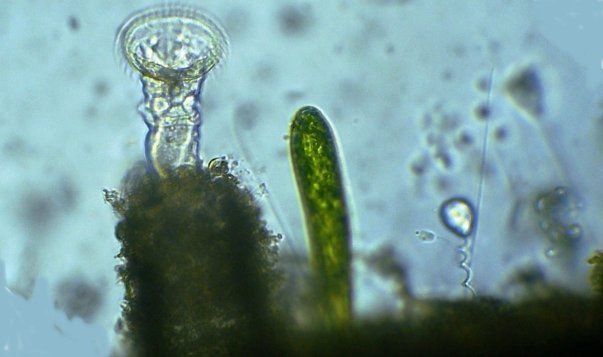
Un protopéridinium (divergens ? ) au x 40 : la flèche indique le flagelle : on peut se demander comment ces spécimens sans chlorophylle peuvent se nourrir...Il semble qu’un prolongement protoplasmique sort par l ‘ échancrure à coté du flagelle et englobe l’organisme à capturer Protozoaires : Plusieurs espèces de tintinides : Favela : Hélicostomella et au dessous Tintinopsis radix Lorica de Tintinopsis campanula et codonella : on voit bien les cils (difficile à photographier car très mobile ) Acanthaire : on voit les épines siliceuses et l’ectoplasme (flèche rouge ) Peu de larves à cette saison mais voici celle d’une ophiure et d’une holothurie à droite Plus commun ce larvacé oikopleura mais chose plus rare ce juvénile qui met à peine une heure pour atteindre la forme adulte : Encore plus rare (c’est la deuxième fois en 20 ans ) ce cercaire de trématode cercaria pectinata (?) sans doute parasite d’un mollusque : Et enfin ce que je pense être un statoblaste de bryozoaire : -
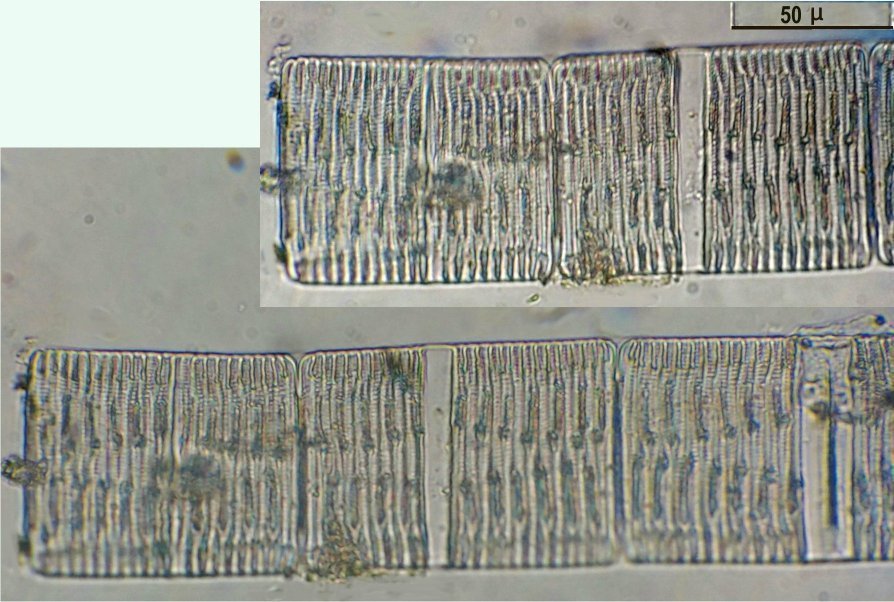
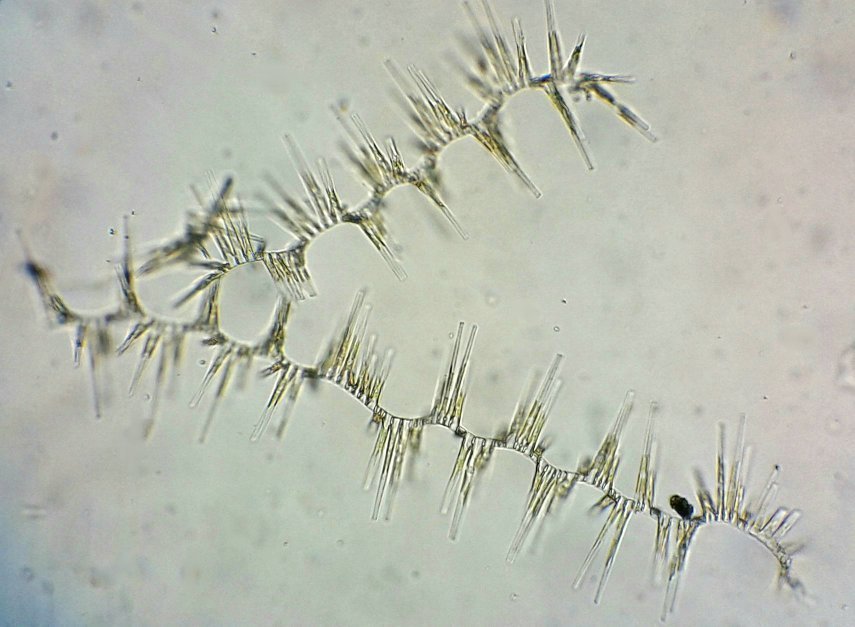
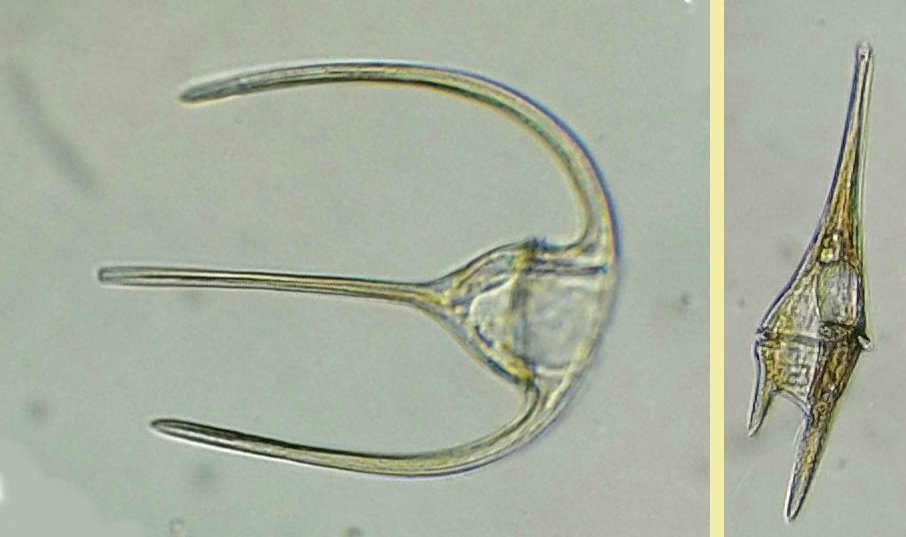
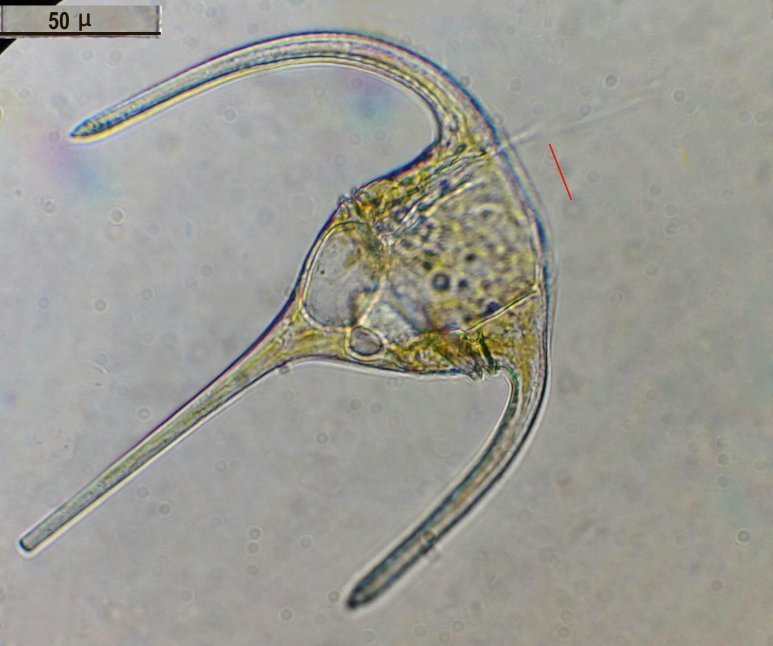
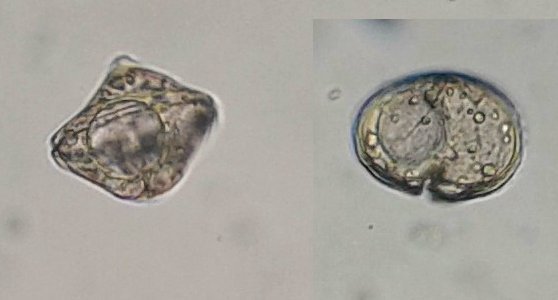
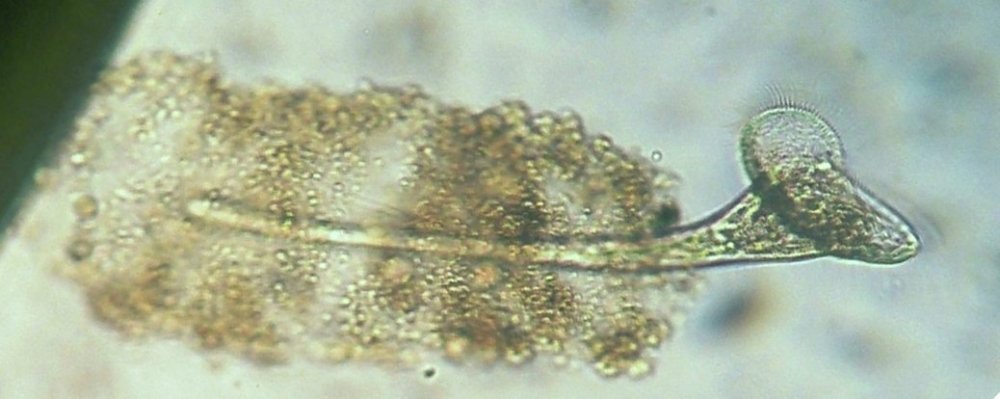
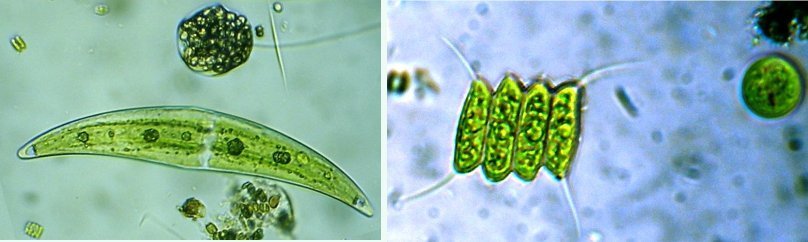
C’est un thème récurent pour moi et cette fois j’y ai ajouté le millésime ! En fait ce sont des échantillons observés entre fin Aout et fin Septembre donc plutôt fin d ‘ été. On aurait pu commencer cette présentation en paraphrasant Jean de la Fontaine « le plancton ayant erré tout l’été se trouva bien concentré quand l’automne fut venue » . Le mot erré correspond bien à l’étymologie de « plancton » : en grec = ce qui erre , c’est à dire qui n’a pas de moyen de locomotion propre, et suit les courants, ce qui inclut aussi les méduses. Mais tout d’abord quelques précisions sur la façon de le recueillir et cette fois on va remplacer le filet à plancton par deux accessoires tout à fait courants : Un filtre à café souple ( maille 200 µm environ) et un seau (celui ci contient 6 litres mais on peut en prendre un plus petit qui sera moins lourd quand il est plein) Le principe est de remplir le seau et de le vider lentement dans le filtre. On répète l’opération plusieurs fois puis on retourne le filtre à l’envers (partie intérieure devenue extérieure : image à droite ci dessus) dans le bocal de prélèvement , on verse un peu d’eau pour rincer le filtre et décoller les organismes et on recommence autant de fois qu’on veut. Il est utile de trouver un troisième accessoire (bien pratique mais pas transportable !) ce sont ces marches qui descendent au ras de l’eau et dont je ne retrouve plus le nom . On peut ainsi manier le seau à la main mais à défaut de marches, utiliser la corde que l’on voit dans le seau pour le lancer dans l’eau. Les échantillons ont été observés dans les heures qui suivent la récolte et remis à l’eau . On va présenter les espèces les plus originales, mais l’inventaire n’est pas exhaustif ….Il y a aussi : pleurosigma, licmophora, ardissiona, cylindrothéca, striatella, amphora...pour les diatomées les plus représentées, copépodes à divers stades de développement, véligers d’escargots...peu ou pas de larves à cette époque . Voir ici pour autres espèces :https://forum.MikrOscOpia.com/topic/19993-diatom%C3%A9es-de-m%C3%A9diterran%C3%A9e/#comment-82904 Voici donc ce qui a pu être observé : pour le phytoplancton : diatomée coscinodiscus : La surface n’est pas plane mais bombée et exceptionnellement j’ai utilisé Combine Z sur 4 images. Diamètre 210 µm : visible à l’oeil sur une lame bien éclairée. Rhizosolenia styliformis : Elles forment de longues chaînes de parfois 5 ou 6 individus Plus rare : avec deux niveaux de mise au point : Rhabdonema adriaticum que j’avais confondu avec fragilaria Une espèce rare aussi : Bleakeleya notata de la famille des Fragilariaceae Une autre peu commune biddulphia challengerii qui n ‘est pas plate mais a la forme d’un oreiller Les dinoflagellées sont plus nombreuses à cette époque : ceratium fusus En médaillon détail au X 40 Ceratium symétricum et ceratium furca à droite Une image plus détaillée où l’on voit le flagelle en mouvement qui tire le spécimen (déplacement vers la droite) Gymnodinium la flèche montre une boucle du flagelle transverse enroulé dans la gouttière Protoperidinium vue de coté et de dessus du même spécimen (au x 15)
-

Trésor archéologique sur la plage.
Jean Marie Cavanihac a répondu à un(e) sujet de Tryphon T dans Sujets de Microscopes à écran.
Bonjour Je dirais carotte de béton , à cause de la forme circulaire pas naturelle ! Datée du temps des pyramides (ils ne mettaient pas de béton à l'époque ! ) Amitiés JMC -

Les habitants du bassin
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour C' est exactement le but ! Amitiés JMC -
-
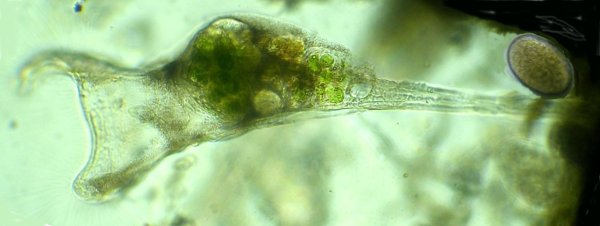
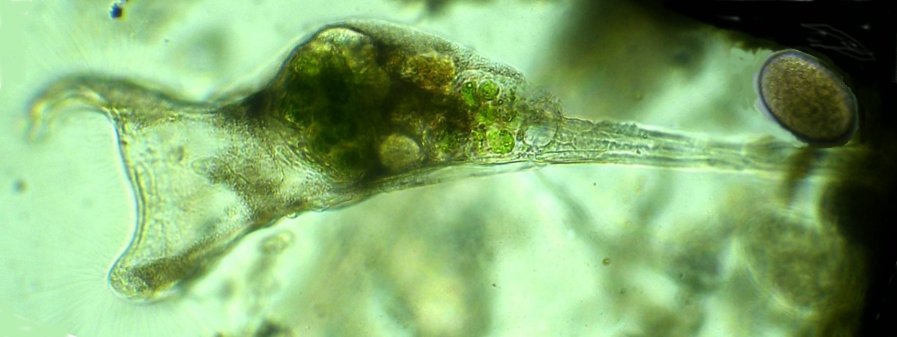
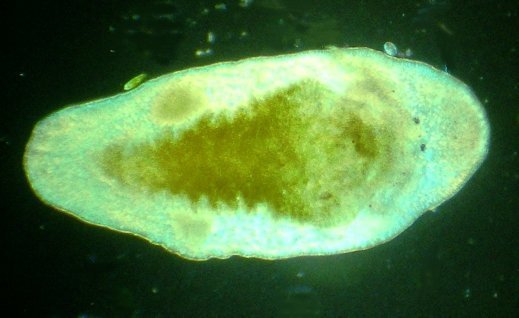
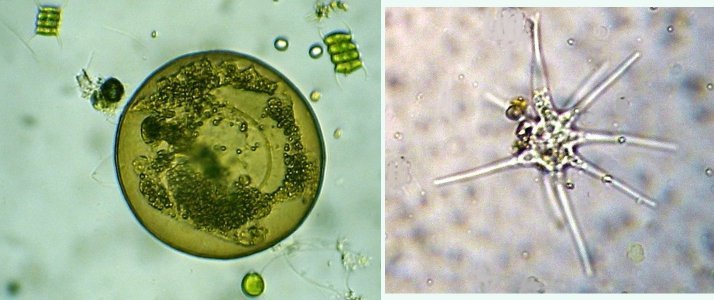
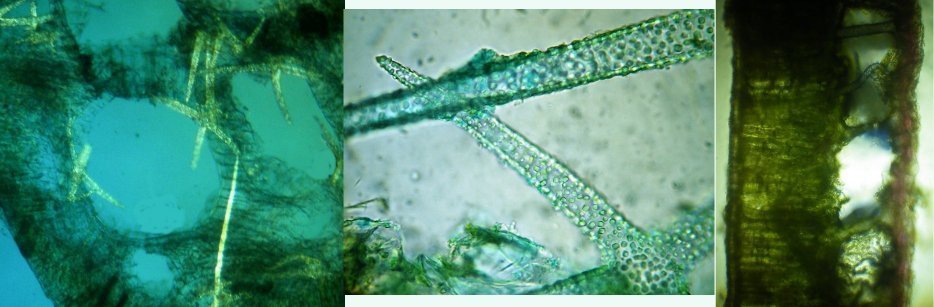
Dans la série "Aventures microscopiques" voici : Les habitants du bassin Souvent nos activités sans rapport avec la microscopie peuvent nous conduire à réaliser des observations aussi inattendues qu’intéressantes. Ce peut être à l’occasion d’un repos dans un parc, d’une après midi de ballade dans la région, une visite dans une jardinerie, ou... une invitation chez des amis qui possèdent un bassin à poissons. C’est ce dernier cas qui va servir à illustrer une exploration des habitants de ce bassin et montrer qu’il n’est pas toujours utile d’aller chercher loin ; j’ai fait ces images rapidement et elles ne sont pas optimisées, mais ce qui importe c’est de voir la variété d’organismes dont chacun pourrait mériter plusieurs heures d’observation . On voit sur cette photo une partie du bassin de 80 cm par 2 mètres et 60 cm de profondeur, garni de nénuphars et de quelques plantes aquatiques. (NB : la sphère en RAKU au premier plan est l’oeuvre de ma compagne, et le bassin appartient à des amis qui nous prêtent leur four à gaz pour ces cuissons raku à l’extérieur de leur maison ) Donc entre deux cuissons , un petit prélèvement de quelques milli litres en grattant les parois du bassin, le dessous des feuilles de nénuphar (en évitant les carpes koï !) est ramené à la maison et voici ce qu’on peut y observer : Un suctoria : avec ses tentacules déployées un rotifère : Un autre rotifére probablement ptygura, qui se construit une logette avec ses boulettes fécales : (on voit aussi une vorticelle contractée sur la droite ) Un autre rotifère plus rare : collothéca avec un œuf : on ne voit pas sur l’image les longs filaments qui lui permettent d’attraper sa nourriture comme avec un filet. Il y en avait plusieurs dans l’échantillon. Un autre protozoaire : stentor qui a produit (ou réutilise?) une logette... à moins que ce ne soit un rotifère ! Des desmidiées ; closterium et scenedesmus Un planaire vu en fond noir : remarquer les taches oculaires à droite une amibe à thèque : arcella à gauche et une amibe libre dans l’eau qui prend cette forme étoilée. Et enfin une vue rapide sur une coupe de tige de nénuphar : à gauche en lumière polarisée on voit bien les lacunes contenant de l’air qui permettent la flottaison ainsi que les sclérites rendues brillantes. Au milieu gros plan sur les sclérites. A droite coupe de la feuille : l ‘épiderme est à gauche de l’image et on voit aussi les lacunes sur la face inférieure qui permettent à la feuille de flotter Il y avait aussi dans l’échantillon quelques euglènes mais pas beaucoup de diatomées… Voici une observation rapide (quand on rentre de la séance RAKU à plus de 100 km de la maison on a quelques autres priorités ! ) ; il ne faut pas garder l’échantillon tel quel plus de 24 heures car beaucoup d’espèces peuvent disparaître ou être mangées par d’autres . On peut dès que possible séparer des spécimens intéressants avec une micropipette et essayer de les cultiver dans un environnement approprié : par exemple prendre suffisamment d’eau du lieu de prélèvement en plus de l’échantillon lui même. En effet dans le cas présent, à 100 km de distance, la composition des eaux locales peut être très différente d’une région à terrains calcaires par rapport à une autre à terrains granitiques.
-
Bonjour Sujet impressionnant et rare , ayant conduit à cette belle étude ! Je me souvient que si on n'éjecte pas le le scolex le cycle continu ! On sait bien qu'il faut cuire le porc à coeur mais apparemment on ne se méfie pas assez du boeuf ! De toute façon depuis le Creutzfeldt Jakob je n'en mange plus ! Amitiés JMC
-
Bonjour Pour changer des images d'objets naturels microscopiques voici quelques images d'objets manufacturés (les techniques de fabrication font largement appel à l'optique) . Contenu (puce ) d'un transistor la partie carrée est constituée de 3 ou 4 couches de silicium empilées où sont reliées les connexions vers l'extérieur. Une 3 eme connexion se fait par le boitier qui fait aussi office de dissipateur de la chaleur. Pour ceux qui connaissent , l'intérieur d'un transistor 2N2905 : c'est surprenant de voir la petite taille de la puce , car il est donné pour un courant max de 0,8 ampère Images obtenues avec objectif x 2,5 et le dispositif d'épiscopie décrit ici : https://forum.MikrOscOpia.com/topic/18538-épiscopie-à-leds/#comment-76427 AMitiés JMC
-

Larves d'échinodermes
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
Bonjour Merci de tes encouragements, il faut que je me familiarise avec l'insertion d'images et liens dans la galerie pour que les images pointent vers la source, article ou post...! -

pluteus oursin en lumière polarisée.jpg
Jean Marie Cavanihac a commenté un(e) image de la galerie de Jean Marie Cavanihac dans Jean Marie Cavanihac
-

Larve d'Ophiure.
Jean Marie Cavanihac a commenté un(e) image de la galerie de Jean Marie Cavanihac dans Jean Marie Cavanihac
-

anemonetexte4.jpg.b04f1e204243f6310fe07bc59d6b19ad.jpg
Jean Marie Cavanihac a donné son avis sur un(e) image de la galerie de Dominique. dans Galerie Mikroscopia
-

pluteus oursin en lumière polarisée.jpg
Jean Marie Cavanihac a posté une image de la galerie dans Jean Marie Cavanihac
-
-
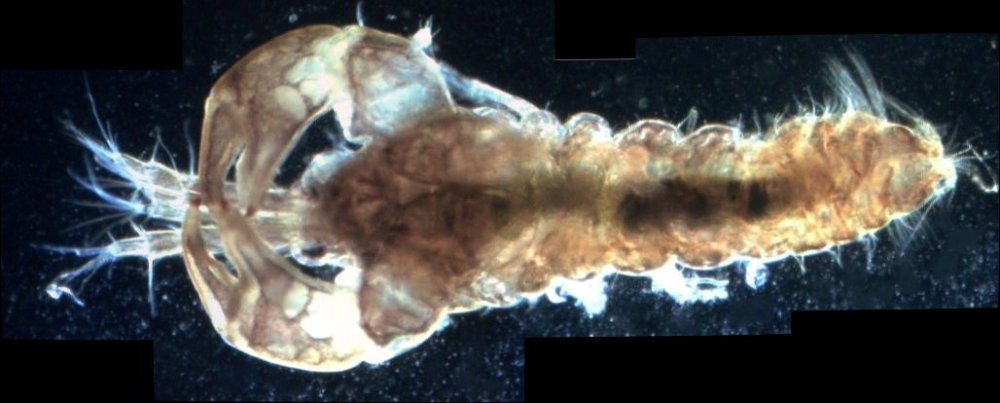
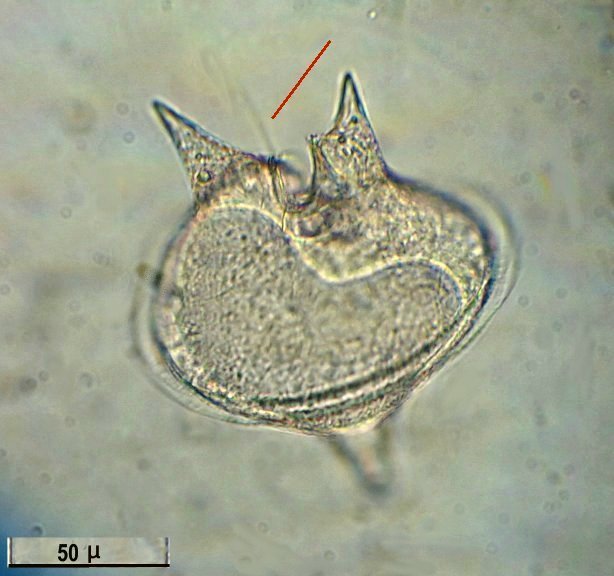
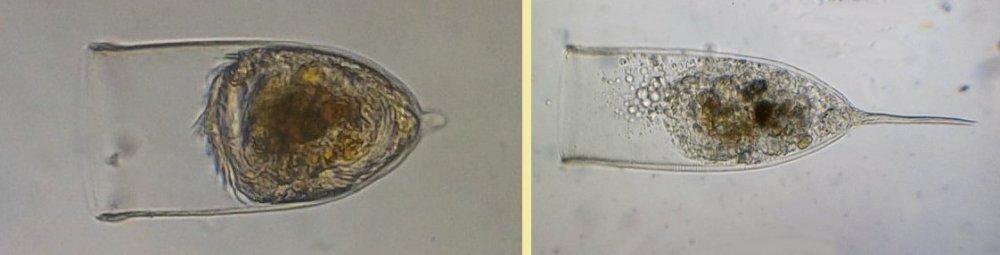
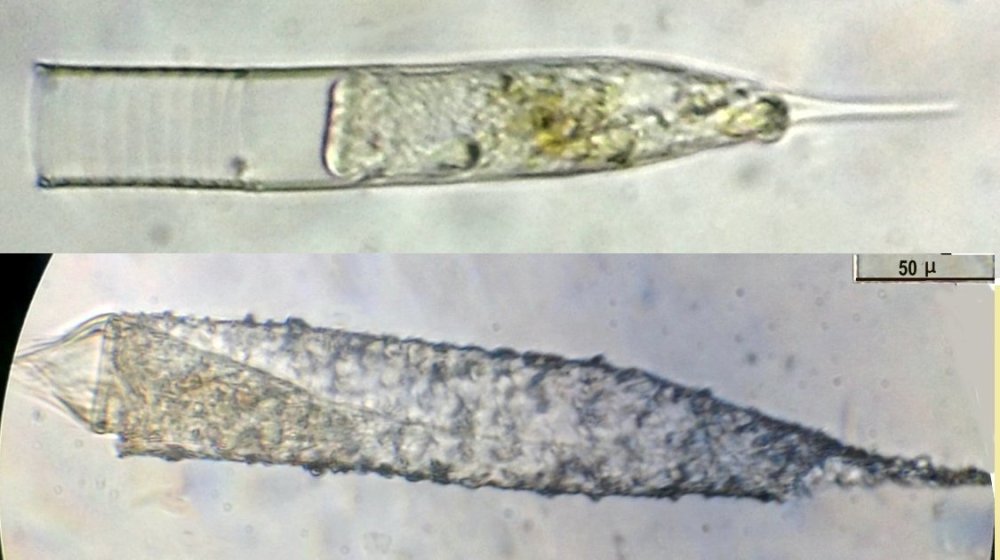
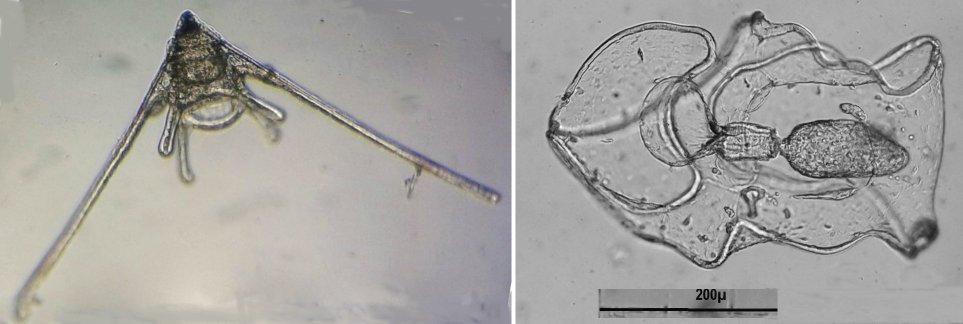
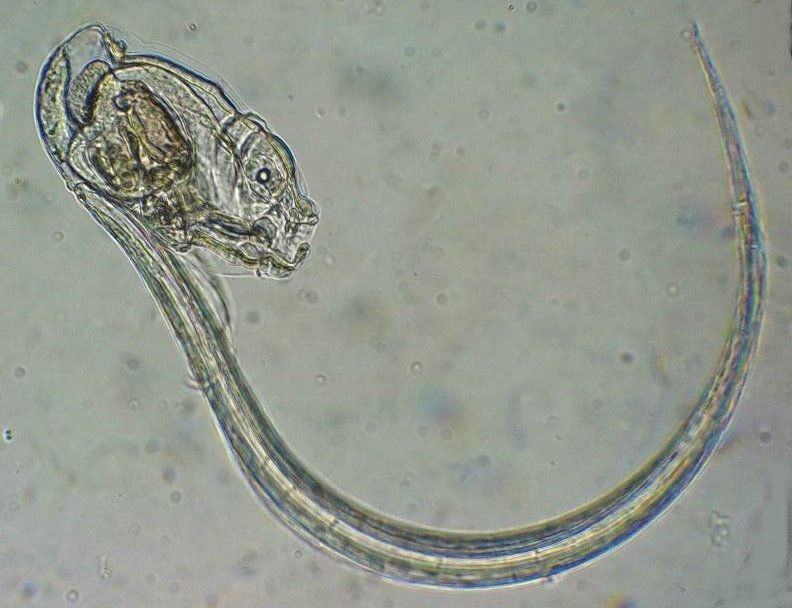
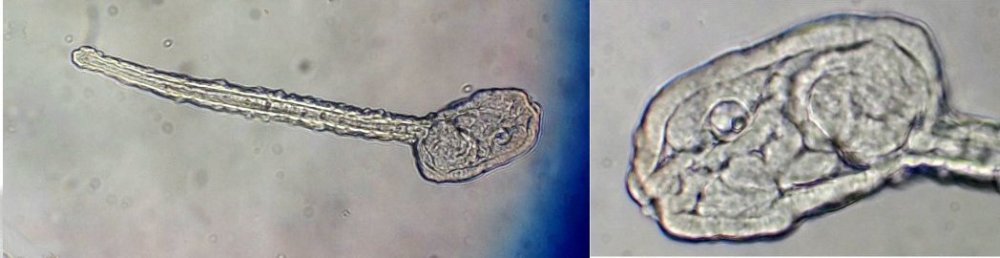
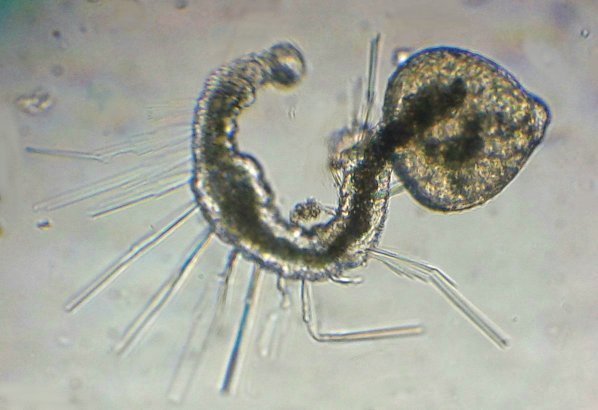
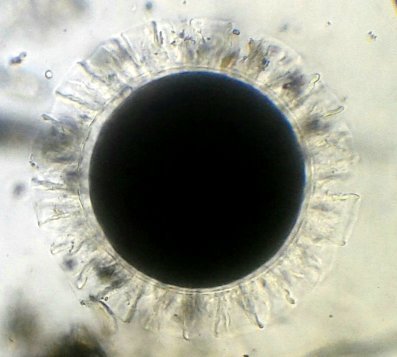
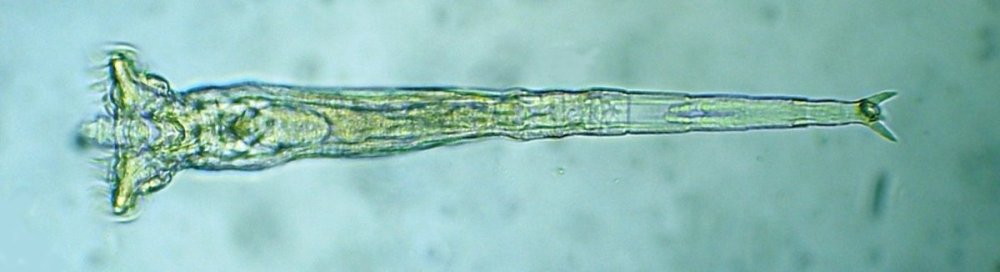
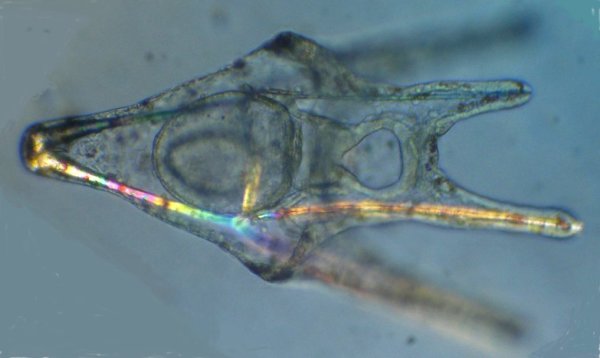
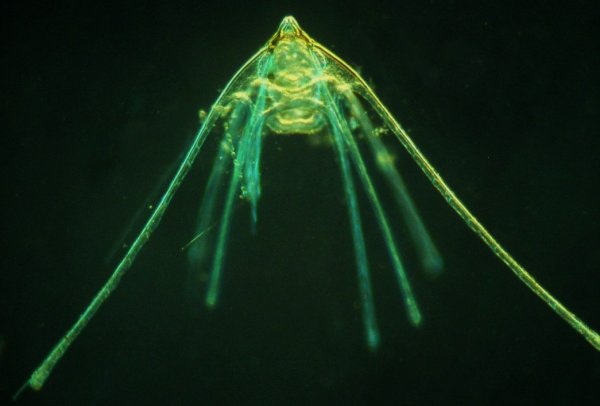
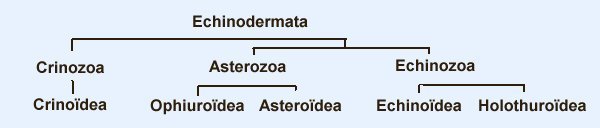
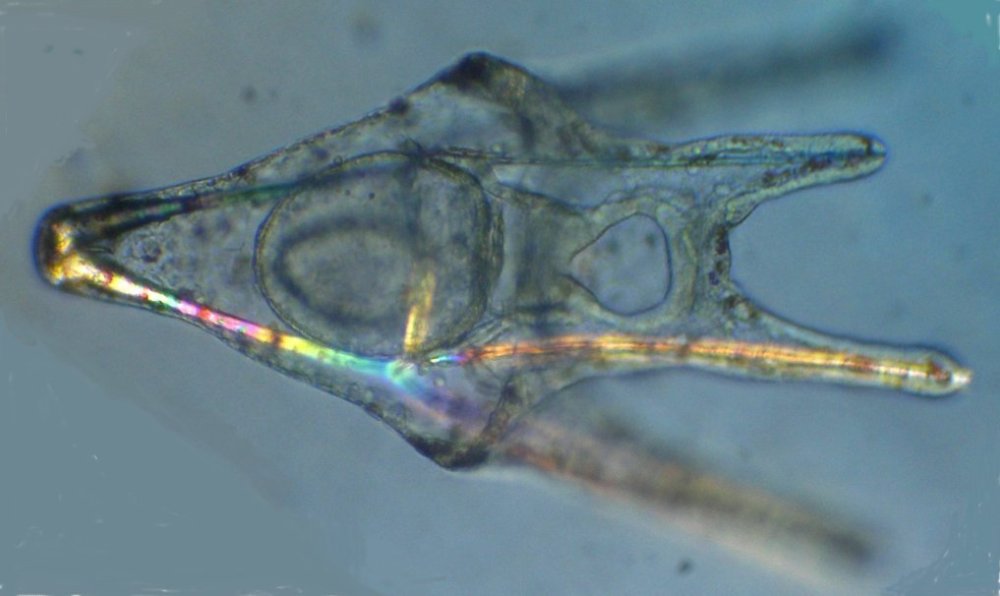
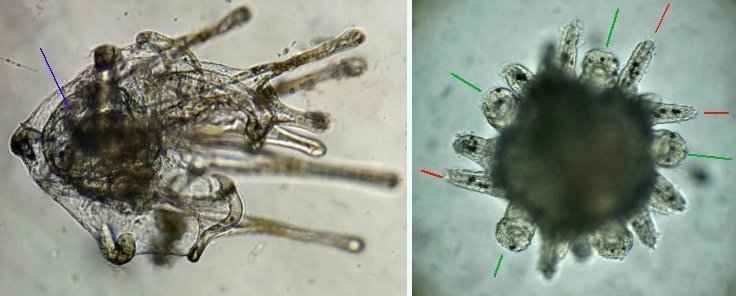
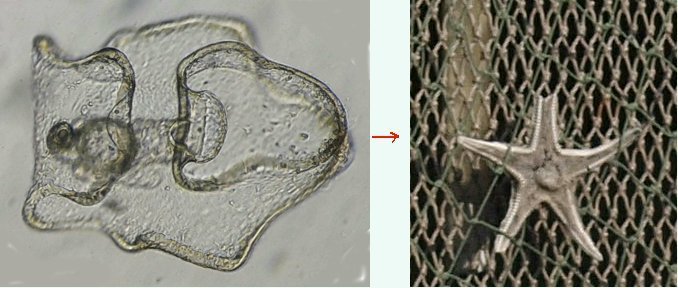
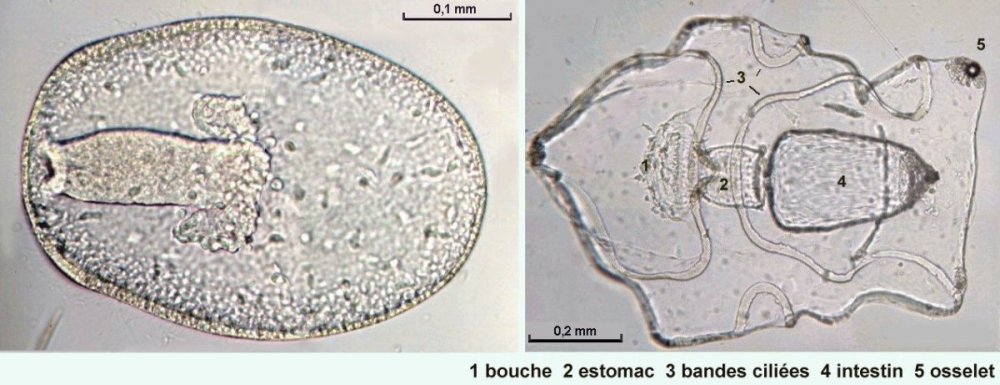
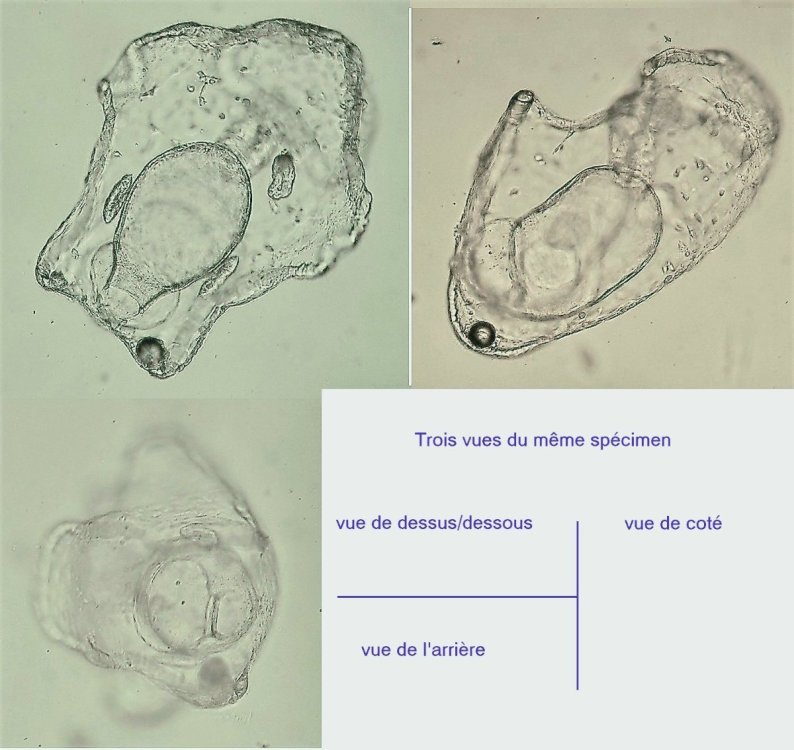
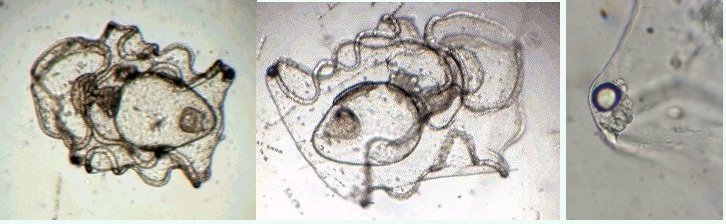
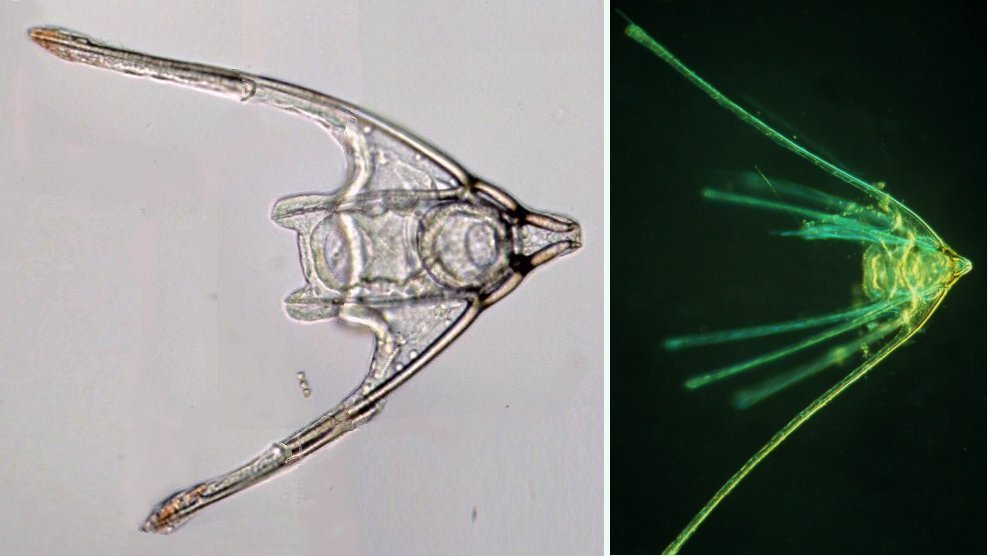
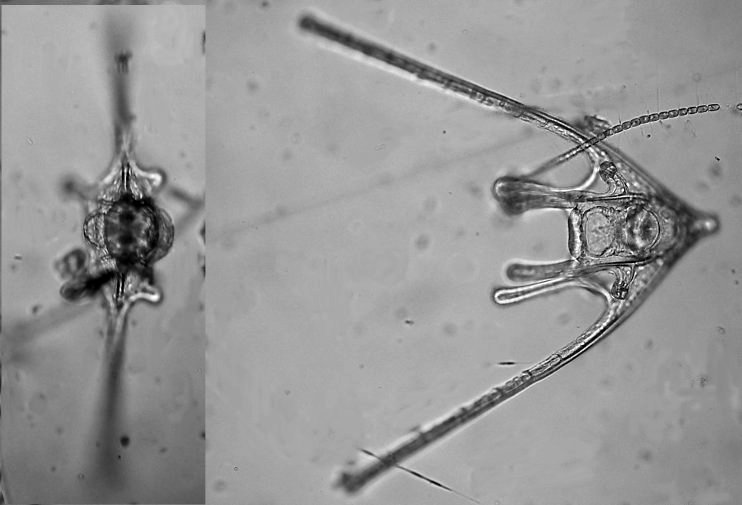
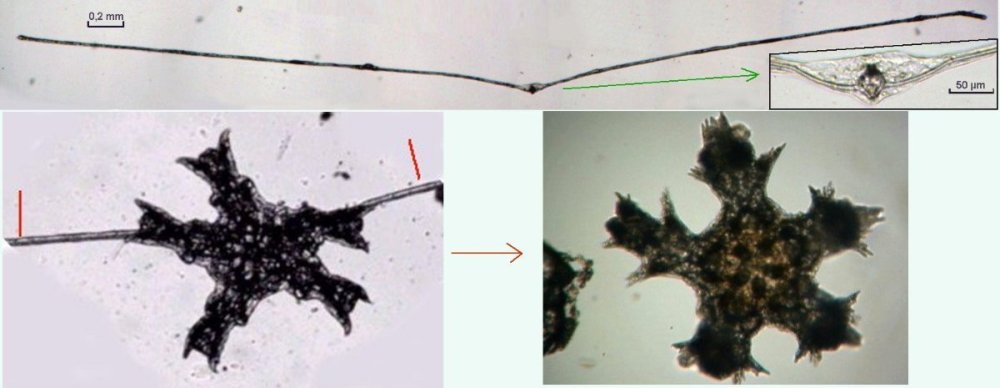
Les échinodermes représentent un groupe important d’organismes exclusivement marins qui compte plus de 7000 espèces . Leur nom vient du grec « echino » = hérisson et « dermo » = peau. Leur squelette rigide ou semi rigide pour la plupart est formé de carbonate de calcium et pourvu d’excroissances sous formes d’épines de même composition. Ils, présentent généralement une symétrie radiale d’ordre 5 c’est a dire que les structures sont espacées de 72 degrés, par exemple la bouche des oursins possède 5 dents . Dans ce qui suit on ne parlera pas des crinoïdea qui ont une morphologie assez différente On voit bien les piquants rigides et aussi les podias plus longs sous la forme de fins filaments terminés par une ventouse ; voir le lien ci dessous pour l’étude des podias, pédicellaires etc : https://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-OURSINS/OursinsJMC.htm Voici 2 larves : oursin courant Paracentrotus lividus et echinocardium cordatum (à droite) tous deux au stade pluteus Une image en lumière polarisée montre la nature calcaire (calcite ) des tiges constituant les embryons de squelette interne . On voit bien la bouche entre les bras à droite qui sont couverts de cils . La larve se déplace bouche en avant pour capturer le plancton. On a parfois la chance de voir la métamorphose d’un pluteus à 8 bras vers un oursin juvénile que l’on voit déjà à l’intérieur (flèche bleue). Sur un juvénile (image à droite) - flèches rouge : ébauche de piquants et flèches vertes : ébauches des podias. Autre échinoderme : Asteroïdea : étoile de mer dont voici la larve (pas sûr à 100 % ce pourrait être celle d’un concombre de mer mais à ce stade elles se ressemblent !) A droite adulte pris dans un filet (12 cm diamètre). Les 5 bras sont relativement souples et grâce à leurs podias , peuvent ouvrir la coquille de mollusques bivalves. L’étoile de mer projette alors son estomac à l’extérieur pour digérer sa proie. Holothuroïdea : Le groupe compte environ 1200 espèces dont la taille moyenne se situe entre 10 et 30cm. Le surnom « concombre de mer » décrit bien la forme de l’adulte ! La symétrie d’ordre 5 est moins visible. à gauche stade antérieur : gastrula - on voit le début du système digestif et à droite larve plus âgée Voici 3 photos d’une même larve : Les images ne sont pas très contrastées car prises au microscope inversé dont la lampe était un peu faible. La larve évolue ensuite sous la forme auricularia: a droite détail d’un osselet qui sera intégré dans les tissus (objectif x 40 ) Ophiuroïdea : une espèce très représentée (2000 espèces) et vivant en général sur les fonds de grande profondeur : https://www.researchgate.net/publication/7899207_Larval_Morphometrics_and_Influence_of_Adults_on_Settlement_in_the_Gregarious_Ophiuroid_Ophiothrix_fragilis_Echinodermata Ci dessous image de deux larves à des stades d’évolutions différents : (nommées aussi : Ophiopluteus) . A droite un autre spécimen en éclairage de Rheinberg Image difficile à obtenir : celle d’une même larve vue de face à gauche et de dessus . La photo de face a été rendue possible grâce à un micro aquarium contenant plus d’eau qu’une lame et permettant au sujet de se déplacer dans 3 dimensions (ce qui ne facilite pas le focus!) Les larves peuvent légèrement différer d’une espèce à l’autre : mais l’ adulte se développe toujours à la jonction des bras : (montrés ici par flèches rouges) dernière image à droite : adulte libre. L’image du dessus montre une larve aux bras excessivement longs : plus de 4 mm d’envergure ! Les bras des ophiuridae sont fragiles et cassants. Beaucoup plus souples que ceux des étoiles de mer , ils servent aux déplacements par un mouvement ressemblant à la reptation des serpents. Ils sont recouverts d’excroissances calcaires Images d’adultes : https://fr.wikipedia.org/wiki/Ophiuroidea Vue d’ensemble de quelques échinodermes : http://www.mesa.edu.au/echinoderms/gallery.asp
-
Bonjour Dominique Je ne connaissais pas la version "vers" mais j'ai bien connu les cétoines dorées, on en trouvait d'avantage quand j'étais jeune et vers mes 12 ans j'en avais élevé une pendant des mois ...C'est un vrai bijou volant ! Les hannetons aussi étaient plus nombreux, ça fait des décennies que je n'en ai pas vu un .... C'était aussi courant de faire l'élevage des vers à soie, il y en avait même à l'école Amitiés JM
-

Diatomées de Méditerranée
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
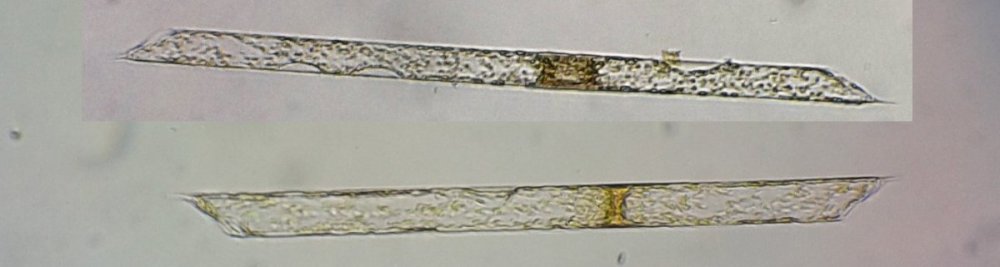
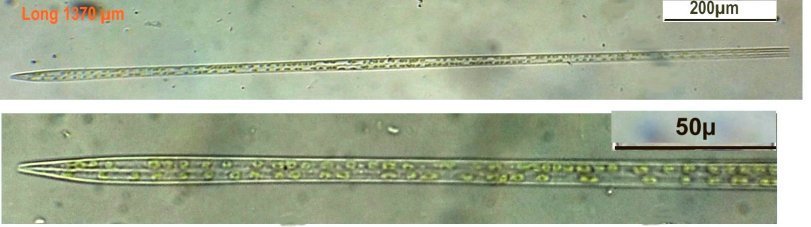
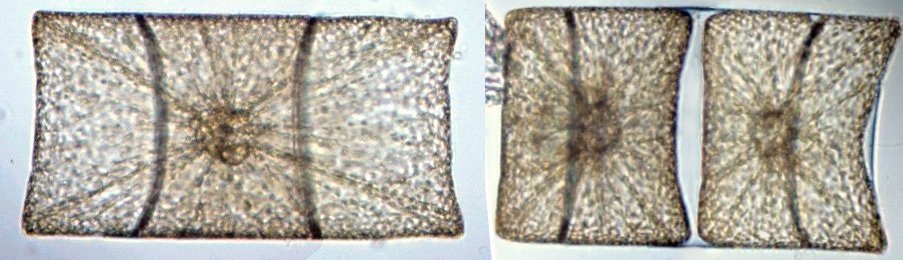
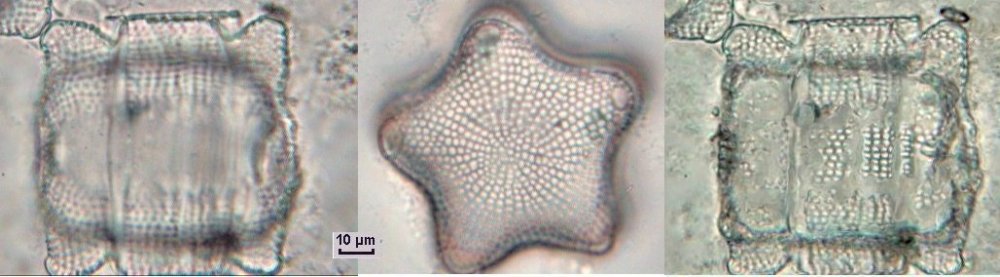
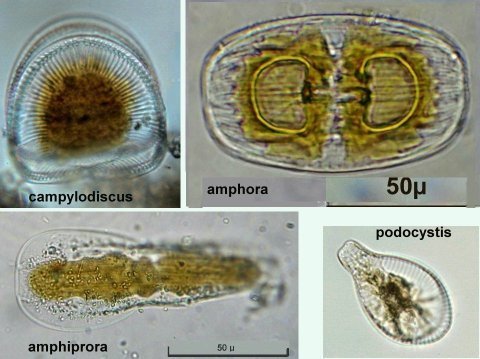
Autres diatomées moins communes ; ardissiona fulgens vue valvaire et connective et division Un spécimen rare et très long : thalassiotrix. Là aussi les frustules longues de 1,3 mm seraient certainement brisées Autre espèce peu courante : Biddulphia challengerii (?) en cours de division Quelques spécimens plus rares ou de forme complexe , qui apportent plus d’informations sous leur forme naturelle sans préparation : triceratium formosum pentacrinus (?) l’image à droite est un stack de 20 images Enfin pour terminer une planche de quelques diatomées de formes diverses :