-
Compteur de contenus
4 179 -
Inscription
-
Dernière visite
-
Jours gagnés
1
Tout ce qui a été posté par Jean Marie Cavanihac
-

Petit guide d'identification visuelle
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
-

Petit guide d'identification visuelle
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
-

Petit guide d'identification visuelle
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
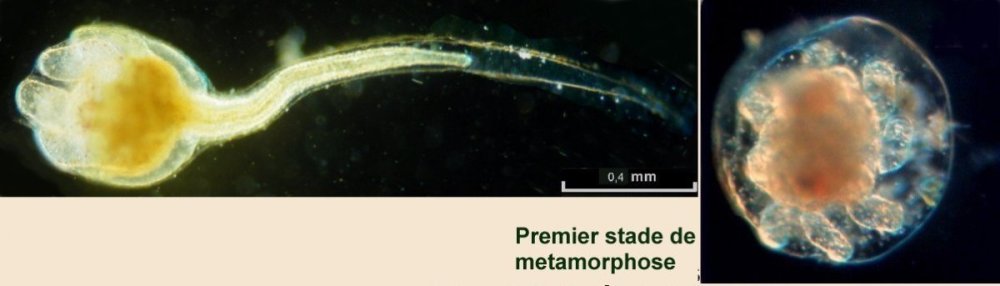
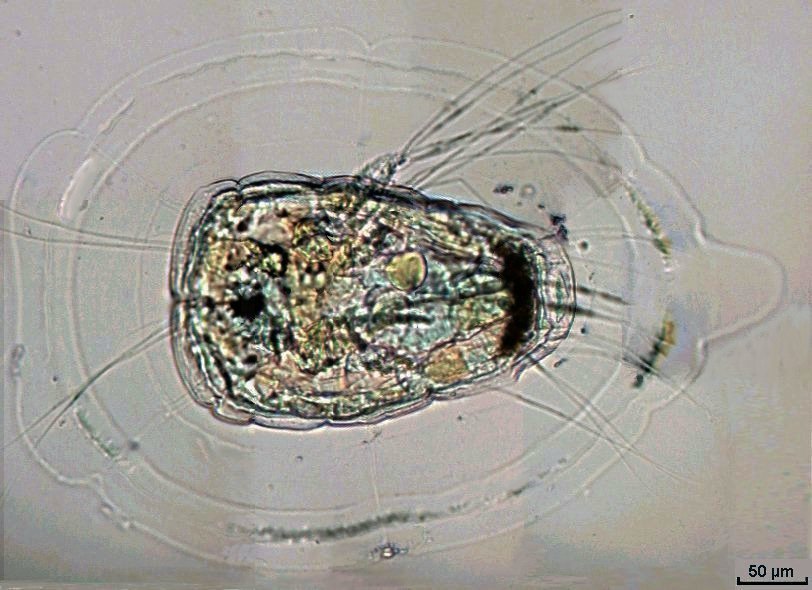
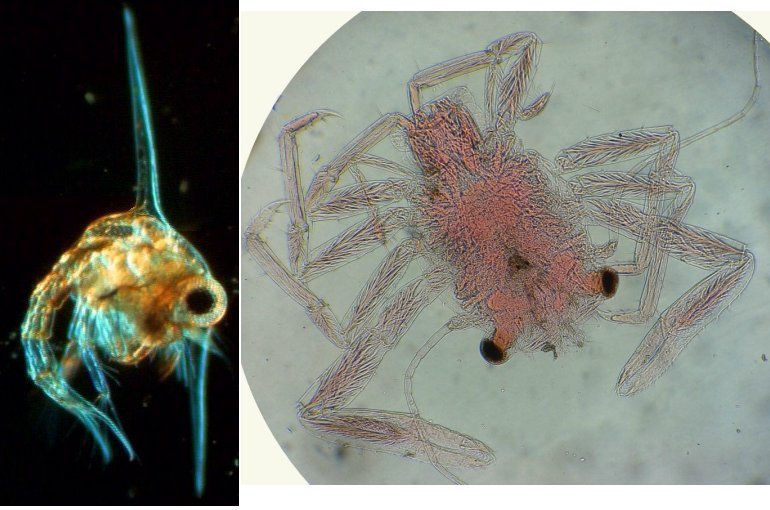
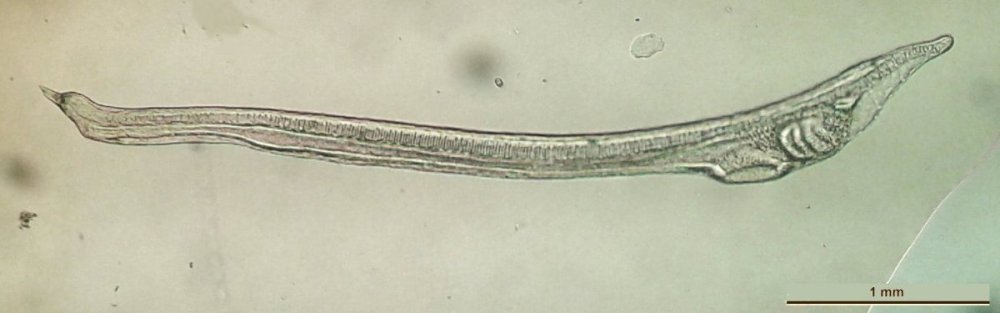
Lorsque l'on commence à observer la vie microscopique on se pose la question de savoir le nom des sujets que l'on voit afin de trouver plus d'informations sur Internet par exemple . Voici quelques planches illustrées qui peuvent guider dans cette démarche et montrent les sujets les plus fréquemment trouvés dans des échantillons : SOMMAIRE : les planches suivantes donnent les détails de chaque vignette REUSSIR LES OBSERVATIONS DANS DE BONNES CONDITIONS REUSSIR LES OBSERVATIONS : MONTAGE DES LAMES -
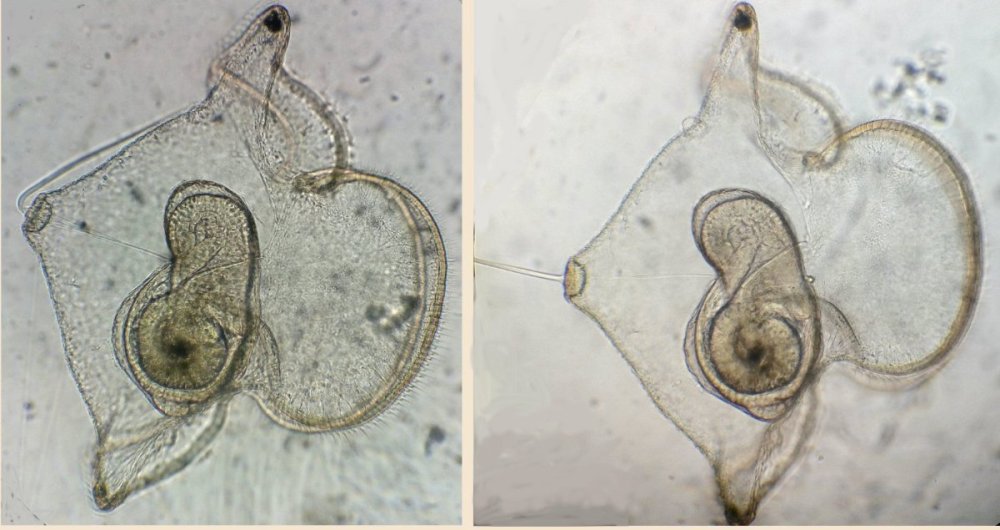
LE MONDE FASCINANT DES ROTIFERES Jean-Marie Cavanihac, Avec l'aimable participation de F.Azemar dans l'aide à l'identification. Comme je dis souvent, l'observation de la faune et de la flore aquatique constitue un bon début pour devenir passionné de microscopie. Le milieu liquide facilite en effet l'observation par transparence et la majorité des sujets ne demandent aucune préparation. De plus la recherche des échantillons nous fait aussi souvent découvrir des lieux agréables ! Lors de nos premières observations, nous sommes attirés (les plus jeunes surtout…) par tout ce qui bouge et nos premiers sujets d'émerveillement sont, bien sûr, les protozoaires… mais ceux ci sont rapides et ne nous laissent que peu de temps pour les admirer. Fort heureusement nous avons d'autres petits amis dont certains veulent bien prendre la pose : ce sont les rotifères. Leur surnom anglais 'wheel animalcules '' = petits animaux à roues, décrit parfaitement les individus les plus représentatifs de l'espèce. En effet les rotifères portent sur leur 'tête' des petites couronnes de cils tournant en sens inverse qui rabattent les particules nutritives vers leur bouche. Ils me font penser irrésistiblement à ces brosses rotatives pour faire reluire les parquets ou nettoyer les moquettes. Il ont été 'honteusement' copiés, dans ces véhicules de voirie équipés de deux brosses tournantes en sens contraire de part et d'autre du pare choc avant et qui ramènent les feuilles des caniveaux vers un tube d'aspiration central : voilà un gigantesque rotifère mécanique ! comme quoi l'homme n'a rien inventé… Les 'roues' ont aussi une fonction de locomotion et permettent à certaines espèces de se déplacer très rapidement . Chez d'autres elles sont plus discrètes et les déplacements se font par reptation. Sans doute pour nous permettre de mieux les admirer, (serait ce un brin de coquetterie ? … car se sont en majorité des femelles parthénogéniques, qui se reproduisent donc en donnant d'autres femelles identiques..! ) les rotifères se fixent par leur 'pied' sur des supports divers, algues filamenteuse, débris végétaux. Ce pied contient en effet une glande sécrétant une substance adhésive. Mais ils sont aussi capables de s'en détacher rapidement. Ils possèdent la faculté de rétracter les couronnes ciliaires si celles ci sont heurtées par un objet ou un protozoaire véloce ! Comme ils sont transparents leurs organes internes sont très visibles, l'un d'eux en particulier au centre: le 'mastax' qui est un organe masticateur pratiquement toujours en mouvement : la forme de ses mâchoires chitineuses (trophi) diffère selon les espèces et constitue aussi un moyen d'identification . Voici une famille de philodina : Il est possible de les 'cultiver' si le milieu contient des micro algues et parfois la levure de boulanger (préalablement bouillie pendant 10 mn pour l'inactiver et éviter les contaminations) peut 'dépanner' pendant quelque temps … L'introduction de levure très diluée, permet d'ailleurs de matérialiser les forts courants engendrés par les roues ! N'essayez pas de faire des préparations définitives, elles sont décevantes, car les rotifères se contractent si le milieu leur déplaît (le formol tout particulièrement…) et deviennent méconnaissables et puis ce serait triste de tuer ces animaux si attachants… D'ailleurs cette faculté de se rétracter et de suspendre leur métabolisme leur permet de résister à des conditions extrêmes dont la sécheresse totale. Et vous constaterez souvent que, dans un prélèvement ou il n'y a aucun rotifère 'identifiable' le premier jour , vous en trouverez des quantités quelques jours après. Voir les très beaux articles de Christian Colin dans le magazine. D'autres fois il y en a énormément dans le premier jour du prélèvement et le lendemain ils ont tous 'disparu' en formant leurs kystes de résistance. Mais je parle, je parle, et je vous entends penser très fort "des images ! des images !" pour voir à quoi ressemblent ces étonnants métazoaires, pour ceux qui n'en ont jamais rencontré (serait ce possible …? ) … ou pour les autres qui apprécieront leur diversité de formes surprenante … Une dernière précision, si les rotifères sont bien représentés dans les ruisseaux (calmes), mares, pièces d'eau et fontaines des jardins public, bacs des jardineries (plantes aquatiques) , aquariums, vieux bac à fleur plein d'eau au fond du jardin… il en existe aussi des espèces marines identiques à certaines espèces terrestres. Voici une petite galerie d'images qui pourra modestement aider, je l'espère, à l'identification des espèces les plus communes et même …de celles qui ne ressemblent pas au modèle 'standard ' ! Toutes prises au X 15 Rotifer vulgaris L'un des plus fréquent : le Rotifer vulgaris (rotifère présent dans les mousses) avec un mode de locomotion ressemblant à celui d'une chenille. Ses couronnes de cils sont très réduites et ressemblent d'avantage à des moustaches ! Très courants aussi mais petits (parfois plus petits qu'un protozoaire..) Lepadella lecane Autre grand classique : Brachionus avec une multitude de variations dans l'espèce . Ils sont souvent 'cultivés' intensément pour la nourriture de larves de poissons. (voir sur le web ). L'image en montre un transportant ses 3 œufs. Noter la tache rouge qui constitue un organe sensible à la lumière. Classique aussi le placide Euchlanis , relativement gros , calme et facile à étudier : Un peu plus 'rare' et difficile à immobiliser : Synchaeta : c'est l'exemple type d'un rotifère qui existe en version "eau douce et eau salée" . Il dispose de sortes de poils sensitifs Autre version du Synchaeta très transparent . Les deux spécimens sont d'origine marine . Mytilina avec quelques cornes antérieures et postérieures … Un spécimen rare : Cupelopagis vorax grand amateur de rotifères qu'il capture avec sa "nasse" que l'on voit à gauche ! A suivre
-
HYDROMEDUSES Jean-Marie Cavanihac, Lorsque l' été approche , prés de nos côtes apparaissent des centaines de petites méduses roses (de l'espèce aurélia) . Celles ci sont inoffensives mais le contact avec les tentacules de grosses méduses peut causer des chocs allergiques sérieux et même laisser des cicatrices. Mais d'où vient le mot méduse (nos amis anglo saxon les appellent jelly fishes: littéralement poisson gélatineux ) Rappelez vous vos souvenirs de la mythologie Grecque : en ce temps là il y avait les trois Gorgones qui vivaient prés du Jardin des Hespérides et l'une d'entre elle s' appelait Méduse. Elle est traditionnellement représentée avec des serpents dans ses cheveux et les pauvres humains qui croisaient son regard étaient changés en pierre. L' histoire raconte qu'elle fut vaincue par Persée qui fit don de la tête de Méduse à Athéna , la déesse protectrice d'Athènes...En effet en Grec Méduse signifie "qui protège' . Est ce la légende qui a donné son nom à ces créatures aquatiques ? le fait est, que les grosses méduses ont des tentacules pendants qui ressemblent à des mèches de cheveux qui se tortillent (d'ou la référence aux serpents ! ) et effectivement un poisson qui touche ceux ci se voit injecter une toxine paralysante (qui ne le change pas pour autant en pierre mais le pétrifie cependant !) Fort heureusement pour nous, les variétés de méduses microscopiques sont inoffensives et nous pouvons observer leurs gracieux mouvements : en voici quelques exemples ci dessous CI dessus image prise avec objectif x 2,5 . A droite avec 6,3 x Vue de coté d'une hydroméduse , avec 4 tentacules , (x 2,5) et le manubrium à droite qui porte la bouche , la partie arrondie à sa base étant les gonades Mais comment sont produites ces méduses ? la forme la plus courante est engendrée par le bourgeonnement d'un polype fixé au fond . La méduse représente une forme sexuée permettant la reproduction et la dissémination de l'espèce : chez l'obélia le polype développe des individus spécialisés qui contiennent des petites méduses : voici l'image d'un d'entre eux avec les bébés méduses se bousculant à la sortie ! A droite un individu 'normal' du polype mais rétracté : Cependant on rencontre des formes sans polype telle cette photo assez rare de Dipurena gemmifera (image de gauche) qui présente la particularité d'avoir des bourgeons médusaires sur le manubrium L'un des intérêts de l' obélia réside dans le fait que la méduse est assez plate, et qu'il est possible de voir en détail les organes internes comme, le manubrium et la bouche ouverte au centre, les 4 gonades ainsi que les canaux qui les traversent, photo ci dessous à gauche. Ci dessus à droite le détail d'une gonade d'obélia. La photo de gauche montre l'estomac de l'obélia sous le manubrium avec le départ des 4 canaux qui traversent les gonades et rejoignent un canal circulaire à la base des tentacules Voici un gros plan sur le manubrium d'une autre espèce de méduse : Sur l'image de droite vous pouvez voir la méduse en train de digérer une larvacée dont seule la queue dépasse (flèche) de la bouche ! On trouve souvent des spécimens en bon état de conservation qui illustrent bien leur mode de propulsion par réaction Voici la photo d'une autre espèce de méduse que j'ai un peu 'bricolé' pour avoir nets, à la fois la bouche et le fond de l'ombrelle : il s'agit du montage de deux photos prises à des plans de focalisation différents. Mais l'un des plus intéressant sujets à observer sont les tentacules qui constituent des outils de chasse sophistiqués : les tentacules sont couverts de cnidocytes qui produisent des nématocytes . Un nématocyte est une sorte de capsule chitineuse contenant un dard enroulé et un organe de déclenchement, le cninocil qui dépasse. Le cnidocil est sensible au contact mais probablement aussi à des substances chimiques émises par les proies. Lorsqu'il détecte celle ci, le dard est projeté avec violence et perce l'épiderme ou l'exo squelette de la proie. A ce moment là le venin est injecté. Il est difficile de voir le contenu du nématocyte( seulement avec le microscope électronique ) mais on peut provoquer leur décharge en ajoutant un peu de vinaigre sur la lame. L'animation ci dessous montre le déploiement d'un tentacule et les autres photos donnent le détail des nématocytes particulièrement visibles sur cette espèce. . En haut à droite détail des tentacules (x 15) , en bas à gauche (x 40 ): détail des cnidocytes sur le tentacule. Noter : le cnidocil et une structure repliée à l'intérieur . En bas à droite on voit les filament des nématocytes déchargés, reliés au dard, dont la longueur est importante Un dernier détail que l'on peut facilement observer en particulier sur l'obélia ( photo de droite) est représenté par des statocytes qui sont des organes régissant l'équilibre et sont situés dans une sorte d'ampoule à la base des tentacules. Le statocyte contient un statolithe arrondi en matériau dense (calcaire ) qui appuie sur des fibres nerveuses et permet de transmettre les informations de mouvement au système nerveux simplifié de la méduse . La photo de gauche montre un statocyte sur le bord de l'ombrelle d'une hydromèduse. Donc n'ayez plus peur des méduses : évitez simplement de les toucher (même si elles sont échouées sur la plage ! ) et observez les gracieux mouvements de leur ombrelle dans l'eau !
-
SUCTORIA II Jean-Marie Cavanihac, Mais vous n'êtes pas au bout de vos surprises : les suctoria sont classifiés comme CILIOPHORA /PHYLLOPHARYNGEA , car les jeunes suctoria ont des cils !. Ils les perdent lorsqu'ils se fixent sur un support qui leur convient et ils sont très difficiles à identifier sous cette forme larvaire. Le processus de reproduction est en effet assez étrange mais très captivant : la génération des larves se fait par bourgeonnement de l'individu adulte. On peut voir les cils qui commencent à s'agiter alors qu'elles sont encore fixées, puis elles se séparent en cherchant un support. Rassurez vous, elles n'ont pas la vitesse de déplacement des protozoaires excités que nous connaissons et laissent le temps de les suivre. Une autre espèce que j'avais trouvée, n'a pas de lorica rigide mais s'est aimablement prêtée à l'observation de ce processus : sur les quelques individus fixés sur un bugula , l'un d'entre eux était en train de bourgeonner . Cette séquence animée a duré 15 minutes ). Cette sorte de fleur est l'adulte (partie sombre) et ses 'pétales' sont les jeunes larves qui sont prêtes à prendre leurs envol. Sur la vue en temps réel leurs cils commençaient à battre régulièrement. Objectif x 15 Les larves ressemblent beaucoup à des ciliés (puisqu'elles en sont ! ) mais elles se déplacent nettement plus lentement et sur de courtes distances. Si je n'avais pas vu leur naissance je les aurais prises pour des ciliés un peu ralentis ! Voir images ci dessous au x 40 . Sur celle de droite on distingue déjà une ébauche de tentacules et une sorte de structure repliée. Comme on va le voir ces larves ont une brève existence sous cette forme : lorsqu'elles trouvent un support à leur goût (sur quels critères de choix ??) elles se fixent perdent leurs cils et se métamorphosent immédiatement en adultes. Mais il était l'heure du dîner (je ne pense pas qu'à ça mais il m'arrive de manger aussi de temps en temps ... et la durée du repas fut d'ailleurs très utile pour observer la suite ): j'ai laissé la lame en place (en réalité une lame puits) couverte, pour éviter l'évaporation en laissant les jeunes vivre leur vie . Demi heure à trois quart d'heure plus tard , je reprenais les observations et trouvais l'image ci dessous : a présent l'adulte était entouré d'une demi douzaine de petits suctorias qui grandissaient presque à vue d'œil ! Je recherchais alors un autre spécimen bourgeonnant et j'étais décidé à suivre pas à pas le processus pour ne pas manquer l'étape de la métamorphose des larves : j'en trouvais un et attendis le départ des larves. Je vous fais grâce des images intermédiaires et je vous propose cette 'bande dessinée' des aventures d'un des rejetons du suctoria. Une fois la larve fixée, sur l'enveloppe du bugula (partie rougeâtre) j'ai pris des images à intervalles réguliers (1 toute les 2 minutes) sur plus d'une demi heure et obtenu l'animation ci dessous . Ce qui est fascinant c'est la rapidité de la croissance : imaginez que, vous vous installiez pour faire une sieste sous un arbre à l'aspect inoffensif qui porte de grosses noix; pendant votre demi heure de sommeil, les noix tombent se mettent à pousser et vous vous réveillez entouré de mini vampires qui tendent vers vous leurs tentacules dans l'attente d'un bon repas (vous en l'occurrence !). Effrayant n'est ce pas ... (Objectif x 15, mosaique de 5 images réduite de moitié) Je pars vivre ma vie ! Un joli coin pour grandir ! Désolé mon vieux J'y étais avant ! C'est parti pour la métamorphose ! Voici la séquence animée d'une durée en temps réel de 20 minutes à raison d'une image toutes les deux minutes. Il s'agit de l'individu marqué par la flèche dans la BD ci dessus. Notez qu'il y a un autre individu dans le coin gauche en bas qui grandit comme l'ombre du premier ! Attendez le chargement complet pour voir l'animation ! C'était le début de l'hiver lorsque j'ai recueilli ces spécimens. La température de la mer était d'environ 14 -15 ° . Peut être est ce le choc thermique en passant à une ambiance de 20 ° qui a déclenché le processus ? Le fait est que, le fond de la boite de pétri qui me sert à trier les spécimens, était couvert de dizaines de ces jeunes suctorias. Il est utile de noter également que d'aussi longues observations ne sont possibles qu'à condition d'utiliser une lame puits (photo ci dessous : voir article sur ce sujet dans Microscopies) avec suffisamment d'eau, qui évite l'évaporation rapide, ET un éclairage 'froid' par LED blanche: un éclairage par ampoule à incandescence aurait probablement 'cuit' les spécimens avant la fin du processus.
-
SUCTORIA Jean-Marie Cavanihac, Le monde microscopique est source d'étonnement perpétuel, surtout lorsque nous rencontrons des créatures étranges à l'apparence et au fonctionnement déroutant. Parfois je me prends à penser que les auteurs de films de science fiction ou autres Aliens, pourraient trouver dans le micromonde des créatures stupéfiantes ou effrayantes : il suffirait de multiplier leur taille par quelques milliers de fois ! . Ainsi pourrait on parler des suctoria, protozoaires fixés par une tige non contractile et développant de gracieuses branches à partir de leur corps comme dans l'animation en lien ci dessous. Mais ne nous y trompons pas, ce sont de véritables petits vampires qui n'ont pas de cystosome (bouche) comme les autres protozoaires mais ces bouquets de tentacules avec lesquels ils capturent leurs proies . En effet elles portent à leurs extrémités des sortes de disques ou boules adhésives : ce n'est pas un protozoaire attachant mais franchement collant ! animation d'un suctoria qui sort ses tentacules (objectif x 40, une image toutes les 2 secondes ) Quelques images de diverses espèces de suctoria avec objectif x 15 : Quand un autre protozoaire touche l'un de ces disques, il reste collé et aussitôt, chez cette espèce tout au moins, d'autres tentacules s'abaissent et viennent l'immobiliser . Au début rien ne se passe et on voit les cils du protozoaire qui continuent de s'agiter. Mais si vous observez bien, un étrange ballet commence : les disques semblent avoir dissous la membrane du protozoaire et une sorte de flux de granules apparaît tout le long des tentacules comme si le cytoplasme de la proie était transféré goutte par goutte vers le suctoria. En quelques minute le protozoaire est vidé de sa substance , les cils s'arrêtent de fonctionner et la membrane vide et rétractée est rejetée.! l'animation ci contre est prise en 5 minutes de temps réel. (x 40) Attendez le chargement complet pour voir l'animation ! Tous les spécimens que j'ai capturés vivent dans l'eau de mer et plus particulièrement, fixés sur des espèces de bryozoaires (bugulas) de couleur rouge. Je n'en ai jamais rencontré sur des bugulas clairs ou ayant une structure calcaire. .
-

Aventures microscopiques - Episode I
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
Aventures dans un jardin public Jean-Marie Cavanihac, Souvent les débutants (de tous âges !) en microscopie se demandent ce qu'il pourraient bien se mettre d'intéressant sous la dent (traduisez : placer sous l'objectif ! ) . Voici une petite histoire (vécue) qui pourra leur donner des idées. L'été dernier , pendant nos congés, je visitais avec ma femme, une petite ville prés de notre lieu de vacance dans le Sud Ouest de la France; vous savez ce que c'est : on visite, on prend des photos et au bout d'un moment on a un petit creux et envie de se reposer. Fort heureusement un jardin public était à deux pas et nous nous assîmes (dur, dur, le passé simple ! ) pour manger un gâteau . Nous regardions les hauts marronniers qui nous offraient leur ombre, et dont les feuilles s'agitaient sous la brise, les bosquets de fleurs vives, le joli petit pont de bois qui traversais une mare artificielle :.... une mare ai je dis ? mais il doit bien y avoir quelques créatures microscopiques dans celle ci !. Seulement voilà, je n'avais pas prévu cela et je n'avais pas de récipient pour prendre des échantillons d'eau ..que faire,? Je me rappelais alors que j'avais dans ma poche une boîte de film 35 mm et voici mon récipient tout trouvé. note : Il n'était pas indifférent dans ce cas de manger le gâteau D'ABORD (mais vous n' êtes pas obligés de manger non plus ! ) AVANT de prendre l'échantillon plutôt que de faire l'inverse : les micro organismes contenus dans l'eau et déposés sur nos mains ne nous veulent pas forcément du bien... Cela pour dire qu'il faut toujours être prudent lors des prélèvements . Bravant les bêtes sauvages qui devaient se tapir sous les nombreuses algues, (alligators, piranhas,... hippopotames ? ) ainsi que les énormes carpes qui se battaient pour saisir des morceaux de pain, je plongeais dans l'eau, assez troublée par ce remue ménage, ma boite de film en raclant au passage les fins dépôts sur les pierres du bord. Je ramassais aussi un fragment d' élodée qui flottait sur l'eau. Bon j'arrête là mes souvenirs de vacances car je pense que je commence à vous lasser (c'était juste pour faire durer le suspense ! ) ..Le plus intéressant était ... dans la boîte de film. Comme je repartais le lendemain et que je n'avais pas mon microscope, je mis la boîte au frais en attendant. Arrivé chez moi, je prélevais ce qui s'était déposé au fond et voici le résultat. Je passe sur les organismes archi connus (?) : protozoaires euplotes, vorticelles etc...pour ne parler que de ce qui sort un peu de l'ordinaire et d' espèces que je n'avais encore jamais rencontré ou seulement en de rares exemplaires. Sur le chapitre des protozoaires voici une photo de famille de quelques espèces voisines avec des formes élégantes : Vaginicola , thuricola et cothurnia. L'image la plus à droite montre deux individus dans une sorte de kyste. L'animation montre des particules vertes probablement des algues symbiotiques qui se déplacent assez rapidement à l'intérieur du cytoplasme . Vaginicola Cothurnia fixés sur une algue Thuricola En regardant de plus prés (comme quoi il faut être attentif ) je remarquai au bord d'une lorica de tout petits protozoaires avec un corps arrondi et semble-t-il des tentacules dressées au dessus . Ils sont également rétractiles mais j'avoue n'avoir jamais rien vu de semblable : probablement des choanoflagellés Salpingoeca Bien entendu dans la pellicule de vase qui recouvrait les pierres il y avait les habituelles amibes testacées : Photos d' arcella de trois quart et de dessus (ce n 'est pas les mêmes: dans la seconde on distingue la masse du protoplasme ). Je n'avais encore jamais rencontrée l'euglyphe épineuse . Pour la technique, la photo de centropyxis à droite est la somme de deux images avec des plans de focalisation différents faite sous ASTROSTACK : Ci desus : centropyxis euglypha acanthophora Il y avait aussi des diatomées comme gomphomena, ou pinnularia mais je ne mets pas d'images parce qu'elles sont bien connues aussi. les Desmidiées sont souvent présentes dans l'eau des mares comme ce long closterium, visible à l'œil nu (je n'avais rencontré que les espèces en 'croissant' ) et ce pediastrum Toujours les classiques spirogyres (connues aussi , mais je ne m'en lasse pas !) une eudorina dont on voit très bien les flagelles et ce groupe de petites algues en forme de croissant dont j'ai perdu le nom ... J'observais ensuite les feuilles de l'algue élodée et je trouvais de nombreuses loricas contenant un rotifère que je n'avais jamais rencontré, probablement limnias melicerta : quand on le dérange il s'en va en avançant avec sa couronne de cils. Il y avait aussi des lecanes avec leur carapace de tortue , mais vous les connaissez déjà. En triant les sujets dans la boite de pétri je tombais tout à coup sur ceci qui m'intrigua fortement : L'animal bougeait lentement ses appendices et le contenu indistinct de l'abdomen me faisait penser à une forme larvaire. J'en trouvais un second quelques millimètres plus loin, puis dans l'ombre du bord de la boite de petri, je trouvais enfin la mère de ces bébés qui était une grosse puce d'eau : probablement Daphnia Obtusa : on voit dans l'image ci dessous les bébés sortant de la poche incubatrice . Ici encore un sujet que je n'avais jamais rencontré. Note : l'image ci dessous prise à X 2,5 est une mosaïque de 5 images assemblées manuellement (çà va aussi vite ) sous PSP (et réduite d'un facteur 2) . Bien que ce fut (j'use ma réserve de passé simple aujourd'hui !) la fin de mes congés, et que je n'ai pas eu assez de temps pour les peaufiner, ces observations non préméditées comptent parmi les plus captivantes que j'ai faites et montrent qu'il suffit parfois d'un peu d'intuition et d'opportunité pour faire des découvertes intéressantes dans seulement 25 ml d'eau, sans technique de prélèvement (filet etc...) particulière. Je profite de l'occasion pour donner quelques conseils pratiques concernant l'observation des échantillons : en effet comme j'étais pressé je n'ai pas procédé de la façon habituelle et j'ai failli 'louper' la grosse daphnie dans l'ombre du bord de la boite de pétri… et il y en avait une et une seule dans le prélèvement ! . Habituellement pour ne rien laisser échapper dans les observations je procède ainsi : 1 - Transvaser l' échantillon liquide dans un bocal transparent à large ouverture (pour permettre l'oxygénation) et laisser reposer dans la pénombre, au frais pendant une heure : la boue décante lentement et l'eau devient claire 2 - observer à travers le bocal avec une loupe : les 'gros engins' : daphnies , copépodes , vers, larves d'insectes …. deviennent facilement repérables et ont peut les aspirer (bonne chance avec les copépodes !) avec un compte goutte monté à l'envers (la grosse ouverture du tube étant dans l'échantillon) : la surface de capture est plus grande et l'aspiration moins forte pour ne pas endommager les sujets. 3 - Prélever ensuite le dépôt du fond (sans agiter! ) par petites quantités, en l'étalant dans une boite de pétri de 40 à 60, mm de diamètre, ou une lame à puits bricolée et observer avec une forte loupe ou avec le plus faible grossissement du micro. Prélever les sujets intéressants avec une micro pipette et les déposer sur des lames (pas plus de trois à la fois sinon on ne sais plus ce que l'on a prélevé ) avant d'observer à grossissement plus fort . Je mets peu d'eau et rarement une lamelle (si sujet intéressant difficile de le récupérer sans l'abîmer pour le laisser évoluer dans le bocal) ou j'utilise une lame à puits. Lorsque l'on pense que l'on a épuisé l'intérêt du premier prélèvement , vider la boite dans un AUTRE récipient que celui d'origine (ne pas jeter !) et continuer le processus jusqu'à avoir complètement épuisé le dépôt au fond du premier récipient . Vous en avez pour un petit moment, mais ensuite cela va plus vite car vous rencontrez des choses que vous avez déjà vues dans les prélèvements précédents et on se concentre sur les nouveaux sujets. Pourquoi ne pas jeter les prélèvements 'étudiés' ? parce qu'en les conservant quelque temps, (vous pouvez tout remettre dans le flacon d'origine à la fin ) d'autres espèces de protozoaires apparaissent, des rotifères, des amibes également plus tard ; à la température ambiante des algues comme les spirogyres peuvent entrer en conjugaison etc... et pendant une quinzaine de jours vous pourrez observer d'autres sujets qui n'étaient pas là (ou sous formes de spores ou de kystes ) le premier jour. JMC - 2003 -
LA VIE CACHEE DES OURSINS - par J.M. CAVANIHAC Comment tout commença ? : après une longue et fatiguante observation dans une touffue forêt d'algues microscopiques, soudain, au détour d'un embranchement, je tombais sur ceci qui tenait fermement un fragment de ce qui avait dû être un copépode. : Je me frottais les yeux, rougis par l'observation: était ce un fragment d'un minuscule E.T. ? Comme je ne connaissais pas de crustacés possédant des pinces à trois doigts, je rangeais cette image dans mes 'dossiers X' (des affaires non classées, j'en ai moi aussi ! ...) avec d'autres bizarreries biscornues. Mais la vérité était ailleurs comme je le constatais plus tard en étudiant les oursins. Même les lecteurs habitant loin de la mer connaissent les oursins... à défaut d'y avoir goûté. C'est rond, noir et ça pique ! Quel intérêt microscopique peuvent ils bien avoir ? Je ne parlerai pas de celui du microscope (surtout le stéréo microscope ... ) pour retirer les piquants que l'on récolte dans les pieds, l'été en se promenant dans les vagues, mais de celui d'accessoires (si l'on peut dire...) que porte la coque de l'oursin (le test, pour lui donner son nom scientifique) . L'oursin, dont les ancêtres sont apparus il y a 500 millions d'années, et sont présent dans de nombreux terrains fossilifères, appartient à la famille des échinodermes, de même que l' étoile de mer avec qui, il partage de nombreux points communs et en particulier une symétrie d'ordre 5. Les oursins sont intéressants à plusieurs titres: ce sont des sujets pratiques pour étudier l'embryologie in vitro : un œuf fécondé se développe en quelques heures et divers stades de la larve peuvent être observés. L'un des plus beaux est celui de la larve pluteus avec sa forme de flèche , qui n'avance pas toutefois dans le sens de la flèche mais à l'envers, les 'bras' oraux recouverts de cils rabattant la nourriture vers la bouche placée entre eux (à droite de la photo). Ces bras sont soutenus par des barres de calcaire constituant un véritable squelette interne : Mais le plus extraordinaire ou du moins le plus spectaculaire à mon sens, sont des organes disséminés entre les piquants de l'oursin adulte, plus nombreux autour de la bouche et qui mesurent tout au plus le quart de la longueur de ceux ci . J'aurais pu vous présenter la galerie d'image les concernant et vous laisser deviner à quelle créature (extraterrestre ??) appartiennent ces éléments mais je vous laisse partager le spectacle ... D'abord une petite animation : je précise que l'objet en question est séparé depuis plusieurs heures de l'oursin et que manifestement il continue à travailler pour son propre compte ! (image à x 6) ! Ce modèle n'est pas le seul outil dont dispose l'oursin : il en existe d'autres ci dessous, récoltés toujours sur le même individu avec des formes et modèles variés et des fonctions certainement spécialisées. Je vais arrêter là le suspense et identifier les objets inconnus : il s'agit de pédicellaires, qui sont plus nombreux autour de la bouche et servent à nettoyer le test et les abords de celle ci. Il est vrai que, contrairement à d'autres fruits de mer , les oursins paraissent toujours très propres sans algues, ni concrétions, ni parasites d'aucune sorte collés à eux. Mais la surprise ne s'arrête pas là : on voit par transparence que les 'pinces' contiennent des structures osseuses qui leur assurent rigidité et articulation. Pour en savoir plus j' ai utilisé une solution de Dakin (c'est un antiseptique contenant du chlore stabilisé : l'eau de javel diluée fonctionne peut être mais contient de l'hydroxyde de sodium qui est caustique ) qui dissous la partie épidermique des pédicellaires sans attaquer les osselets, et on découvre des merveilles de finesse avec des systèmes d'articulation sophistiqués, des 'dents' ou des crénelures suivant la fonction du pédicellaire. Certains ont une tige rigide, d'autre un bras souple , les deux portant des cils vibratiles très fins mais que l'on peut deviner aux mouvements des particules environnantes. Sur les photos à droite un autre type d'os de pince et la même en lumière polarisée (X 15) Ces pinces à trois doigts sont appelés triphylus : en voici la totalité des os en position ouverte en lumière polarisée : Comme les osselets sont formés de calcite (carbonate de calcium ) qui possède un pouvoir rotatoire sur la lumière , on peut obtenir de magnifiques images en lumière polarisée . Cela vaut aussi pour la larve : (le champ de la larve pluteus de droite ou l'on voit les barres de calcaire est un peu sombre car ma caméra est insuffisamment sensible pour rendre toute la beauté du spectacle ) . Il semble que ces structures aient un contrôle autonome (les cils de leur tige servent peut être de moyen de détection des intrus) et peuvent résister et continuer à bouger plus d'une semaine dans de l'eau de mer placée dans le réfrigérateur. Les plus impressionnantes sont celles (globifères) qui possèdent les griffes ci dessous (x 6) (c'est celle de l'animation plus haut) : et dont le détail de la griffe indique qu'elles sont venimeuses et conçues pour injecter une substance toxique aux intrus : en effet un canal apparaît clairement dans la griffe supérieure sur la vue de droite (x 40) : Il semble que ces structures aient un contrôle autonome (les cils de leur tige servent peut être de moyen de détection des intrus) et peuvent résister et continuer à bouger plus d'une semaine dans de l'eau de mer placée dans le réfrigérateur. Les plus impressionnantes sont celles (globifères) qui possèdent les griffes ci dessous (x 6) (c'est celle de l'animation plus haut) : et dont le détail de la griffe indique qu'elles sont venimeuses et conçues pour injecter une substance toxique aux intrus : en effet un canal apparaît clairement dans la griffe supérieure sur la vue de droite (x 40) : Ci dessous voici le détail d'un des trois os : (X 15) les griffes sont à droite Comment obtenir des pedicellaires ? inutile d'essayer avec une pince à épiler : elles sont quasiment invisibles au milieu des piquants ! J'utilise la méthode suivante : je place l'oursin vivant que je viens de pécher (je n'ai pas essayé avec des oursins vendus dans le commerce, ) dans un bol avec de l'eau de mer, le coté oral ( la bouche) en haut et je dirige aux alentours de celle ci un fort jet d'eau (obtenu avec une seringue de 50cc). Je recommence deux ou trois fois l'opération en utilisant l'eau du bol pour remplir la seringue, je rend l'oursin à son environnement et je laisse décanter le bol. Les pédicellaires tombent au fond et si vous êtres chanceux (le bol... encore !..) peut être aussi quelques œufs que l'oursin aura laissé échappé dans son émotion. (Ce sont ces œufs, de couleur rouge orangé que les amateurs d'oursin mangent à la petite cuillère...) . Que les âmes sensibles se rassurent, l'oursin va rapidement reconstituer ses pédicellaires cassées comme tous les échinodermes qui ont une faculté de régénération surprenante, l'étoile de mer étant par exemple capable de régénérer en totalité un de ses bras . Juste un petit plus : les oursins sont des animaux attachants et déploient dans l'eau des dizaines de petits appendices ou podia, terminés par une ventouse : la traction est très forte puisqu'il faut tirer fermement pour détacher l'oursin de son support (le bol dans le cas ci dessus) . Lors de cette manœuvre plusieurs podia sont rompus et restent attachés sur le bol par une sorte de ventouse ronde. En appliquant à celle ci le traitement au chlore (on voit d'ailleurs deux bulles de chlore piégées sur l'image de doite ) on obtient les 4 osselets principaux la constituant et d'autres d'une finesse remarquable : Ces quatre osselets semblent porter des griffes sur leur partie externe. (détail à droite x 15). Ils sont tenus et renforcés par une structure carrée centrale que l'on voit bien sur la vue de gauche. Celle ci est séparée du reste dans l'image ci dessous (mais les os ne sont pas cassés, il s'agit de 3 couches de 'feuilles' indépendantes) et le dessin donne une idée de l'organisation de la ventouse d'un podia vu en coupe : Copyright © JM CAVANIHAC Mai 2002
-
POILS DES PLANTES Jean-Marie Cavanihac, Les poils font partie de l'évolution des mammifères : leur fonctions étaient diverses à l'origine : protection contre le froid, contre les piqûres d'insectes etc... Mais les plantes elles aussi portent des poils, plus ou moins denses ou clairsemés. Il est probable que leurs fonctions sont similaires : protection contre les insectes tout d'abord. Voici une observation facile à faire avec les plantes du jardin ou à l'occasion d'une promenade dans la nature . Nul doute que le poil ci contre est quasiment une défense anti char,... (on appelle cela des 'chevaux de frise' ne me demandez pas pourquoi !) à l'échelle d'un puceron et un poil ordinaire prend la taille d'un arbre toujours à son échelle ! . Mais les poils des plantes ont probablement d'autres fonctions : ils augmentent la surface des feuilles et tiges et peuvent permettre une meilleure régulation de la température. Souvent le dessous des feuilles est couvert de poils qui piègent les gouttes de rosée et permettent ainsi de ralentir le dessèchement. Pour nous, amateurs de mondes microscopiques, les poils présentent aussi un grand intérêt et cela pour plusieurs raisons : 1 - ils sont faciles à trouver , dans votre jardin ou même sur votre balcon, 2 - ils sont intéressants par leur variété de formes, Enfin ce sont de très bons objets pour s'initier au montage de préparations sous gélatine glycérinée par exemple. C'est d'ailleurs un sujet type, assez facile, pour démarrer les activités de microscopie,qui permet d'illustrer les diverses étapes de notre démarche : collecte, prélèvement/traitement des échantillons, observation, montage . Par ailleurs les observations n'exigent pas un grandissement important (photos de cet article prises au x 6,3 ou x 15 pour les détails ) ce qui les mets à la portée de tous , y compris des microscopes bon marché. Donc le printemps est là, la nature se réveille et les plantes poussent partout, y compris des herbes sauvages que nous aurions tort de mépriser dans notre quête de sujets intéressants. L'identification des espèces peut poser quelques problèmes mais ce n'est pas le but du jeu : simplement trouver des objets surprenants à observer. Il y a juste un petit préalable à leur obtention qui est de les prélever de la manière schématisée ci dessous : avec un scalpel ou un cutter bien tranchant tenu incliné (attention les doigts ! ) faire une légère incision sur la tige d'un demi millimètre de profondeur si possible. Attraper le bout découpé et tirer doucement avec une pince à épiler par exemple. Un morceau d'épiderme de plus en plus fin va se détacher : placez le immédiatement dans une goutte de liquide glycériné et recommencez l'opération pour avoir un certain nombre d'échantillons. Les meilleurs seront ceux où on a réussi à enlever (même sur quelques millimètres seulement ) une seule couche de cellules qui permettra de voir les poils et leurs fixations. Pour commencer, voici un poil pas plaisant du tout, celui de l'ortie : pourtant en dépit des cuisants souvenirs qu'il nous laisse c'est une merveille de réalisation : le poil est une partie d'une glande située à sa base qui secrète, entre autre, de l'acide formique (celui des fourmis). La pointe en est très fragile et se brise en biseau au moindre contact pour mieux se planter dans votre peau. Le même mouvement comprime la base du poil qui se fait un plaisir de vous injecter le venin ! Mais le spectacle est aussi un émerveillement en lumière polarisée. Le détail montre l'extrémité d'un poil intact ou l'on voit très bien le canal interne. Autre grand classique : le poil de géranium (ou plutôt de pélargonium) : tout le monde connaît la senteur forte de ces plantes (qui passent pour éloigner les moustiques) dés qu'on les touche et le microscope nous en donne l'explication car le poil porte à son extrémité une goutte d'essence parfumée. Voici des poils avec la goutte intacte et le détail d' un autre ou elle s'est dissoute ou évaporée. La lavande aussi (qui passe également pour un répulsif des moustiques ..) présente des poils aux formes surprenantes sur les tiges et surtout les feuilles : la lavande n'a pas l'air très poilue me direz vous, mais allez y regarder de plus prés et vous serez surpris. Les poils ressemblent à des arbres en miniature (vus de profil sur l'image de gauche) Dans le genre pas très poilu : le lierre, même si les poils sont plus rares et très écrasés contre la tige : leur forme en étoile vaut le déplacement ! Autre plante intéressante le chèvrefeuille, qui vous en donne deux pour le prix d'un, car on observe deux types de poils dont ceux ci en forme de massue. Et les fleurs me direz vous: j'y arrive. Voici un poil de chrysanthème (en grec littéralement : fleur d'or ) avec de jolis poils en forme de T. Vous pouvez également observer les poils à l'intérieur de diverses fleurs (pistils en particulier …) La tige du tournesol possède de longs poils segmentés : Une plante sauvage aux feuilles dentelés genre pissenlit, nous montre quelques crochets et fourchettes: Autre 'crocs' impressionnants sur les bords d'une petite feuille : Le chardon qui pourtant est couvert d'épines, peut être pour s'excuser, nous offre le spectacle de ces poils arrondis en fond noir ... (noter que le fond noir se prête bien à ces observations … ) Mais j'ai gardé pour la fin (ci dessous à gauche au x 2 ) une application astucieuse des poils de certaines graines qui grâce à leur forme, s'agrippent à la fourrure des animaux ( à nos bas de pantalons aussi ... ) et en profitent pour se disséminer comme le fait la graine de Bardane. D'ailleurs ce sont elles qui donnèrent à un ingénieur Suisse, Georges de Mestral , dans les années 50, l'idée (et le brevet) du Velcro* : Il ramenait (et son chien aussi...) , de ses promenades, ces graines très 'attachantes' et il eut l'idée de les observer au microscope... et l'idée du velcro prit forme . Après plusieurs années de mise au point elle conduisit aux produits que nous connaissons aujourd'hui. N'est ce pas une belle histoire qui illustre bien l'apport de la curiosité à la science ... ? (A droite image d'un autre poil d'une autre graine qui utilise le même principe, mais je ne sais pas son nom ! ) * Velcro est la contraction de VELvet (velours)CROchet : observez au microscope les deux parties d'un velcro et vous comprendrez pourquoi. Le problème majeur a longtemps été la réalisation industrielle des crochets. Voir : http://inventors.about.com/library/weekly/aa091297.htm Voici d'ailleurs une image des deux parties d'un velcro : crochet et boucles : JMC
-
MICRO-OUTILS POUR MICROSCOPIE J.M. CAVANIHAC Nous observons le micromonde, mais nous avons peu de moyens d'agir sur les objets faute d'outils de taille acceptable. Parfois il serait bien pratique de retourner une diatomée pour la voir sous un autre angle mais comment faire ? Dans la continuité du "Faites le vous même " (DIY: Do It Yourself en anglais !), voici quelques petits trucs pour réaliser de micro outils : Aiguille montée : d'accord, elles ne coûtent pas trop cher encore faut il pouvoir se les procurer, mais on peut les réaliser très simplement : un bout de tourillon bois de 6 mm de diamètre (magasins de bricolage) , un petit trou de 1 mm dans l'axe et collé dedans par la tête, une simple aiguille. Personnellement je préfère utiliser un fil d'acier inox de 0,5 mm (voir articles de pèche, magasins de modélisme ..) affûté à la lime (ou petite meule) et poli à la toile émeri fine, car il ne rouille pas ! Dans la même veine vous pouvez faire une aiguille 'lancéolée' avec cette fois un fil plus gros aplati au marteau et limé puis poli en forme de flèche éventuellement tranchante sur les bords (idem ci dessus pour le manche !) Jusqu'ici , ce n'est pas trop difficile, sauf que si vous regardez la pointe au microscope, elle ressemble plutôt à un pieu . Comment obtenir une pointe plus fine : par électro-érosion et là on attaque des techniques de pointe (sans jeu de mot ...) exigeant.... un laser à plasma ? (non je plaisante )... une simple pile électrique ! Attention : ne JAMAIS utiliser une alimentation reliée au secteur ou pouvant délivrer un fort courant (genre chargeur d'accus) . En effet l'électrolyse d'un métal est capable d'arracher des atomes et de façonner des formes très fines. Voici le dispositif ci dessous qui parle de lui même . L'électrolyte, solution ou sont plongées les électrodes dont une est à usiner, est constitué d'eau salée (1/2 cuillère à café dans un verre d'eau) Lorsque l'on fait passer le courant des bulles d'hydrogène se dégagent au pole négatif (cathode en cuivre ) et la solution prend une couleur brun rouge du coté de l'anode (notre fil d'acier à usiner) car les ions fer passent en solution. La durée d'usinage est plus ou moins longue selon le diamètre du fil (compter environ 1/2 heure pour un fil de 0,5 mm selon courant, salinité, distance entre électrodes : plus le courant est faible plus l'usinage est fin) et le résultat que l'on peut contrôler périodiquement au microscope est le suivant : La pointe fait de l'ordre de 20 microns de diamètre : SANS avoir été affutée mécaniquement auparavant : le fil a été juste coupé à la pince. Le travail de ces petits électrons n'est il pas merveilleux ? Pour usiner uniquement la pointe ne laisser tremper qu'un ou deux millimètres dans la solution. Si vous voulez affiner le fil au préalable, tremper 1 à 2 cm et électrolyser jusqu' à ce que le diamètre soit passé par exemple à 0,2 mm sur la partie immergé puis remonter et laisser tremper les 1 ou 2 millimètres pour fignoler la pointe : Ici les résultats sont obtenus avec du fil inox (qui est un alliage) et l'attaque est moins régulière qu'avec du fil d'acier ordinaire (corde à piano) , mais celui ci à l'inconvénient de rouiller . On peut de la même manière affiner des formes préalablement forgées (ou trouvées toutes prêtes dans le commerce comme ces aiguilles à appâts pour pêche au "vif" ) : à gauche extrémité 'usinée' : Autre outil intéressant : des micro pipettes : le compte goutte est en général trop gros et trop peu précis pour ré-aspirer un objet, par exemple localisé sous faible grossissement . Vous pouvez demander auprès d'un laboratoire d'analyse médicale (lors de votre prochaine prise de sang ...) quelques tubes MICRO HEMATOCRITE, qui servent à faire des prélèvements sur les bébés. En général ils sont héparinés à l'intérieur ( l'héparine est un anticoagulant ) et il faudra bien les rincer avant usage. En chauffant doucement le milieu d'un tube sur une PETITE flamme et en tirant sur les extrémités, le verre fondu s'allonge et se rétrécit. On s'arrête de tirer à un diamètre de 1 à 0,5 mm environ et on brise au milieu de la partie rétrécie. En rebrulant les extrémités à la flamme ou en les passant sur de la toile émeri très fine on peut avoir une ouverture très nette (contrôler au microscope) . On peut à défaut procéder de même avec un tube plastique genre recharge de stylo en plastique vide en la plaçant PLUS HAUT au dessus de la flamme et en la faisant tourner sur elle même (pour éviter que le plastique ne brûle). Il suffit alors de couper au milieu de la partie étirée avec une lame de rasoir et ce dernier type de pipette est pratique car incassable et souple. Par contre il n'est pas transparent Ci dessus : capillaire pour microhématocrite : taille réelle (Trait bleu = non hépariné ). Ci contre capillaire étiré et pointes après cassure. NB : éviter de les utiliser dans des boites de petri en plastique car ils rayent le fond. Utiliser plutôt des capillaires plastique. Pour utiliser ces capillaires c'est très simple : les monter dans un tube de compte goutte à l'envers au travers d'un petit bouchon de caoutchouc (gomme de crayon porte mines) : (éviter de faire venir le spécimen dans le corps du tube compte goutte car il sera difficile de le faire redescendre dans le capillaire ! ) On n'insistera jamais assez : ne JAMAIS aspirer avec la bouche : risques de contamination ! Si vraiment vous n'avez pas de compte goutte, des dosettes unidoses de collyre ou de sérum physiologique (ou même d'éosine ! voir rayon parapharmacie des grandes surfaces ...) sont très pratiques : ici le capillaire est en plastique introduit en force et collé dans le tube et le tube dans la dosette. Pour manipuler les échantillons, j'avais oublié de signaler que l'on peut trouver en pharmacie des aiguilles d’acupuncture très fines que l'on peut monter dans un manche en bois pour plus de commodité de manipulation : l’échelle sur la pointe est de 200 µm Petit bonus : le filet à plancton ! On peut se compliquer la vie à essayer d'en réaliser un 'vrai' mais en voici deux modèles très simples (filtres à café en mailles plastique ) l'un souple et plus fin (on peut vider à l'intérieur plusieurs seaux d'eau pour concentrer les micro algues) et l'autre rigide et lesté (2 plombs de pèche de 50 gr) pour envoyer à quelques mètres dans l'eau , avant de rincer leur contenu dans un peu d'eau dans un petit seau. (Bien entendu si vos sources de prélèvement sont 'douteuses' ne pas oublier d' utiliser des gants de protection et de désinfecter les filets à l'eau javellisée en rentrant à la maison . ) Ne me dites pas que tout cela coûte trop cher ! et vous serez étonné de ce que vous pouvez en faire... Bon bricolage !
-

Determiner la taille des sujets observés
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
MICROSCOPIE QUANTITATIVE ( … une approche !) par J.M. Cavanihac Tout microscopiste amateur (ou non !) s'est un jour posé la question de connaître la taille de ce qu'il observe . Ce n'est pas si anodin que cela : des espèces de diatomées, ou de protozoaires par exemple peuvent être différenciées à partir de leur dimensions. Pour un microscope le grossissement total est donné par le produit du grossissement de l'objectif par celui de l'oculaire. C'est très bien en théorie , mais qu'advient-il après l'adaptation plus ou moins sophistiquée d'une caméra sur le tube du microscope ?. Il existe des micromètres objets (que l'on mets donc à la place de l'objet ) et des micromètres oculaires (qui sont installés à demeure entre les deux lentilles de ce dernier ). En général les micromètres oculaires doivent être étalonnés à partir d'un micromètre objet en fonction des objectifs utilisés: deux graduations espacés d'1/100 de mm sur l'objet correspondent par exemple à 23 graduations du micromètre oculaire, ce qui ne rend pas franchement commode la conversion surtout lorsqu'on change d'objectif et ne permet pas d'en garder la trace sur l'image. Actuellement il est possible d'acquérir facilement un tel micromètre objet pour quelques dizaines d'euros et d'en superposer l'image sur celle du sujet observé. Mais à défaut, il existe une autre solution, relativement précise, à la portée de tout le monde pourvu que vous ayez un logiciel de traitement d'image (dessin) (même rustique) et quelques couvre objets. Bien entendu le processus est le même si vous avez un micromètre objet comme référence ou une lame de comptage divisée en carrés genre Malassez, Nageotte... Les couvre objets ont environ 0,17 mm d'épaisseur. Mais on peut être un peu plus sûr de leur épaisseur moyenne en en empilant une trentaine (ce qui devrait nous faire 5,1 mm d'épaisseur ) , que l'on peut contrôler avec un double décimètre ou mieux un pied à coulisse. Si par exemple on trouve 5,4 mm c'est qu'ils font 0,18 mm en réalité. Posons un de ces couvre objets verticalement sur une lame en le fixant par une boulette de mastic ou mie de pain et faisons la mise au point (attention de ne pas descendre l'objectif trop vite …sinon casse assurée! ) sur sa tranche . Prenez une photo et, sur l'écran de l'ordinateur, dans votre logiciel de visualisation favori, mesurez (avec le double décimètre) la taille de cette tranche très grossie. Dans mon cas avec l'objectif de 15 et tous les divers grandissements dus à l'adaptation de la caméra je trouve 69 mm Ci dessus avec objectif 6,3 x et 15 x à droite J'ai donc un grandissement réel de 69/0,17 soit 405 fois ! Ce qui veut dire aussi que 0,1 mm sur l'objet correspond à 40,5 mm sur l'écran. Il suffit alors de tirer sur l'image un trait de 40,5 mm avec le logiciel de dessin/visu, de le copier dans un nouveau fichier et d'écrire à côté : 0,1mm avec objectif 15 x. Recommencez avec les autres objectifs et vous créez un fichier documentaire (BMP ou Jpg) avec les divers grandissements (voir ci contre ). Pour les objectifs de faibles grossissement vous pouvez observer 5 couvre objets accolés pour augmenter la précision. Vous pouvez ensuite sub diviser l'échelle pour l'adapter à la taille de la photo. Dans vos prochaines images (obtenues dans les mêmes conditions : avec le même objectif ) il suffira de copier (copy/paste) la longueur de trait correspondant au grandissement de l'objectif employé pour disposer d'une échelle fiable (à mieux que 10%) . Bien entendu insérez l'échelle avant toute manipulation de l'image : notamment Resize et Resample !. (juste un mot : la fonction Resample est en général préférable à Resize car elle réalise une interpolation des pixels manquant ou restant au lieu de les dupliquer ou de les supprimer comme fait Resize) Pour les lecteurs qui voudraient approfondir la notion de mesures diverses, je signale le logiciel GRATUIT ImageJ, téléchargeable au National Institute of Health http://rsb.info.nih.gov (en versions Mac et PC) : il s'agit d'un vrai logiciel de mesure scientifique, avec calibration d'échelle, mesure surfaces, comptage d'objets, profils de densité (optique), manipulation de piles d'images, sommation/moyennage d'images (par exemple à divers niveaux de focalisation..), rendu 3D et j'en passe… Auriez vous pensé (sans l'échelle) que ce long Chaetognate (Arrow Worm) trouvé dans du plancton marin mesurait prés de 3 mm de long ? Image échelle 1/2 obtenue avec 8 images élémentaires. -

Comment observer des échantillons liquides
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
LAMES à PUITS et MICRO-AQUARIUMS Jean-Marie Cavanihac Cela vous est certainement déjà arrivé : lors d'observations sur la vie aquatique des rivières, étangs ou mer, nous posons sur la platine de notre microscope des sujets qui baignent dans l'eau et nous nous retrouvons souvent avec les doigts mouillés ou la platine inondée. Si nous utilisons peu d'eau celle ci s'évapore assez vite (surtout avec un éclairage par incandescence ) et nos micro créatures se transforment en harengs saurs ! . C'est encore pire avec l'eau de mer car l'évaporation augmente la concentration en sel ce qui peut aussi les tuer rapidement et les débordements liquides sont corrosifs pour la platine ! Comment faire pour concilier à la fois un environnement acceptable pour les sujets et éviter les inondations ? : utiliser des micro aquariums (NB : sans eau ce sont aussi de micro vivariums !) ou ce que l'on appelle des lames à puits. Tout le monde connaît les lames à dépression (sans rapport avec le Prozac ™ !) qui sont intéressantes pour éviter d'écraser les sujets, mais qui contiennent très peu de liquide. Voici deux exemples de lames à simple et double dépression qui sont assez onéreuses et pas vraiment pratiques pour cette application. Un des buts de cet article est aussi de montrer qu'il y a pas mal d'accessoires utiles qu'un amateur un peu bricoleur peut avoir le plaisir de réaliser (cela compte aussi !) pour quelques centimes d'euros. Il est donc très facile de faire des lames à puits en collant (avec colle à deux composants, 'cristal' de préférence) des joints de plomberie sur la lame. Attention: les joints rouges sont en fibre et sont poreux, il est prudent de les vernir avant usage . Certains magasins de bricolage vendent des pochettes de joints assortis ou vous trouverez certainement votre bonheur et des joints en plastique. Voici deux exemples de lames avec des anneaux de 3 et 1 mm de haut respectivement . Si vous voulez descendre en dessous du millimètre d'épaisseur (pour réaliser l'équivalent des lames à dépression ) vous pouvez utiliser des rondelles de mica: ce minéral se clive facilement en feuilles de plus en plus fines : ici 0,1 mm à gauche et 0,5 mm à droite - (Diamètre interne 10 mm) Un autre moyen simple est de prendre une plaque de plexi de 3 mm de hauteur et de percer 4 trous de 8 mm avant de la coller sur la lame. Cette lame est particulièrement utile pour partager le contenu d'un compte goutte ou pipette afin de séparer des animaux. Micro aquarium : cette fois c'est un tube de plexi de 22 mm de diamètre intérieur qui est collé sur la lame : il peut contenir 'beaucoup' d'eau et être conservé au réfrigérateur* par exemple pour suivre le développement d'une larve ou d'un oeuf. La hauteur ne permet de l'utiliser qu'avec des objectifs de 2 à 2,5 fois mais c'est en général suffisant. Je vous donne un petit truc : vous avez aspiré (ou crû aspirer !) la bestiole qui vous intéresse, dans votre pipette. Comment la séparer des autres ? Prenez un couvercle en plastique blanc (genre couvercle de TuperWare ™) et déposez le contenu de la pipette en faisant des petites gouttes cote à cote. Puis observez avec une grosse loupe la goutte dans laquelle se trouve votre animal et aspirez le tout seul . Variante : micro aquarium rectangulaire à capacité étendue : toujours à partir d'une plaque de plexi de 3 mm dans laquelle vous découpez un rectangle (voir ci dessous) . Sa surface permet de trier les objets facilement avec le faible grossissement et la pipette. Vous pouvez même y faire flotter une lamelle qui sera guidée par les bords de la cuvette en plexi.... Voici également un accessoire utile pour éviter l'évaporation sur un échantillon: pour les plaques à puits vous pouvez y placer simplement une lamelle sur le puits mais pour les lames ordinaires vous pouvez usiner une pièce dans un anneau de plexi ou de PVC (ici de l'alu sur la photo) avec en dessous un décrochement de la largeur de la lame . De l'autre coté vous collerez une lamelle ou un morceau de lame. Je l'utilise pour des observations longues avec peu d'eau (ou pour laisser la préparation en place le temps du repas !) ou encore pour protéger les échantillons du dépôt de poussière quand ils trempent une heure dans le fixatif sur la lame. Voici une variante de boite de Petri réalisée avec une lame de verre de 40 x 40 x 1 mm utilisée pour le montage sous cache métal des diapositives photo 35 mm. L'anneau de plexi de 4 mm de haut est usiné avec un tour parallèle. Vous devez bien avoir dans vos connaissance un ami ou mécanicien qui possède cette machine outil... Très pratique aussi pour étaler et trier les sujets à faible grossissement Autre variante avec un anneau plus épais et plus haut (12 mm) : il contient davantage d'eau et son épaisseur permet de conserver la fraîcheur lorsque l'on sort les échantillons du frigo*. On ne peut l'utiliser qu'avec les objectifs de 2 ou 2,5 x. Le haut de l'anneau est usiné pour recevoir un couvercle de boite de Petri plastique (60 mm) pour éviter l'évaporation. On peut utiliser aussi du PVC, mais il n'est pas transparent et c'est moins joli ! Note: dans la culture cellulaire, les chercheurs utilisent des plaques à puits avec 4, 6, 12 or 24 puits dont voici un exemple . Elles sont particulièrement adaptées pour des microscopes inversé (ces microscopes permettent de voir par en dessous et donc d'éviter de tremper l'objectif dans le milieu liquide et également de dégager le haut des puits pour manipuler les cellules) On peut les utiliser aux faibles grossissements avec un microscope droit. Pour ceux précisément qui ont la chance d'avoir un microscope inversé, c'est un couvre objet de 22 mm qui est utilisé comme fond de cette boîte Vue de dessus Tous ces accessoires sont très peu coûteux à réaliser, ce qui permet de les faire en plusieurs exemplaires. Ils permettrons des observations dans de bonnes conditions et de conserver (parfois plus d'une semaine pour ceux à grosse capacité ) des spécimens vivants à condition de les placer au frais ( compartiment 'légumes' du frigo*) : en effet le froid réduit le métabolisme et la consommation d'oxygène qui est un facteur critique. Vous éviterez grâce à eux de mouiller la platine, la corrosion (surtout avec l'eau salée ) du microscope... et de vous ruiner en utilisant des kilomètres de papier essuie tout ! Attention : Il est conseillé d'utiliser un frigo ( de récupération par exemple ) dédié à la conservation des échantillons ou des produits chimiques. Si vous utilisez votre réfrigérateur familial, veillez bien à ce qu'ils soient placés dans des boîtes ETANCHES afin d'éviter tout risque de contamination des denrées alimentaires par des produits d'origine bactérienne ou chimiques. -

Les réactifs et colorants simples en microscopie
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
LES REACTIFS EN MICROSCOPIE J.M CAVANIHAC Dans le précédent article sur le montage des lames , j'évoquais la difficulté d'obtenir , du moins en province et en petites quantités, des produits utiles pour la préparation ou conservation des échantillons. Voici une liste des réactifs les plus utiles, les possibilités pour se les procurer (ou des équivalents : les solutions figurent en italiques) en dehors des rares maisons spécialisées, et leur mode d'emploi. Cependant j'ajouterais un préliminaire, à savoir que 90 voire 95% des observations les plus intéressantes se font ...SANS colorants ! Donc même si la tentation est grande, une fois que vous avez votre nouveau microscope, ne vous précipitez pas dans la recherche de colorants ! Produits fixateurs : Formol à 4 ou 10 % : un désinfectant pour aquariums contient ces pourcentages de formol et, malheureusement aussi un colorant bleu qui colore votre objet même si vous ne le voulez pas. Cependant ce produit est décoloré par une solution acide : vinaigre blanc par exemple, et votre objet redevient transparent. Fixateur de BOUIN : uniquement en maisons spécialisées :formol+acide picrique+acide acétique (ne convient pas pour conserver des objets calcifiés qui se ramollissent) Un autre est l'AFA qui n'utilise que 5% de formol, 5% d'acide acétique 40% d'alcool et 40% d'eau Pour la conservation des algues : 80 % alcool, 10% formol, 1% glycérine Encore un autre : alcool acétique = 1/3 acide acétique + 2/3 alcool 90 ° (peut être le plus facile à faire soi même avec du vinaigre blanc et de l'alcool : Mélange alcool 90° + Vinaigre blanc (vinaigre d'alcool): mélanger 70% alcool 30 % vinaigre : solution de dépannage (pour la petite histoire j'ai lu dans une revue américaine une solution de secours : Whisky/vinaigre dans ces proportions !: cher surtout si c'est du 15 ans d'age) Produits colorants : Eosine à 2% : pharmacies ou grandes surfaces : existe aussi en doses unitaires très pratiques Bleu de méthylène : pharmacies (anciennes surtout !) Teinture d'iode : pharmacies idem (colore en bleu l'amidon) Rouge neutre : coloration vitale non toxique pour les protozoaires : maisons spécialisées Vert d'iode : coloration des tissus ligneux (coupe de plantes) : maisons spécialisées Eclaircissant pour colorants : si vous avez trop coloré l'objet trempez le dans quelques gouttes d'alcool chlorhydrique (1 goutte d'acide Chlor. dans 50 gouttes d'alcool à 70°) Produits transparisants : Liquide glycériné : Pour observations immédiates : faites le vous même : 1/3 alcool 70 °, 1/3 eau , 1/3 glycérine (pharmacies ) Hypochlorite : solution de chlore stabilisée : dissous la cellulose et les tissus organiques (coupes de plantes ) utiliser la solution de DAKIN (désinfectant en pharmacie) . éviter l'eau de javel qui contient de la soude et est très corrosive. Solution de soude à 20% : déboucheur liquide pour éviers...CORROSIF permet de dissoudre l'intérieur des insectes pour les rendre plus transparents, les éponges pour récupérer les spicules , les diatomées pour ne garder que les frustules....neutraliser ensuite en rinçant bien avec de l'eau vinaigrée. Utiliser des gants ! Milieux de montage : Aqueux: gélatine glycérinée : faites la vous même (voir article précédent) Baume du Canada : maisons spécialisées : exige une parfaite déshydratation des objets Coumarone (résine de Coumarin) : idem . Possède un indice de réfraction élevé très utile avec les diatomées Résines de synthèse genre Eukitt : idem ci dessus (produits professionnels) Autres produits utiles : Vernis pour sceller les lamelles, vernis à ongles ou peinture à maquettes (un peu épaisse) Alcool isopropylique 90° : nettoyage des instruments, lentilles, platine microscope Solution d'alcool à 5% (1 goutte alcool 70° dans 15 gouttes d'eau distillée) : ralentisseur des mouvements des animaux aquatiques Eau gazeuse : le gaz carbonique contenu endort les animaux aquatiques Chlorure de magnésium : en pharmacie : une dilution à 30 g/litre ralentit les animaux MARINS Pour tous ces produits: il est commode de récupérer des flacons compte gouttes (genre collyre pour les yeux...) ce qui ne tiendra pas beaucoup de place sur votre table de travail: -

Collecte des échantillons avant observation
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
Collecte des échantillons Jean-Marie Cavanihac, La majeure partie de l'activité microscopique se fait à domicile, dans votre petit labo aménagé sur un coin de bureau, le dessous de l'escalier ou le fond du garage. (Dure parfois, la science à la maison !). Mais une partie du succès dépend aussi des moyens que l'on utilise pour faire des prélèvements à l'extérieur, prélever, concentrer et acheminer les échantillons. Les beaux jours approchent et il est temps de préparer les 'campagnes' de prélèvement . Note : je rappelle que des précautions doivent être prises pour le prélèvement, stockage et transport d'échantillons dans des zones que nous devons considérer comme potentiellement contaminées. S'y a des micro - organismes c'est qu'il y a des bactéries à manger !!!. Les quelques idées et astuces ci dessous fonctionnent bien et surtout elles ont un rapport coût/efficacité inégalé. Voici une petite revue des accessoires utiles schématisés sur une diapo 'powerpoint' . Pour prélever des échantillons solides un canif et une loupe sont utiles pour ne prendre que ce qui est strictement nécessaire et intéressant : pas la plante entière si seule une fleur vous intéresse : d'abord vous aurez moins de volume à porter et en plus vous serez respectueux de la nature. Pour les insectes : regardez la grille du radiateur de votre voiture après un trajet, l'été à la campagne, cela vous évitera de tuer les gracieux papillons. De petits sachets plastiques à fermeture par pression et numérotés sont très pratiques et tiennent très peu de place. Un carnet ou vous reportez leurs n° et endroits de prélèvement est indispensable surtout si vous voulez retourner sur les lieux d'une découverte intéressante. Dater également les prélèvements (au moins la saison) . Mais c'est sur les échantillons liquides que l'on peut faire le plus de travail sur site, pour éviter de transporter des litres (Kilos) . Petite anecdote , quand j'avais 12 ans, j'avais cru naïvement, qu'en remplissant une bouteille d'un litre d'eau de mer sur la plage j'allais découvrir des choses intéressantes. Certes j'y découvris mon premier copépode mais il était la SEULE créature de la bouteille. Depuis j'ai perfectionné ma technique et je récupère une centaine de copépodes dans un échantillon de 100 ml . Tout le mode pense au filet à plancton dont nous voyons parfois des images à la TV avec des armatures de plus d'un mètre et des récipients de l'ordre du litre, tractés sur des kilomètres par de puissants navires océanographiques . Vous pouvez en faire presque autant avec un filtre à café, un seau, et bien sûr l'accès à un port, rivière, étang ou mare. Pour les ports il est intéressant de prélever à marée haute qui apporte des espèces du large (j'ai bonne mine de parler de marée, moi, avec ma Méditerranée ! ) ou lorsque le vent vient du large, le 'marin' comme on dit. Vous pouvez monter (avec l'autorisation du propriétaire) sur une barque au raz de l'eau ou sur un ponton qui s'éloigne un peu de la berge . N'oubliez pas de regarder les vieilles amarres qui traînent en permanence dans l'eau : toute une faune et flore s'y développe . En paraphrasant le Chevalier de Lagardère 'si tu ne vas pas au copépode le copépode ira à toi' , voici une technique simple: prenez un de ces filtres à café (voir photo) en plastique rigide ou mieux, souple, que l'on trouve très facilement pour 3 € au supermarché (la maille se situe entre 50 et 200 µ) , un seau en plastique léger de 4 à 5 litres, genre seau de plage des enfants (j'en ai un avec la photo de Mickey Mouse mais ça marche aussi avec celle de Donald Duck…). Vous remplissez le seau de la main droite avec l'eau contenant vos présumés sujets et vous le versez lentement (sans faire déborder) dans le filtre tenu de la main gauche. Renouvelez l'opération 4 à 5 fois (d'avantage si l'eau est très transparente = peu de choses en suspension). A la dernière fois, avant que le filtre ne se vide complètement, versez l'eau résiduelle du filtre dans votre bocal échantillon (J'utilise un bocal de yaourt en verre grande taille avec un couvercle plastique réutilisable) . Retournez ensuite votre filtre à l'ENVERS au dessus du seau vide et faites couler sur l'envers l'équivalent d'un demi verre d'eau pour rincer l'intérieur du filtre. S'il est souple c'est plus facile de le retourner comme une chaussette. Vider ensuite le contenu du seau dans votre bocal échantillon (si trop d'eau utiliser un 2° bocal) . Regardez à contre jour : vous devriez déjà voir des choses qui nagent ou s'agitent. Bouchez les bocaux en laissant 1/3 du volume d'air au dessus du liquide et stocker au frais et à l'ombre : une petite glacière portable (avec un pack réfrigérant) est utile l'été MAIS elle doit être réservée à cet usage et pas question de la partager avec votre sandwich (risques de contamination). Le pack ne doit pas toucher les bocaux. Prenez un litre de la même eau non filtrée afin de diluer vos échantillons au labo. Imaginez qu'il y ait 2 créatures par litre sur votre lieu de prélèvement : pas évidentes à attraper ! vous avez filtré l'équivalent de 20 litres ( = 40 créatures) que vous avez concentrées dans 200 ml d'eau , ce qui équivaut à une densité de 200 créatures par litre : c'est nettement plus intéressant n'est ce pas ! CI dessus deux types de filtre et photo d'une maille. Restons sur le terrain : la nature à horreur du vide et la vie microscopique a besoin de supports pour prospérer: S'il y a des algues flottantes récupérez les (avec des gants) N'arrachez pas les algues fixées ! Posez les sur le filtre et versez dessus de l'eau pour bien les rincer : même procédure que plus haut pour rincer le filtre etc. Si les algues sont fixées 'peignez' les doucement sous l'eau avec par exemple le filtre lesté, en vidant le résidu à chaque fois dans le bocal. S'il y a des dépôts verdâtres sur les pierres, grattez les (par exemple avec le bord du couvercle du bocal et versez dans celui ci, idem avec le DESSOUS des feuilles de plantes immergées (nénuphars, ou l'envahissante jacinthe d'eau ). Cette méthode du 'grattage' peut être utilisée -discrètement- dans certaines mares artificielles, jardins publics voire bassins à poissons rouges décoratifs dans des jardineries (si, si ,j'ai osé le faire !). Parfois il est utile d'avoir une rallonge : une boite de film 35 mm fixée par un anneau de fil de fer au bout d'un tuteur pour plantes en bois ou plastique de 80 cm à 1 m est bien utile pour atteindre des algues ou la vase du fond sans tomber à l'eau ! Paradoxalement on arrive à prélever des espèces dont la taille devrait passer aux travers des mailles. L'explication est (voir photo ci dessus ) , que la matrice constituée par les fils a une surface importante par rapport aux mailles et capte aussi les plus petites espèces d'ou l'intérêt de bien rincer le filtre à l'envers pour les décrocher. Vous voici de retour chez vous : si votre prélèvement est très concentré : ça grouille et ça s'agite, de toutes parts, il faut le diluer sinon il n'y aura pas assez d'oxygène dissous pour tous et vos créatures (surtout crustacés) ne vont pas vivre longtemps. Si vous n'avez pas le temps de trier (en général il est déjà l'heure du repas !) Agitez doucement pour homogénéiser et fractionnez dans trois, quatre récipients plats ou plus (sans bouchon) en respectant la règle que la hauteur d'eau totale (diluante comprise) doit rester le tiers ou le quart du diamètre du récipient, ceci pour avoir une grande surface d'oxygénation. Si vous avez le temps vous pouvez commencer à trier les sujets les plus intéressants à faible grossissement dans une lame aquarium et les mettre dans les alvéoles de lames à puits pour les séparer ou dans un bocal plus petit . Parfois il est utile de séparer rapidement les prédateurs du genre hydre qui vous mangent allègrement les puces d'eau ! Si le prélèvement est clair : laissez le reposer tranquillement une heure ou deux, voire une nuit et prélevez ensuite délicatement au fond, sans faire de remous, ce qui se sera déposé . Pour étudier l'échantillon de façon exhaustive se reporter à la méthode décrite dans 'Aventures dans un jardin public' du même auteur dans la même collection ! Pour les irréductibles qui veulent à tout prix un filet à plancton voici un exemple : voilage pour rideaux (maille 200 µ) tendu sur armature en fil d'acier inox de 35 x 15 cm . Il est lesté par un poids de plomb (50 g) au fond et 30 g sur un bord afin qu'il puisse traîner à plat sur les algues du fond. (ne pas utiliser si grosses pierres au fond) Il est possible de le lancer à la main, le laisser dériver dans le courant et remonter doucement d'un mouvement continu en ne le laissant jamais repartir en arrière. Vous pouvez trouver des chutes de voilage chez des marchands de tissus pour rideau : apportez votre loupe pour voir la taille de la maille. Je suis sûr que vous allez améliorer ces quelques idées. Dans le même esprit voici quelques objets courants détournés de leur vocation , comme une tasse a thé en verre fin qui a juste la forme d'un Bécher, les pots de yaourts ou crèmes en verre bien transparents comme aquariums ou boites de pétri, un jeu de seringues graduées collées par la pointe sur des rondelles en bois, font des éprouvettes graduées pas chères , un flacon de médicament avec compte goutte fait un ensemble de prélèvement pratique à emmener toujours avec soi … -
MONTAGE DES LAMES J.M. CAVANIHAC Dans les observation microscopiques que nous faisons, entre pour une large part le hasard : certains organismes n'existent qu'en un seul spécimen dans notre prélèvement et nous resterons peut être des années sans en retrouver un autre... Que faire pour conserver une trace de ces observations uniques ? La première idée qui nous vient est de faire photos sur photos, avec des grossissements différents, voire réaliser une mosaïque d'image pour obtenir une vue globale du sujet . Mais est ce suffisant ?? Par exemple certaines espèces de copépodes ne se différencient que par la forme des appendices servant à la nage. Si ceux ci ne sont pas nets ou sont cachés dans le plan de prise de vue il sera impossible à posteriori d'identifier l'organisme uniquement sur photo. D'ou l'alternative, utilisée depuis des décennies, peut être aussi parce que la photo était trop chère, de conserver physiquement les objets en réalisant leur montage sur lame. Cette solution permet à tout moment de revoir le spécimen, de rechercher un détail qui aurait échappé à la photo, d'utiliser d'autres techniques d'observation : lumière polarisée, contraste de phase, DIC,... le jour ou nous aurons à notre disposition des microscopes plus sophistiqués... Première étape : Avant de placer définitivement le sujet entre lame et couvre objet (définitivement, car cet assemblage est difficilement démontable et entraîne en tous cas la perte de l'objet), il faut qu'il soit apte à se conserver le plus longtemps possible: pour cela la première opération est de le fixer (c'est le terme utilisé) en l'imprégnant de substances qui stoppent les processus de dégradation en général par dénaturation des protéines. L'agent fixant le plus connu est le formol, mais l'alcool peut être utile aussi (avec de moins bons résultats), de même que l'acide acétique . On aborde ici un des casses têtes du microscopiste amateur qui est de se procurer en faible volume (et faible coût !) ce type de produit. Les distributeurs de produits chimiques vous fourniront aisément 1 litre de formol ultra pur pour 25 € mais qu'en ferez vous, sachant qu'il polymérise au dessous de 17 ° avec le temps et devient inutilisable. Donc: formol en dilution de 4 à 10 % . Pour se dépanner : un produit désinfectant pour aquarium en vente dans les animaleries (évite les points blancs sur les poissons...) contient 4% de formol dans une de ses versions et 10 % dans une autre plus quelques milligrammes de désinfectant et un colorant. La concentration devrait convenir, mais j'avoue ne pas avoir trop de recul quant à la conservation. Un fixateur 'universel' est le picro formol de BOUIN qui est un mélange de 25 % formol, 70 % acide picrique et 5% acide acétique (en vente dans magasin spécialisé en microscopie ) Un classique : le Lactophénol mais en plus de l'acide lactique il contient du phénol qui est toxique. Idem magasin spécialisé. NB: le formol n'est pas anodin pour la santé et il faut éviter d'en respirer les vapeurs. Toutes les adjonctions de produits se font directement sur la lame afin d'éviter de manipuler des échantillons fragiles. Personnellement j'utilise le Bouin. Mais à défaut un mélange de 20 ml de vinaigre, 75 ml d'alcool à 90° (alcool pour désinfection d'instruments : pas pour soigner les plaies !) et 5 ml de glycérine est un conservateur acceptable utilisable avec des temps de fixation plus longs (une 1/2 heure à 1 heure ) mais non toxique. 2° étape : LAVAGE : eau distillée ou déminéralisée : très important surtout après utilisation du formol : tout résidu va rendre l'objet cassant à long terme et va aussi le décolorer. Si on souhaite colorer , c'est le moment. 2° étape et demie : facultative : Coloration : la 'bonne' coloration est celle qui permet de colorer spécifiquement certains tissus (et pas les autres) pour mettre en évidence des structures parfois trop transparentes (ex: noyaux cellulaires...). Là encore casse tête : mais deux colorants au moins sont facile à trouver : éosine (en grandes surfaces et parfois en dosettes très pratiques) et bleu de méthylène (pharmacies). A défaut on peut essayer les colorant liquide alimentaires (voir rayon préparation pour gâteaux !). Sans trop entrer dans les détails il y a deux modes de coloration : coloration progressive et régressive. Dans le premier cas on plonge l'objet dans le colorant et on surveille la coloration : on stoppe en rinçant quand la densité souhaité est obtenue. Dans la méthode régressive on sur- colore et on plonge ensuite dans un bain décolorant en surveillant cette fois la décoloration. Par exemple pour décolorer avec l'éosine utiliser 100 ml d'alcool à 70 ° dans lequel on a mis 1 ml d'acide chlorhydrique. Toujours bien rincer ensuite. 3° étape choix du milieu de montage: la suite du processus va dépendre du milieu de montage : il y en a de deux types : milieux aqueux et résines . La résine la plus connue est le Baume du Canada (résine naturelle d'un pin) : MAIS les objets doivent être parfaitement déshydratés par passages prolongés dans plusieurs bains d'alcool absolu puis du xylène (toxique ++) . La conservation est parfaite et les anciennes lames étaient montées ainsi. Ce traitement est un peu agressif pour de petits objets qui ne supportent pas bien la déshydratation : si celle ci n'est pas parfaite la préparation va se troubler sous le couvre objet et devenir opaque. A notre niveau et tout en acceptant une durée de conservation bien moins longue (4 - 5 ans au moins quand même) il existe une technique très simple, pas chère, pratiquement applicable à tous les objets, non toxique et sous certaines conditions permettant de démonter les lames . C'est la gélatine glycérinée (GG): encore une vieille recette, mais qui vous plaira car vous pouvez la faire vous même avec de la gélatine alimentaire en feuilles au rayon pâtisserie (encore !) des grandes surfaces (ou à partir de suppositoires à la glycérine ...mais je vois d'ici votre tête en allant en acheter à la pharmacie : rassurez vous, ils existent aussi en modèle 'enfant' et vous pourrez toujours prétexter que c'est votre petit dernier qui a des difficultés à évacuer...) Pour les suppos : très simple : faire fondre au bain marie et rajouter une quantité égale de glycérine, Laisser le produit se solidifier dans un flacon à large ouverture Avec les feuilles : Faire tremper 2 grammes de feuilles de gélatine dans 10 ml d 'eau pendant 2 heures. Faire chauffer au bain marie dans le flacon définitif (de préférence à large goulot, contenance 30 à 50 ml) jusqu'à ce que la gélatine soit fondue: ajouter alors 12 ml de glycérine et remuer longuement pour bien mélanger : laisser encore 5 minutes puis laisser refroidir. Ne pas laisser bouillir !. La gélatine se solidifie mais le mélange reste souple. Il est ensuite possible d 'en retirer des petits morceaux avec une pince à épiler. Ceux ci fondent vers 50 à 60 ° C ce qui permet d 'y inclure les objets sans trop les chauffer. Il faut au préalable imprégner les objets sur la lame avec du liquide glycériné et laisser évaporer un peu : les objets doivent être justes humides . Si nécessaire retirer l'excédent avec un coin de mouchoir en papier. On peut aussi poser quelques fragments de GG (pas plus gros qu'une lentille (pas optique mais le légume!) a proximité de l'objet et laisser fondre : la GG imprégnant alors l'objet. Comment chauffer ? le plus simple est quelques secondes au micro onde: la gélatine ne doit surtout pas bouillir : faites quelques essais préalables ! S'il y a des amateurs, je décrirais un petit accessoire chauffant alimenté en base tension permettant de fondre la gélatine sur votre bureau lui même. Il y a une petite astuce pour éviter d'emprisonner les bulles, c'est d'appuyer la lamelle sur une aiguille avec l'autre côté trempant dans la gélatine fondue , puis de baisser l'aiguille tout en la retirant doucement comme indiqué ci dessous. Après cela vous pouvez observer au microscope et voir si le sujet n'a pas bougé, s'il n'y a pas de grosses bulles d'air (< à 1 mm) (sinon la dilatation de celui ci finira par décoller la lamelle) . Si c'est vraiment raté vous n'aurez pas gaspillé lame et lamelle : plongez le tout dans un verre d'eau très chaude et la GG fondra libérant ces deux éléments ! S'il n'y a pas assez de gélatine c'est rattrapable, : poser un petit fragment contre le bord du couvre objet où se trouve le manque et remettre à chauffer doucement : en fondant la GG passera sous le couvre objet par capillarité . Par contre si tout vous paraît bon, lorsque la gélatine a durci, bien nettoyer avec une vieille brosse à dents sous un filet d'eau bien froide les excédents de gélatine, laisser bien sécher puis passer une couche de vernis (à ongle incolore ou... à paillettes si vous voulez faire 'Disco' ! : le vieux vernis un peu épais que votre copine ou épouse ne peux plus utiliser est parfait ) ou de peinture à maquette (séchage rapide) à cheval sur le bord du couvre objet et la lame pour éviter toute évaporation. N'oubliez pas d'identifier le sujet sur l'étiquette de la lame, date, et mode de préparation. Pour trois francs six sous, avec du carton fort vous pouvez vous constituer des boites de rangement comme ci dessous: Je vous entends déjà demander : et le montage des protozoaires ? : il est extrêmement difficile car ils se contractent ou explosent lors de la fixation ou du montage. Vous pouvez essayer de faire des frottis en mélangeant très peu de NIGROSINE ou à défaut d'encre de chine à l'eau ou ils se trouvent sur la lame étaler, et sécher TRES rapidement. Mais çà marche un coup sur dix.
-

LIvrets d'utilisation pour microscopes
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
LIVRETS D'UTILISATION POUR MICROSCOPES Jean-Marie Cavanihac Dans un précédent article sur les microscopes 'jouets' que l'on peut facilement acquérir (et pour les autres aussi !) je déplorais l'absence de petits fascicules expliquant les réglages optimum à réaliser, mais surtout fournissant des idées de choses à voir et indiquant comment les préparer pour réaliser des observations intéressantes. Il est vrai qu'on ne trouve plus aujourd'hui que quelques petits livres illustrés - très basiques - à l'attention des plus jeunes mais il n'en a pas toujours été ainsi , et prenons donc notre machine à remonter le temps - disons 30/50 ans en arrière - pour retrouver quelques ouvrages d'initiation bien conçus . Au delà de leur caractère pédagogique leur grande force était de permettre une identification relativement précise des sujets rencontrés. Vous conviendrez qu'il est particulièrement frustrant d'observer un organisme - par exemple une euglène - qui est verte mais qui bouge rapidement et de se demander si c'est un végétal ou un animal avant d'essayer d'en déterminer l'espèce . (Là je suis dur avec vous car ce n'est ni l'un ni l'autre : c'est un Protiste ! A l'école primaire on apprenait qu'il y avait trois règnes : minéral, végétal et animal et tout était clair. Maintenant il y a 5 règnes du vivant (tout augmente ! ). Aujourd'hui nous avons toute la puissance des moteurs de recherche d'Internet, pour approfondir nos connaissances mais encore faut il savoir où chercher et surtout QUE chercher . De trés bonnes bases de données biologiques sont uniquement descriptives (texte) et sans être aussi exhaustives les images nous sont quand même d'un accés plus rapide . Voilà à quoi ressemble une Euglène : ci dessus x 40 , à droite x 15 , fichier vidéo AVI converti en Gif animé; (comme on dit, là ou il y a de l'euglène , il n'y a pas de plaisir ! étant donné qu'elles fréquentent surtout les eaux polluées … Bon d'accord, j'arrête les mauvais jeux de mots !) Voici mon premier ouvrage de microscopie , dans les années 60. Il est un peu détérioré car ouvert maintes et maintes fois , mais il était écrit par un passionné (Henri COUPIN) et illustré de plusieurs planches dessinées à la main permettant d'identifier comme celle montrée ci contre, des animaux aquatiques. Couverture de l'ouvrage Un autre objet du passé : un coffret de réactifs de la même époque :. Le coffret comprend du fixateur , des colorants et un milieu de montage, (Picroformol de Bouin's , acide acetique , hypochorite, safranine, gélatine glycérinée , bitume de Judée ) plus quelques instruments : aiguille lancéolée, verre de montre, … ET un petit livret très bien fait indiquant l'usage des produits et la manière de s'en servir . (j'ai retrouvé quasiment le contenu intégral de ce livret sur un site internet d'un distributeur de microscopes étranger !) Plusieurs années plus tard , j'ai acheté dans un magasin Parisien spécialisé en Astronomie et Microscopie un autre ouvrage, d'aspect plus sérieux et plus ancien, dont je me demande toujours si c'est une édition originale d'époque ou une copie : mais vu la couleur jaunie des pages je penche pour la première hypothèse . Il a été écrit en 1947 par un scientifique, G. DEFLANDRE, Professeur au Collège de France (pas moins) qui se désolait déjà de la perte d'attrait pour la microscopie . Il est particulièrement intéressant car documenté avec plus de deux mille dessins à la plume répartis par familles. A cette époque d'éminent professeurs n'hésitaient pas à réaliser de tels ouvrages de vulgarisation . On s'étonne de nos jour de ce que la science effraie les gens, mais encore faudrait il qu'il y ait des personnes de confiance qui se donnent la peine de vulgariser et d'expliquer…. Couverture de l'ouvrage et l'une des quelques planches en couleur Mais essayons d'être constructifs : c'est peut être le rôle des E-zines (magazines électroniques ..) comme Microscopies, MikrOscOpia ou encore Micscape de prendre le relais de ces ouvrages avec en plus non pas un seul auteur mais une multitude de participants (vous !) explorant chacun des domaines différents et complémentaires. J'ai essayé, modestement, pour ma part de constituer une base de donnée en images permettant l'identification des organismes observés (les plus courants du moins ) et donnant quelques notions de microscopie dont un essai de microscope virtuel. A l'origine c'était pour mes enfants mais il grandissent plus vite que ce que j'arrive à faire (et il est vrai aussi que j'ai toujours de nouvelles images à y ajouter ) . Le dossier , sur CD ROM, est réalisé sous Microsoft Power Point, logiciel bien connu pour animer des présentations. Les images sont incluses dans les fichiers 'présentation' , les liens entre pages sont faciles à faire et il y a quelques effets d'animation. Une vingtaine de vidéo est accessible ainsi qu'un Quizz. Ce logiciel est intéressant car la visionneuse (gratuite) est installée sur le CR ROM ce qui permet une exécution automatique des quatre fichiers 'présentation ' totalisant 30 MO Ci dessous sont présentés en format 'timbre poste' quelques uns des écrans des 150 diapos comprenant plus de 400 images. C'est particulièrement agréable à utiliser car on peut y introduire une part d' interactivité . (zoom sur image, liens avec un lexique, navigation par thèmes en cliquant sur les objets dans le bureau du navigateur …) Ce serait une bonne idée d'en faire de même sur votre ordinateur (même si vous n'avez pas de graveur de CR ROM) . Il y a de nombreux logiciels freeware qui permettent d'organiser des albums de photo . (NB : la qualité des images est meilleure que dans un format HTML et vous avez bien moins de fichiers à gérer) C'est une activité créative : essayez la, car elle oblige à rechercher des données pour identifier les espèces (voir sur le Net …) et vous découvrirez des tas de choses j'en suis sûr. Une fois fait, oubliez votre travail quelques mois, puis, un jour d'hiver gris et pluvieux, lancez votre logiciel et vous serez étonné de ce que vous avez réalisé . Vous pouvez même rajouter votre nom au générique comme producteur, réalisateur, conseil scientifique, caméraman, responsable des effets spéciaux et bien sûr … spectateur ! -

Débuter les observations microscopiques - sujets à voir
Jean Marie Cavanihac a répondu à un(e) sujet de Jean Marie Cavanihac dans Jean Marie CAVANIHAC
DEMARRER EN MICROSCOPIE - II Que voir ??? (suite) par J.M. CAVANIHAC - allez visiter les pièces d'eau dans votre jardin public, jardin tout court, vasques des fontaines de villages, anciens abreuvoirs, anciens lavoirs...bref, partout ou il y a de l'eau et des dépôts verdâtres : ne prenez pas que de l'eau mais grattez ces dépôts, prélevez un peu de vase au fond , des filaments d'algues flottantes ... vous en aurez au moins pour une bonne semaine d'observation entre les diatomées, protozoaires, puces d'eau, rotifères, ostracodes, larves d'insectes copépodes d'eau douce, amibes et j'en passe ...! images: de gauche à droite et de haut en bas : clostérium, cosmarium (x 40), pediastrum, spirogyres, daphnie (puce d'eau) , ostracode, copépode d'eau douce, au 15 x - prélevez des mousses vertes humides (attention ! : pas des lichens qui sont secs et mettent plusieurs années à pousser ) imprégnez les d'eau, laissez reposer une nuit et pressez les comme des éponges : vous trouverez dans l'eau qui s'écoule des rotifères, vers, tardigrades (plus rares...) Rotifères : lecane, rotifer vulgaris, ver nématode, 2 amibes, objectif 15 x - pour ceux qui ont la chance de vivre prés de la mer : observer des vieilles cordes ou morceaux de bois immergés et prélever quelques algues qui poussent dessus : en les agitant dans de l'eau de mer vous ferez tomber des diatomées aux formes extraordinaires : laissez décanter et observez : vous aurez probablement une douzaine de copépodes , de petits crustacés ou de larves diverses en prime... images : diatomée coscinodiscus, striatella, gyrosigma, larve pluteus d'oursin - grattez un peu les poissons (pas les surgelés panés !) et observez la diversité des écailles: écailles de limande ici : (mosaique 6 images x 15) Juste une dernière recommandation , sans faire trop 'écolo' ( je suis pourtant de la génération 68 … Bonjour l'ancêtre !…) ne prélevez pas trop d'échantillons : inutile d'arracher une plante entière pour récolter des poils ou du pollen (une fleur ou une feuille ou deux suffisent) ou un kilo de mousse pour voir des rotifères. Respectez la nature, il y a déjà assez de gens qui la dégradent. Idem avec les prélèvements liquides, mais là c'est vous qui serez bien ennuyés quand il faudra transporter des litres ! . Essayez plutôt de concentrer les prélèvements sur place par filtration (tissu fin, vieux collants…) et diluer le résultat dans 100 ml d'eau locale. Dernier point et là, c'est très important : éviter les prélèvements dans des zones à risques, en particulier à la campagne : pollution par le crottin, lisier ou fosses septiques avec des micro organismes PAS DU TOUT SYMPATHIQUES pour nous: virus de l'hépatite A ou bien le Bacile du Tétanos par exemple . Portez des gants à usage unique (en latex : pas en plastique thermo-soudé car étanchéité = 0) , désinfectez votre matériel de prélèvement et d'observation après usage (trempage prolongé dans eau javellisée par exemple, ou alcool à 70° ) . Ne remplissez jamais une pipette en aspirant avec la bouche: utilisez une poire en caoutchouc (cela va sans dire mais mieux encore en le disant..) . Attention aux coupures sur les doigts (celles faites par des morceaux de couvre objets sont souvent invisibles...) qui peuvent s'infecter avec des échantillons contaminés. Si ces quelques images ne vous ont pas définitivement convaincus de l'infinie diversité du monde microscopique et des heures passionnantes que vous pourrez passer à ramasser des échantillons, observer, classer, identifier …faire des découvertes inattendues (même dans des endroits ou vous êtes passés dix fois, car les organismes changent selon les saisons…), alors laissez tomber, utilisez votre microscope comme presse papier et scotchez vous devant la télé ….! -

Débuter les observations microscopiques - sujets à voir
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
DEMARRER EN MICROSCOPIE - I Que voir ??? par J.M. CAVANIHAC Le monde microscopique est un univers fascinant et sans cesse renouvelé : le microscope est même devenu le symbole du scientifique. L' attrait était tellement vif, fin 19 ° début 20° siècle, que la microscopie était presque devenue une activité de 'salon' , ... à une époque ou la science était 'amusante' et ne faisait pas encore peur… Cet attrait n'a pas toujours été aussi marqué en France que dans d'autre pays et il faut saluer la présence de sites sur internet tels que MikrOscOpia, ou Micscape qui pourraient avantageusement remplacer ces petits ouvrages d'initiation de l'époque qui contenaient de merveilleux dessins à la plume représentant les organismes que l'on pouvait observer. A voir les kits de microscopes qui fleurissent à l'époque de Noël et leur prix défiant toute concurrence, il y aurait, semble-t-il, toujours un attrait potentiel de la microscopie pour les plus jeunes. Hélas ces microscopes ont beaucoup de pièces en plastique (y compris parfois les lentilles !) ce qui leur confère une faible qualité optique, aggravée par le manque de rigidité du statif : Il est rarement possible de les utiliser au delà d'un grossissement de 100 fois. Mais il est surtout regrettable qu'il n'y soit joint aucun fascicule qui donne des conseils sur la façon de préparer les objets ainsi que des idées de choses à découvrir . Et croyez moi on peut passer à coté de beaucoup de choses intéressantes , et être déçu, y compris par un microscope de prix. Première recommandation : le microscope voit au travers des objets ce qui signifie qu'ils doivent être les plus transparents possible à la lumière : pour ce faire il faut qu'il soient les plus minces possibles ET/OU qu'on les rende transparents. Première condition qui peut être réalisée avec l'utilisation d' un microtome, mais qui n'est pas indispensable pour commencer. Par contre il est FONDAMENTAL de transpariser les objets : comment ? simplement par l'observation en milieu liquide. Faites ce test : posez quelques grains de pollen de fleur sur une lame à sec et à l'observation vous ne verrez que quelques tas noirâtres très décevants. Mais posez les dans une simple goutte d'eau avec le couvre objet par dessus pour réduire l'épaisseur , et toute la richesse de leurs détails vous apparaîtra. Convaincus ?? . Certains objets sont un peu difficile à mouiller (insectes...) Voici une recette ancienne mais simple d'un liquide glycériné , qui évite aussi à vos objets de sécher pendant plusieurs jours : mélanger 1/3 eau distillée, 1/3 glycérine, 1/3 alcool à 70° et bien agiter. On peut utiliser pour faire 30 ml de solution : 8 ml glycérine, 10 ml eau et 12 ml alcool (pour compenser l'évaporation de l'alcool et la viscosité de la glycérine) Si on veut faire encore plus simple, sans aucuns additifs,, il suffit de prélever un goutte dans les dépôts verts que l'on trouve au bords des ruisseaux, fontaines ou bords de mer ...nous y reviendrons Deuxième recommandation : toujours démarrer au plus faible grossissement pour repérer toute la surface à explorer, centrer les zones les plus intéressantes au milieu du champ de vision et passer ensuite aux objectifs de grossissement supérieur. Ne pas fantasmer sur les très forts grossissements : les observations les plus intéressantes se font avec les objectifs de 4 à 20 fois . Le 10 x est vraiment universel . L'usage du 40 x ou du 60 x ne se justifie que dans 15 à 20 % des cas. Privilégier aussi le réglage de l'éclairage qui est très important et utiliser le diaphragme pour limiter l'éclairement juste au champ couvert par l'objectif (et PAS PLUS) pour obtenir le meilleur contraste : un objectif de 4 x possède un champ de vision d'environ 4 mm alors que celui de 40 x est de moins de 0,5 mm. Par ailleurs la fermeture du diaphragme augmente la profondeur du champ de vision. Pour reprendre le thème de l'introduction, il m'arrive souvent de voir des adolescents qui ont un microscope qui pourrait leur servir à un bon début même s'il n'est pas très performant, mais qui n'ont aucune idée de ce qu'il pourraient voir avec . Pourtant avec un peu de réflexion, les sujets sont innombrables si on leur applique un minimum de préparations telles que décrites ci dessus. En résumé on peut observer n'importe quoi mais pas n'importe comment. Quelques idées en vrac : (mais pour ne pas ralentir le chargement de la page, les image sont été 're-samplées' dans des format plus petits ) et celle ci divisée en 2 parties - dissoudre une cuillère à café de sel de cuisine dans un verre d'eau tiède, bien remuer, laisser reposer, prélever une goutte, laisser évaporer sur la lame (sans couvre objet ) et observer les belles cristallisation cubiques régulières. - fibres de tissu, laine, lin, coton, soie, synthétique… avec un peu d'habitude vous deviendrez un vrai détective… - vous avez bien un papillon ou deux coincés dans la calandre ou sous l'essuie glace de votre voiture : prélevez de la poussière des ailes (écailles ..), trompe, pattes, oeil à facettes... Photos ci dessous : écaille des ailes, facettes de l'œil (15 x) Acarien (15 x) - poils des plantes (hé oui ! elles en ont aussi..) : regardez les plantes même sauvages, même sur votre balcon, géraniums, lierre, chrysanthèmes…, et en détachant un petit morceau d'épiderme avec une pince à épiler, (plus facile sur les tiges que sur les feuilles ) que vous placerez dans une goutte de liquide, vous découvrirez une grande variété de poils aux formes plus extraordinaires les unes que les autres... - grand classique : les cellules de l'oignon : (ne soyons pas sectaires ça marche aussi avec l'ail, même si l'épiderme est un peu plus difficile a détacher). Savez vous que si l'oignon a un peu 'germé' et si vous prélevez à proximité des parties vertes vous pourrez aussi voir des stomates ?: dernière image colorée à l'éosine, les autres images sont de droite à gauche :poil de chrysanthème, poils de feuilles, (ne me demandez pas l'espèce !) - prélever un peu d'eau dans un vase de fleurs où elles ont séjourné un jour - ou mieux deux - (sans changer l'eau ), gratter la tige immergée des fleurs : protozoaires à gogo... quelques protozoaires fixes (pour changer …) : peritriche, opercularia, vorticelle, suctoria, Suite dans le prochain article.... -

Quelques belles larves du plancton marin - 2
Jean Marie Cavanihac a posté un sujet dans Jean Marie CAVANIHAC
Il y a 16 ans j’avais déjà fait un article sur un sujet similaire, mais depuis j’ai pu rencontrer d’autres images plus intéressantes, à partager avec les lecteurs de Mik-mag .Ces images montrent comment la métamorphose peut modifier l’apparence de la forme adulte par rapport à celle de la larve à tel point que la correspondance n’est pas toujours simple à réaliser. Les exemples ci dessous montrent des formes larvaires qui, du moins pour moi, sont plus agréables à voir que les adultes (mais vous savez, les goûts et les couleurs… !) Il s’agit d’images de spécimens vivants, relâchés ensuite dans leur milieu. Un de mes sujets préféré est l’oursin qui est à lui tout seul une mine d’observations (voir article à son sujet ). L’adulte ici à droite est couvert d’épines mobiles (elles sont montées sur une sorte de rotule) aidées par des podias souples équipés de ventouses qui servent donc aux déplacements et à la fixation sur les rochers. A gauche nauplius d’echinocardiun cordatum. L’adulte n’est pas de la même espèce Ci dessous nauplius de l’oursin adulte vu ci dessus, avec un très jeune adulte où l’on distingue les prémisses des piquants et des podias …L’image de gauche est prise en lumière polarisée qui mets en évidence la structure calcaire des bras de la larve . Les tuniciers sont des organismes filtreurs, aspirant l’eau de mer par un siphon et la filtrant pour se nourrir, au travers de fentes ciliées que l’on voit bien sur l’adulte. La larve d’ascidie ci dessous est probablement celle d’une claveline Un autre tunicier, le botryllus . La larve nageuse est à gauche et à droite une première étape de métamorphose après fixation (Eclairages Rheinberg) A gauche un jeune adulte montrant un siphon sur sa droite et les premières traces de pigmentation. Image de droite une colonie d’adultes (in situ) : Balanus : Un cirripède, peut être le moins sympathique organisme de cette collection, l’adulte possédant des plaques calcaires plutôt tranchantes pour nos pieds ! La forme larvaire nauplius se transforme en larve cypris, qui ne s’alimente pas jusqu’à ce qu’elle se fixe et se transforme en adulte : le lien ci joint de l’ancien article montre une animation de balane capturant des particules alimentaires avec ses cirres : http://www.microscopies.com/DOSSIERS/Magazine/Articles/JMC-Larves2/larves2.htm Un autre cirripède : la larve de Peltogaster paguri , qui pourrait disputer à la balane son rôle peu sympathique ! Elle est très élégante, le corps étant entouré d’un flotteur de forme torique. Malheureusement, après plusieurs métamorphoses, l’adulte l’est moins puisqu’il s’agit de la sacculine qui est un parasite du crabe et des bernard l’hermites (pagure) et comme son nom l’indique prends la forme … d’un sac à l’extérieur de l’hôte. (dans le hit parade de la beauté, là, on touche le fond ! ). Mais le pire c’est que cet adulte étends des ramifications à l’intérieur pour prendre le contrôle total de l’hôte qui ne vit plus alors que pour nourrir le parasite ! Pour la petite histoire j’ai mis 19 ans avant de pouvoir mettre un nom sur cette larve peu commune .. Image composée manuellement à partir de 8 images élémentaires Les Crabes ont deux étapes larvaires: Zoea puis Megalops : illustrées ci dessous : le stade megalops ressemble déjà à un adulte avec la partie caudale qui va se résorber. A gauche le stade Zoea est photographié en éclairage de Rheinberg et a droite il s’agit d’un échantillon conservé depuis 22 ans ! (coloration éosine) BONUS ! une larve d’une créature que je n’avais jamais trouvée pendant vingt ans de récolte d’échantillons ! larve d’ Amphioxus (lancelet) . L’adulte est difficile à prélever car il s’enfonce dans le sable : on voit les deux premières fentes ciliées Encore plus étrange est la forme de la larve du ver phoronide aussi appelé ver « fer à cheval » car les tentacules de son lophophore sont disposées en forme de fer à cheval ) . La larve que j’avais prélevée à l’époque s’est métamorphosée dans son mini aquarium pour donner le jeune adulte ci dessous ! On distingue sur l’adulte le tube digestif, deux gros vaisseaux sanguins et le lophophore à droite La larve ci dessous et l’adulte (à 15 ans d’intervalle) ne sont pas de la même espèce ! Un dernier ver (pour la route ? !) Larve pillidium du ver : Nemerta . La plus longue espèce atteindrait 55 mètres . Deux images prises à des niveaux de focalisation différents. La masse sombre au centre est le jeune adulte en développement : Mots clés : larve, oursin, phoronide, pilidium, nemerta, balanus, nauplius , botryllus , ascidien, porcelanosa, peltogaster, tunicier, amphioxus, zoea, megalops -

Pourrissement pêche agents responsables
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Dominique J'ai ça : https://nematode.unl.edu/key/nemakey.htm Mais il me semble que j'avais téléchargé des planches détaillées... Faut que je cherche dans le DD ! Amités JMC -

Pourrissement pêche agents responsables
Jean Marie Cavanihac a répondu à un(e) sujet de Dominique. dans Dominique
Bonjour Très instructif ...Le petit vers évoque un nématode, un détail de la tête à plus fort grossissement pourrait aider à identifier l'espèce .. (pas facile je sais, ça se tortille beaucoup !) . Amitiés JMC


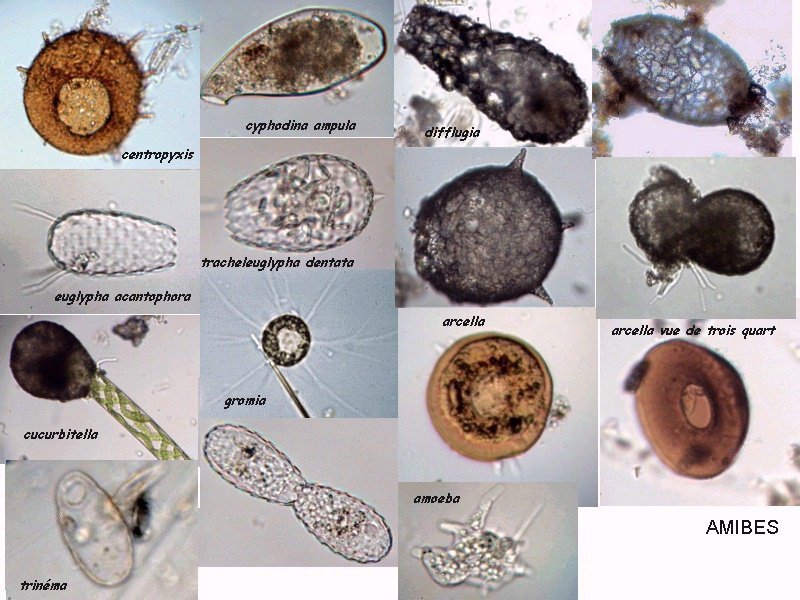

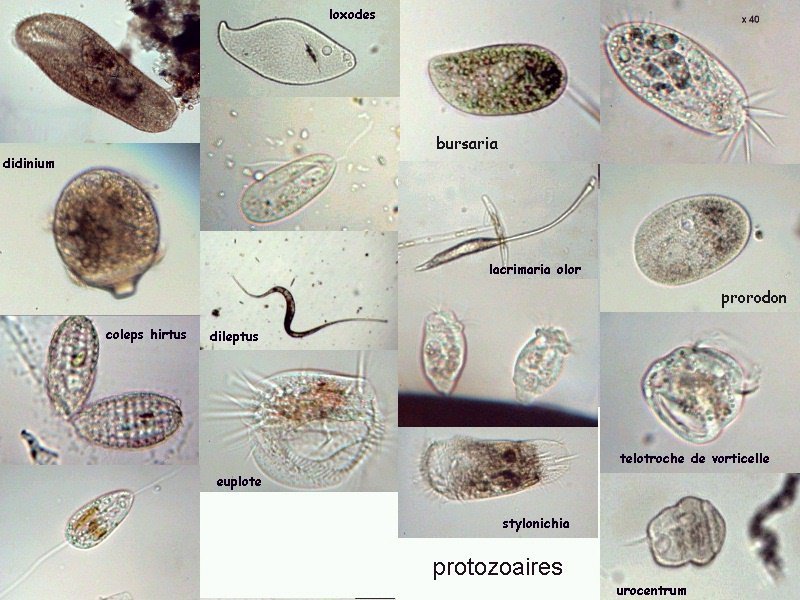
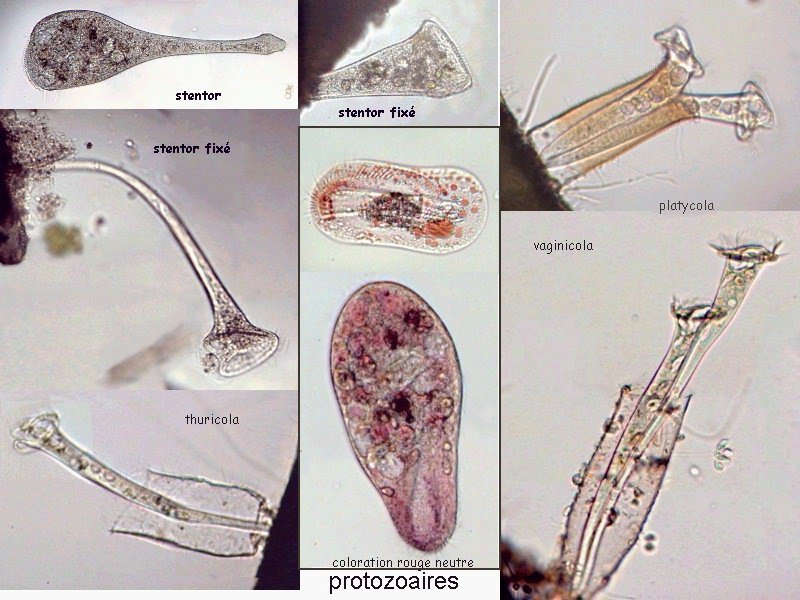
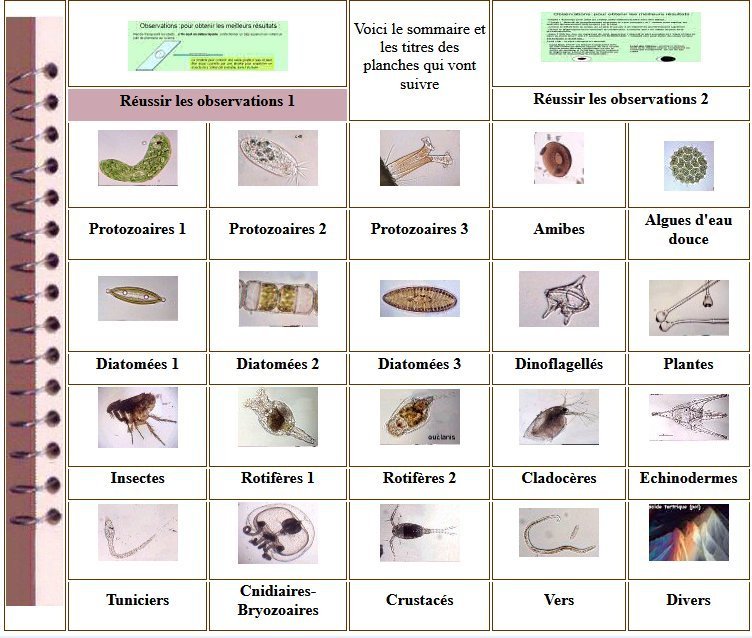
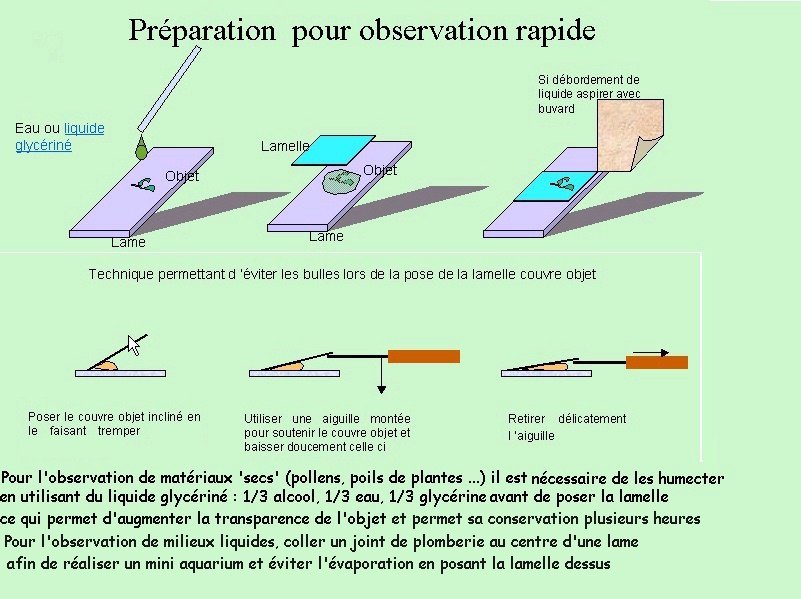
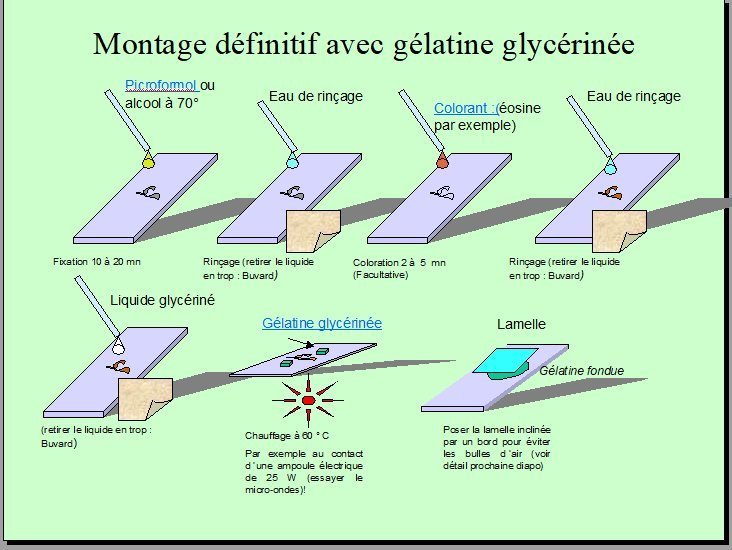
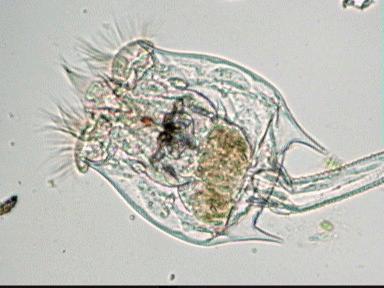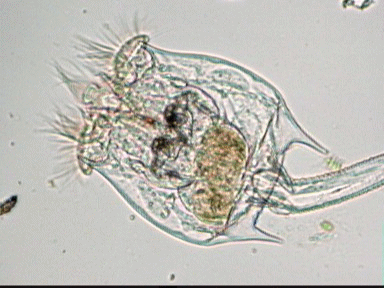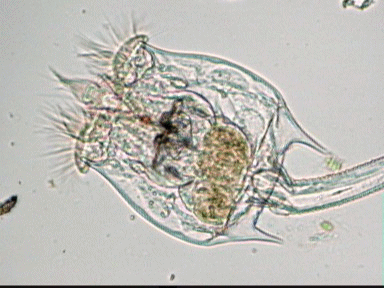
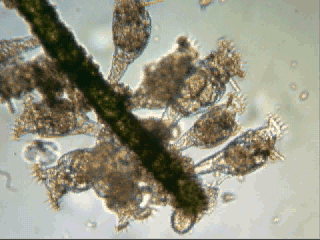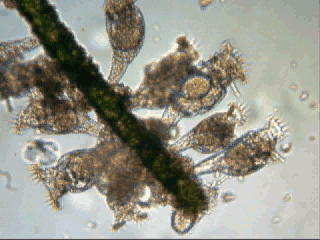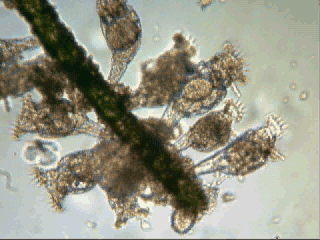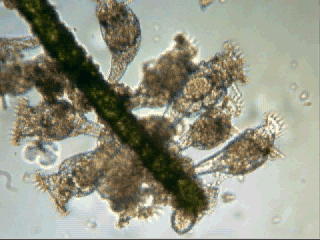

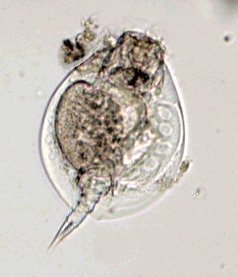
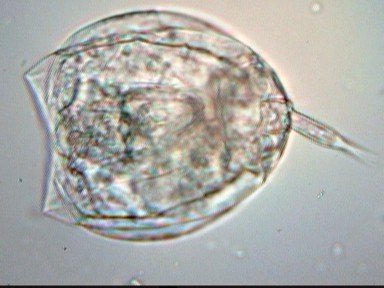
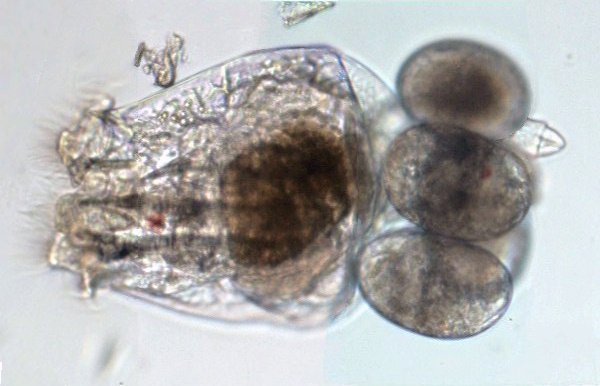
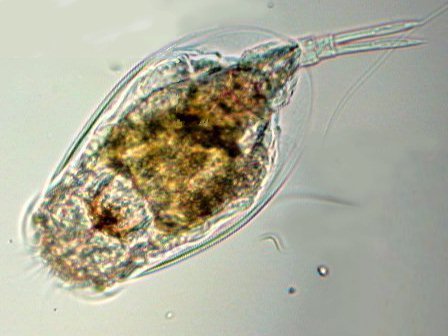
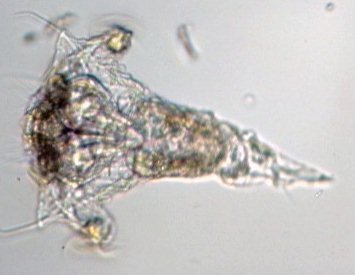
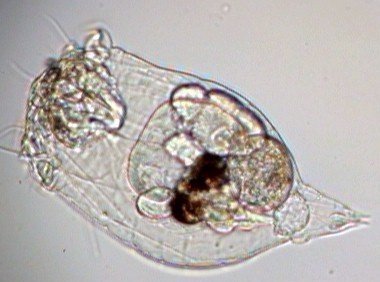
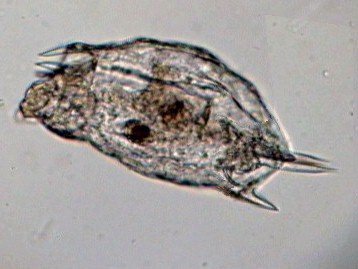
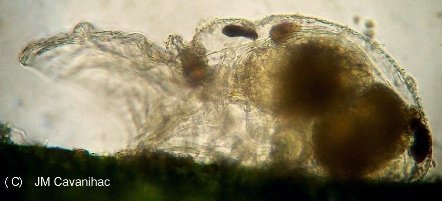
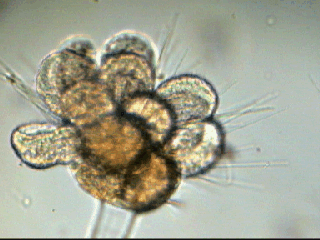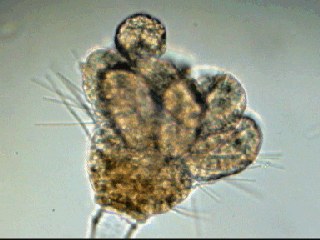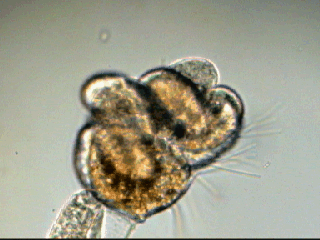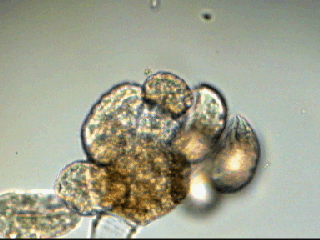



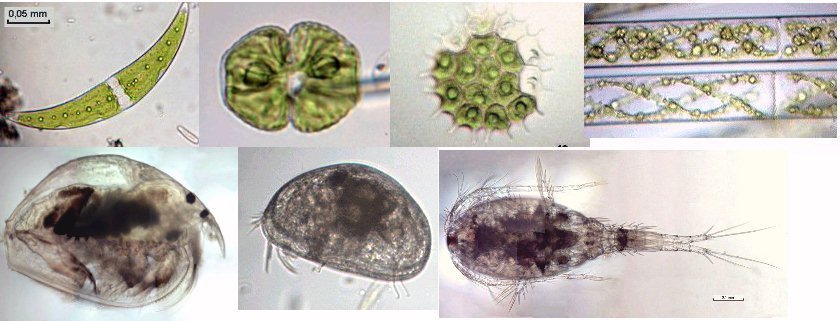
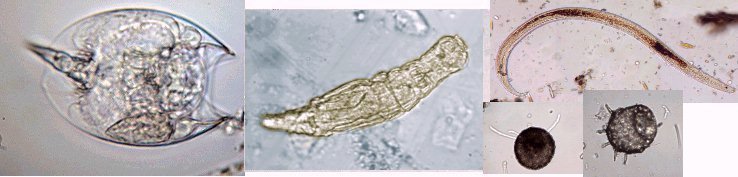
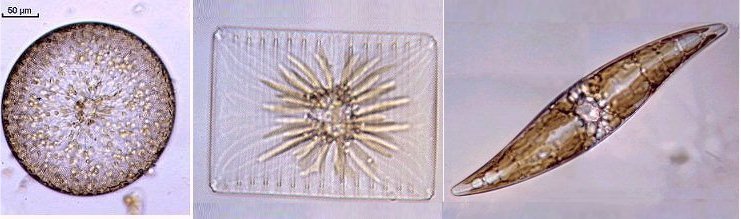
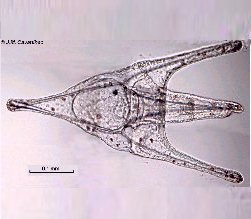
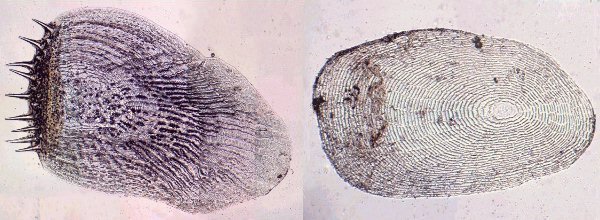


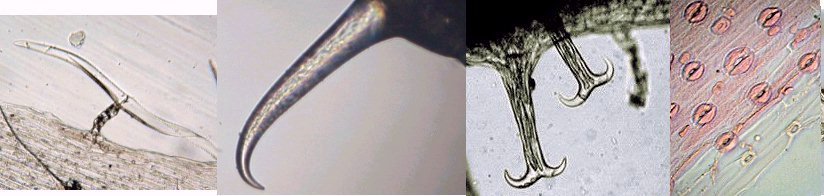
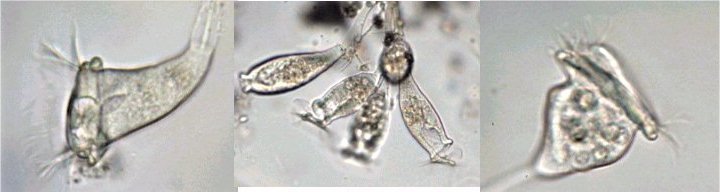

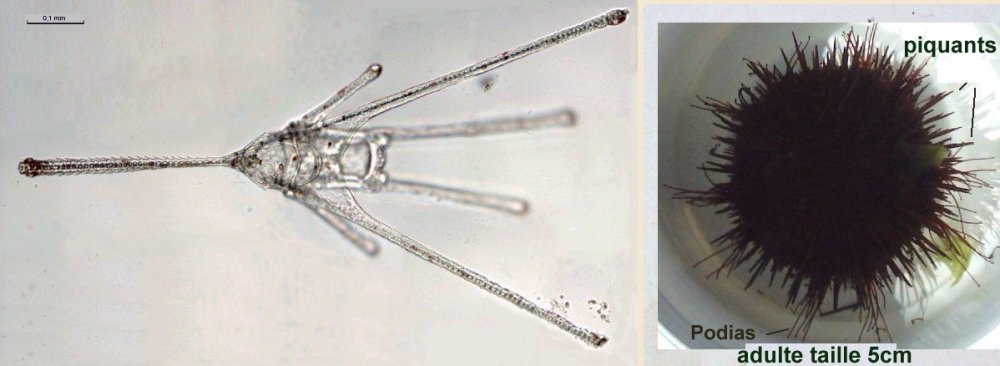
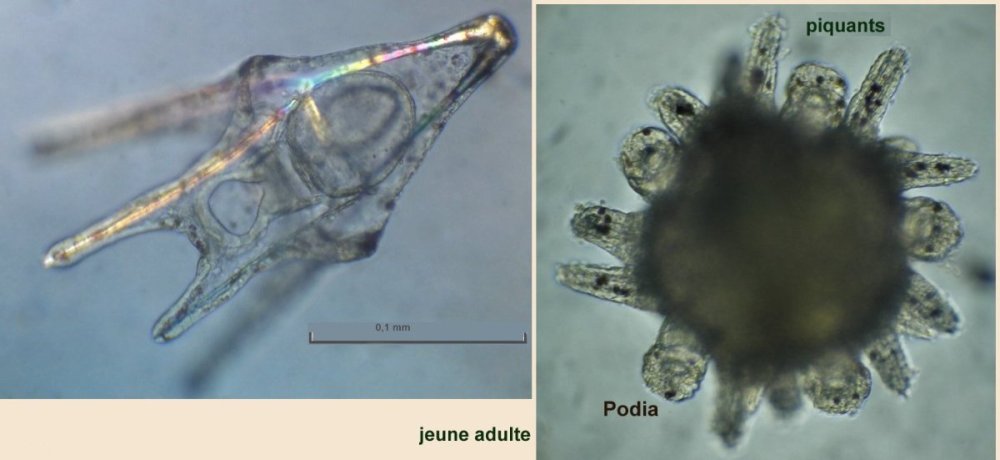
.jpg.50587068754dea901aef78879673a9d4.jpg)